罗红霉素抑制COPD大鼠炎性介质释放对糖皮质激素抵抗的影响
2018-07-06张松,黄茂
张 松,黄 茂
0 引言
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是一种以呼吸道气流受限为主要特征的肺部疾病,其病死率及死亡率均较高,且呈逐年上升趋势[1-2]。COPD本质上属于气道慢性炎症性疾病,故治疗以抗炎为主。糖皮质激素抗炎作用强大,在COPD治疗中有着广泛应用。然而,临床观察显示,部分患者即便采取大剂量糖皮质激素治疗,效果也极不明显,提示患者体内可能存在某种机制,引起机体对糖皮质激素的敏感性降低,即为糖皮质激素抵抗[3-5]。糖皮质激素与糖皮质激素受体(Glucocorticoid receptor,GR)结合后方发挥抗炎作用,近年研究发现,GRα型受体是糖皮质激素发挥效应的主要受体,而GRβ型受体则是内源性糖皮质激素效应的拮抗因子,激素抵抗型哮喘患者GRα表达下调、GRβ上调,因此,推测 GRα/GRβ失衡是造成COPD患者糖皮质激素抵抗的重要原因[6-7]。罗红霉素是新一代的大环内酯类抗生素,临床公认其在COPD治疗中可发挥良好的抗炎作用,然而关于其是否能够逆转糖皮质激素抵抗,国内尚未见相关报道[8]。本研究旨在探讨罗红霉素抑制COPD大鼠炎性介质释放对糖皮质激素抵抗的影响,现报道如下。
1 材料与方法
1.1 实验动物 SPF级雄性裸大鼠40只,体重18~22 g,月龄4~6个月,由北京维通利华实验动物有限责任公司提供,动物编号:SCXK(沪)2015-0002;饲养于我院动物中心实验室SPF环境中,温度(24±2)℃,湿度30%~60%,常规自由饮食,每天日照12 h,通风良好。实验时对实验动物的处理方式符合动物伦理要求。
1.2 药物与试剂 罗红霉素(江苏云阳集团药业有限公司),ELISA检测试剂盒(武汉转导生物实验室),兔抗大鼠GRα多克隆抗体、GRβ多克隆抗体(北京维亚生物技术有限公司),RT-PCR试剂盒[赛默飞世尔科技(中国)有限公司],GRα、GRβ引物(北京博大泰克公司),通用型SP免疫组化试剂盒(上海信裕生物科技有限公司),DAB显色试剂盒(上海威奥生物科技有限公司),苏木精(美国Sigma-Aldrich公司),伊红(上海抚生生物科技有限公司)。
1.3 实验方法
1.3.1 试验分组 饲养1周后,选取30只环境适应良好的大鼠,对大鼠进行编号,并采用随机数字表法分为3组,即空白组、模型组、罗红霉素组,每组10只。
1.3.2 建立模型 模型组与罗红霉素组:分别于第1、31、61天由气管灌注0.2 ml 1.0 g/L的脂多糖溶液,并于2~30 d、32~60 d、62~90 d等3个时间段内将大鼠置于60 L玻璃熏咽箱中被动吸烟,6 h/d。空白组:不予以建模(以0.2 ml生理盐水与新鲜空气处理)。
1.3.3 干预 模型组:由第91天起予以生理盐水灌胃,2 ml/次,1次/d,连续30 d。罗红霉素组:由第91天起予以罗红霉素灌胃,剂量为30 mg/kg,1次/d,连续30 d。空白组正常饲养,不予处理。30 d后,行大鼠解剖处理,采集大鼠腹主动脉血2 ml,静置、离心取血清;分离大鼠右肺前叶,留取肺组织。
1.3.4 炎症因子检测 采用ELISA试剂盒检测血清白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白-1(MCP-1)水平,严格按照ELISA试剂盒进行操作。
1.3.5 肺组织观察 取适量肺组织,经固定、包埋、切片等处理,并予以HE染色后,采用光学显微镜观察大鼠肺组织病理形态学变化。
1.3.6 肺组织GRα、GRβ mRNA表达水平测定 采用RT-PCR法进行检测。取肺组织,适当研磨,提取RNA,反转录为cDNA。GRα上游引物、下游引物分别为5′-TCCAAAGCCGTTTCACTG-3′、5′-CAAGAGGTCAAAGGTGCT-3′;GRβ上游引物、下游引物分别为5′-TGGTTTCCTGTTCGCTCT-3′、5′-TGGTTTCCTGTTCGCTCT-3′;GAPDH上游引物、下游引物分别为5′-GTTCAACGGCACAGTCAA-3′、5′-CAGATCCACAA
CGGATACA-3′;GRα、GRβ、GAPDH扩增片段为348、266、571 bp。PCR扩增:取反转录产物2 ml,上游引物1 μl,下游引物1 μl,10×Easy Tag Buffer(含Mg2+)5 μl,dNTPs 4 μl,Easy Tag DNA Polymerase 0.5 μl,加ddH2O至50 μl。扩增完成后行琼脂糖凝胶电泳,经EB染色,紫外线投射仪下对电泳条带进行观察。GRα、GRβ mRNA表达水平以目的条带与GAPDH灰度值之比进行描述。
1.3.7 肺组织GRα、GRβ蛋白表达水平测定 取肺组织,加入组织蛋白裂解液,裂解后采集上清液,采用Brad-ford法进行测定。取蛋白样品,依次行制胶、上样、电泳分离、脱水等处理。分别加兔抗大鼠GRα多克隆抗体、GRβ多克隆抗体、二抗进行孵育,三种抗体稀释比例分别为1∶1 000、1∶1 000、1∶4 000。ECL发光,经凝胶成像仪进行成像,直至胶片透明,扫描后,采用Bandscan5.0软件分析灰度。
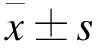
2 结果
2.1 三组肺组织病理形态学特征 空白组:支气管黏膜上皮细胞完整,无明显炎性细胞浸润,肺泡结构连续、紧凑,肺泡壁完整,肺泡腔正常、未见扩大,且无明显炎性细胞渗出(图1A)。模型组:支气管黏膜上皮细胞有明显脱落,管壁存在大量炎性细胞浸润,肺泡壁显著变薄,肺泡明显扩张,管腔聚集有大量炎性渗出物(图1B)。罗红霉素组:支气管黏膜上皮细胞有少许脱落,管壁有少量炎性细胞浸润,肺泡轻度扩张,管腔内存在少量炎性渗出物(图1C)。
2.2 组间血清IL-8、TNF-α、MCP-1水平比较 与空白组比较,模型组血清IL-8、TNF-α、MCP-1水平明显增高(P<0.05);与模型组比较,罗红霉素组血清IL-8、TNF-α、MCP-1水平明显降低(P<0.05)。见表1。
2.3 组间肺组织GRα、GRβ mRNA及蛋白水平比较 与空白组比较,模型组肺组织GRα mRNA及蛋白表达明显降低(P<0.05),GRβ mRNA及蛋白表达明显升高(P<0.05)。与模型组比较,罗红霉素组GRα mRNA及蛋白表达明显升高(P<0.05),GRβ mRNA及蛋白表达明显降低(P<0.05)。见表2。
3 讨论
COPD为一种以气流受限为特征的慢性呼吸系统疾病,发病率及死亡率均较高,严重威胁人类健康[9]。被动吸烟是建立COPD模型的常用方法[10],维持30周以上的被动吸烟便可实现COPD模型成功建立,但为减少实验等待时间,节省实验费用,目前常在被动吸烟基础上联用其他方法进行建模[11-12]。本研究采用被动吸烟联合气管灌注脂多糖的方式进行COPD大鼠模型的建立,结果显示,以空白组为对照,模型组支气管黏膜上皮细胞有明显脱落,管壁存在大量炎性细胞浸润,肺泡壁显著变薄,肺泡明显扩张,管腔聚集有大量炎性渗出物,且模型组大鼠肺组织病理形态学特征与人类COPD的病理形态学改变相符,提示建模成功。呼吸道慢性炎症是COPD发生的核心机制[13]。IL-8是细胞趋化因子家族的重要成员,在中性粒细胞、T淋巴细胞聚集和活化中发挥着重要作用;TNF-α是重要促炎因子,可刺激巨噬细胞等多种细胞释放大量炎性因子;MCP-1参与巨噬细胞的聚集和活化,增加炎性细胞浸润。上述3种炎性介质均被证实参与了COPD的发生发展,与患者预后密切相关[14-16]。本研究中,与空白组比较,模型组血清TNF-α表达明显增高,肺组织GRα mRNA及蛋白表达降低,肺组织GRβmRNA及蛋白表达明显降低,验证了GRα/GRβ失衡是COPD发生的重要机制。

图1 三组大鼠肺组织HE染色(400×)

组别只数IL-8TNF-αMCP-1空白组10153.54±18.69139.12±18.24113.47±16.72模型组10258.98±27.43*244.69±35.61*244.56±29.41*罗红霉素组10196.84±21.54#182.36±27.13#152.46±23.26#
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05
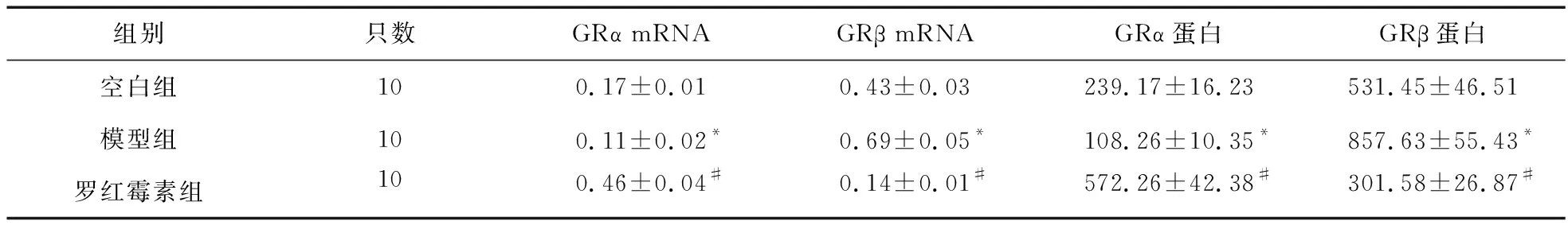
表2 组间肺组织GRα、GRβ mRNA及蛋白水平比较
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05
糖皮质激素是治疗COPD最有效的抗炎药物,但对部分患者疗效较差。研究认为,吸烟哮喘患者存在显著的糖皮质激素抵抗,其治疗药物选择是临床面临的棘手问题[17]。大环内酯类抗生素除可发挥抗感染作用外,还具有良好的抗炎作用,因此,该类抗生素在多种炎症性疾病的治疗上有着广泛应用[18-19]。研究表明,长期应用罗红霉素可改善COPD患者的临床症状,改善患者生活质量[20]。另有研究显示,罗红霉素治疗急性加重期COPD,能够明显降低患者血清IL-8、TNF-α等炎性介质表达水平[21]。本研究结果显示,与模型组比较,罗红霉素组血清IL-8、TNF-α、MCP-1水平明显降低,证实了罗红霉素的抗炎作用。本研究还显示,与模型组比较,罗红霉素组GRα mRNA及蛋白表达明显升高,GRβ mRNA及蛋白表达明显降低,表明罗红霉素对糖皮质激素抵抗有改善作用。
综上所述,罗红霉素能够抑制IL-8、TNF-α、MCP-1等炎性介质释放,调节GRα/GRβ平衡,对逆转COPD大鼠糖皮质激素抵抗有积极作用,值得深入研究。
参考文献:
[1] 王胜,叶海勇,陈悦,等.302例慢性阻塞性肺疾病急性加重期中医证候分型[J].北京中医药大学学报,2015,38(1):57-62.
[2] 冯鑫,王荣丽.慢性阻塞性肺疾病中氧化应激及抗氧化治疗的研究进展[J].临床肺科杂志,2016,21(1):136-139.
[3] 张文路,何志义,赵琳,等.姜黄素逆转慢性阻塞性肺疾病糖皮质激素抵抗的作用机制[J].山东医药,2016,56(38):1-4.
[4] 赵洪达,陈建波,许群,等.吸入糖皮质激素治疗稳定期COPD的疗效及对患者内皮功能及生活质量的影响[J].河北医学,2016,22(2):209-212.
[5] 黄晓梅,贺云鹏,林宗钦,等.不同剂量糖皮质激素在中度至重度COPD患者急性加重期的应用[J].新医学,2017,48(3):163-168.
[6] Geer EB,Islam J,Buettner RC.Mechanisms of glucocorticoid-induced insulin resistance:focus on adipose tissue function and lipid metabolism[J].Endocrinol Metab Clin North Am,2014,43(1):75-79.
[7] 朱莹然,俞小卫.难治性哮喘糖皮质激素抵抗机制的研究新进展[J].医学综述,2015,21(6):1027-1030.
[8] 侯利江.小剂量罗红霉素对使用舒利迭治疗的稳定期COPD患者肺功能及生活质量的影响[J].实用临床医药杂志,2014,18(11):116-117.
[9] 谢文英,尚立芝,胡文豪,等.慢性阻塞性肺疾病的发病机制及中医药治疗进展[J].中国实验方剂学杂志,2015,21(9):227-230.
[10]孙嘉琳,所鸿.通过单纯熏烟法建立慢性阻塞性肺疾病大鼠模型[J].中国医药,2016,11(12):1778-1780.
[11]单丽囡,洪榆,黄纯美,等.益气活血化痰法对COPD模型大鼠细胞因子及气道重塑的干预作用[J].中药新药与临床药理,2015,26(6):744-747.
[12]王国力,邓虎,徐艳玲.补肾中药复方对COPD模型大鼠肺内炎性因子的影响[J].世界中西医结合杂志,2017,12(2):196-199.
[13]杨阳,杨雁.COPD缓解期患者血清PCT、IL-6、hs-CRP水平对急性加重的预测作用[J].广东医学,2017,38(10):1531-1533.
[14]Wieegm CH,Michaeloudes IC,Haji G,et al.Oxideative stress-induced mitochondrial dysfunction drives inflammatory and airway smooth muscle remodeling in patients with chronic obstructive pulmonary disease[J].J Allergy Clin Immunol,2015,136(3):769-780.
[15]孙世民,张珠,王云雀.COPD急性加重期和稳定期血清炎性因子水平及其与肺功能的关系[J].中国全科医学,2014,17(24):2790-2793.
[16]张红.多索茶碱对慢性阻塞性肺病患者气道重塑与炎性指标的影响[J].西北药学杂志,2015,30(5):628-630.
[17]Chatkin JM,Dullius CR.The management of asthmatic smokers.[J].Asthma Res Prac,2016,2(1):1-8.
[18]王文,吴小军.大环内酯类抗生素在慢性气道炎症疾病治疗中的进展[J].临床肺科杂志,2016,21(7):1338-1341.
[19]王文,金松,王勋,等.大环内酯类抗生素对慢性阻塞性肺疾病患者急性加重频率影响的Meta分析[J].医学研究杂志,2017,46(2):90-95.
[20]刘贤兵,李芳,陈晓萍,等.长期小剂量罗红霉素治疗对中重度COPD患者气道局部免疫的影响[J].温州医科大学学报,2015,45(10):734-737.
[21]郑瑞兵,彭卫东.罗红霉素治疗慢性阻塞性肺疾病稳定期患者气道炎症疗效观察[J].中国药师,2016,19(7):1334-1336.
