急性HIV感染者γδ T细胞及其细胞亚群的表型分析①
2018-07-06王桂芳李群辉
吴 江 王 蕊 画 伟 王桂芳 李群辉 李 珍
(中国疾病预防控制中心科技开发办公室,北京 100050)
γδ T细胞是一种天然免疫细胞,主要分为Vδ1和Vδ2 T细胞两种亚群,在抗HIV感染中发挥重要作用[1]。HIV感染导致机体免疫细胞高度活化,T、B淋巴细胞等免疫细胞表面活化、增殖、凋亡分子的表达增加[2]。慢性免疫活化可以引起免疫耗竭,抑制性分子的表达增加[3,4]。HIV通过调节PD-1等抑制性分子的表达而形成免疫逃逸,使HIV持续存在[5,6]。前期的研究发现,急性HIV感染者γδ T细胞表面活化分子的表达显著增加[7,8],但其抑制和凋亡分子的表达情况还不完全清楚。因此,本研究对急性HIV感染者γδ T细胞活化、抑制、凋亡等表型进行分析,以诠释γδ T细胞在急性HIV感染中的作用。
1 材料与方法
1.1材料
1.1.1研究对象 选取2015年1月至2016年12月期间,北京佑安医院在男男同性恋人群(Men who have sex with men,MSM)中筛查出的HIV急性期感染者15例。根据Fiebig分期,将急性HIV感染(AHI)分为6个阶段[9,10],Fiebig Ⅰ-Ⅱ(HIV RNA+,HIV Ab-):1例;Fiebig Ⅲ-Ⅳ(HIV RNA+,HIV Ab+,WB-/±):2例;Fiebig Ⅴ-Ⅵ(HIV RNA+,HIV Ab+,WB+,缺少p31条带):12例。采集患者抗凝血和血浆,用于淋巴细胞数量和病毒载量检测。8例HIV阴性者为健康对照组。研究对象的详细资料见表1。所有参与者均签订知情同意书,本研究已通过首都医科大学附属北京佑安医院伦理委员会的审查。
1.1.2流式抗体 PE标记的抗人Vδ2TCR mAb(IMMU389)(Beckman Coulter公司,美国);FITC标记的抗人Vδ1TCR mAb(TS8.2)(Pierce公司,美国);APC标记的抗人γδTCR mAb(B1)、Percp-cy5.5标记的抗人CD38 mAb(HIT2)、PE-cy7标记的抗人CD160 mAb(BY55)、APC-cy7标记的抗人PD-1 mAb(EH12.2H7)、APC-cy7标记的抗人CD95 mAb(DX2)、APC标记的抗人CD262(DR5,TRAIL-R2)mAb[DJR2-4(7-8)]和对应的同型抗体(Biolegend公司,美国)。
1.1.3其他材料 淋巴细胞分离液(天津灏洋生物有限公司,中国);RPMI1640培养基、胎牛血清(Hyclone公司,美国);牛血清白蛋白(中国医学科学院生物医学工程研究所,中国);FACSCalibur TruCount 计数管、CantoⅡ流式细胞仪(BD公司,美国)。
1.2方法
1.2.1T淋巴细胞计数 采用FACSCalibur TruCount 计数管和多色标记抗体(CD3/CD4/CD8/CD45)标记细胞,流式细胞仪检测分析CD3+、CD4+和CD8+T细胞的百分比和绝对计数。
1.2.2病毒载量检测 血浆病毒载量采用雅培Real-time HIV-1 M2000系统检测,最低检测线为40拷贝/ml。
1.2.3流式细胞术 取新鲜分离的外周血单个核细胞(PBMCs),洗涤后加入不同荧光标记的抗人TCRγδ、Vδ1TCR、Vδ2TCR、CD38、PD-1、CD160、CD95和CD262 mAbs,同时设置单阳对照和同型对照,室温避光孵育20 min。洗涤后,加入300 μl 2%多聚甲醛固定液。流式细胞仪采集数据,FlowJo软件分析数据。
2 结果
2.1病例分析 急性HIV感染者平均年龄为(29.4±6.9)岁,平均感染时间为(72.4±40.6)d。健康对照组平均年龄为(30.3±6.3)岁,两组年龄的差异无统计学意义,具有可比性。
2.2急性HIV感染者γδ T细胞及其细胞亚群频率的变化 与健康对照组相比较,急性HIV感染者(AHI)γδ T细胞的比例无显著变化。Vδ1 T细胞的比例较健康对照组显著增加(P=0.031),而Vδ2 T细胞的比例则显著下降(P=0.033),见图1。
2.3急性HIV感染者γδ T细胞的活化水平显著增加 与健康对照组相比较,急性HIV感染者CD38+γδ T细胞、CD38+Vδ1 T细胞和CD38+Vδ2 T细胞比例显著增加(P=0.002、P=0.000 6、P=0.004)。此外,在急性HIV感染者中,CD38+Vδ1T细胞的比例显著高于CD38+Vδ2T细胞(P<0.000 1),而在健康对照组中,CD38+Vδ1T细胞与CD38+Vδ2T细胞比例的差异无显著统计学意义(P=0.279),见图2。
2.4急性HIV感染者γδ T细胞表面抑制性分子的表达 与健康对照组相比较,急性HIV感染者PD-1+γδ T细胞的比例显著增加(P=0.032),而PD-1+Vδ1 T细胞和PD-1+Vδ2 T细胞的比例无显著差异(P=0.06、P=0.949)。此外,在健康对照组和急性HIV感染者中,PD-1+Vδ1 细胞的比例均显著高于PD-1+Vδ2 细胞的比例(P=0.028,P=0.000 1),见图3A。而急性HIV感染者CD160+γδ T细胞、CD160+Vδ1 T细胞和CD160+Vδ2 T细胞的比例与健康对照组相比无显著统计学差异。但在急性HIV感染者中,CD160+Vδ1 T细胞的比例显著高于CD160+Vδ2T细胞(P=0.009),见图3B。
表1健康对照组和急性HIV感染者的基本资料
Tab.1Basiccharacteristicsofhealthycontrols(HCs)andacuteHIV-infectedpatients
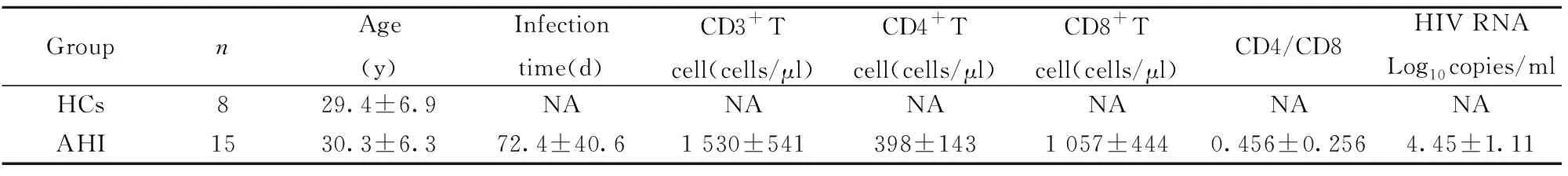
GroupnAge(y)Infectiontime(d)CD3+Tcell(cells/μl)CD4+Tcell(cells/μl)CD8+Tcell(cells/μl)CD4/CD8HIV RNALog10copies/mlHCs829.4±6.9NANANANANANAAHI1530.3±6.372.4±40.61 530±541398±1431 057±4440.456±0.2564.45±1.11
Note:NA.Not applied.
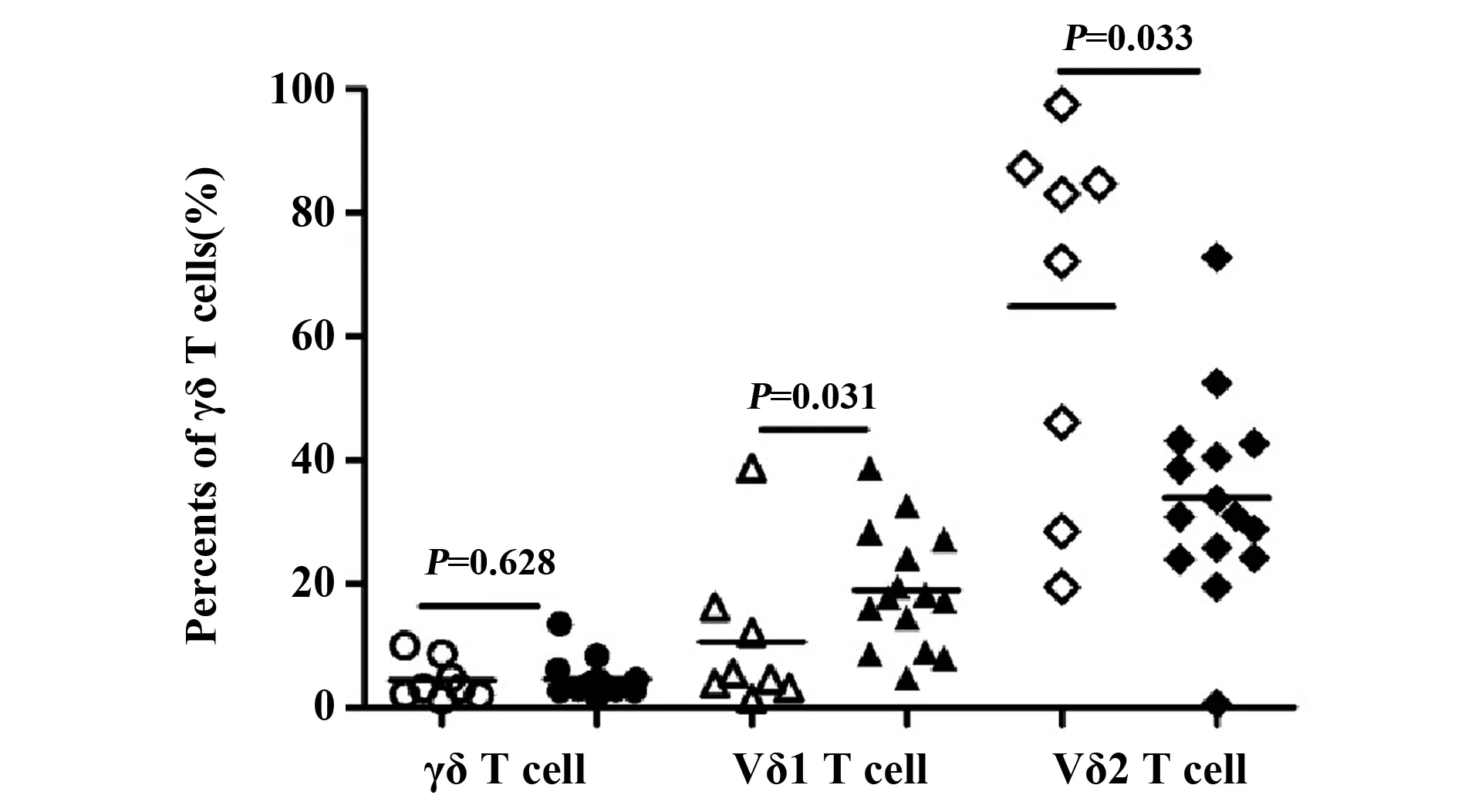
图1 健康对照组(n=8)和急性HIV 感染者(n=15)γδ T细胞及其亚群分布的比较Fig.1 Comparisons of frequencies of γδ T cell and their subsets between healthy controls(n=8) and acute HIV-infected patients(n=15)Note:Hollow represents healthy control:γδ T cell(○),Vδ1 T cell(△),Vδ2 T cell(◇);Solid represents acute HIV-infected patients:γδ T cell(●),Vδ1 T cell(▲),Vδ2 T cell(◆).
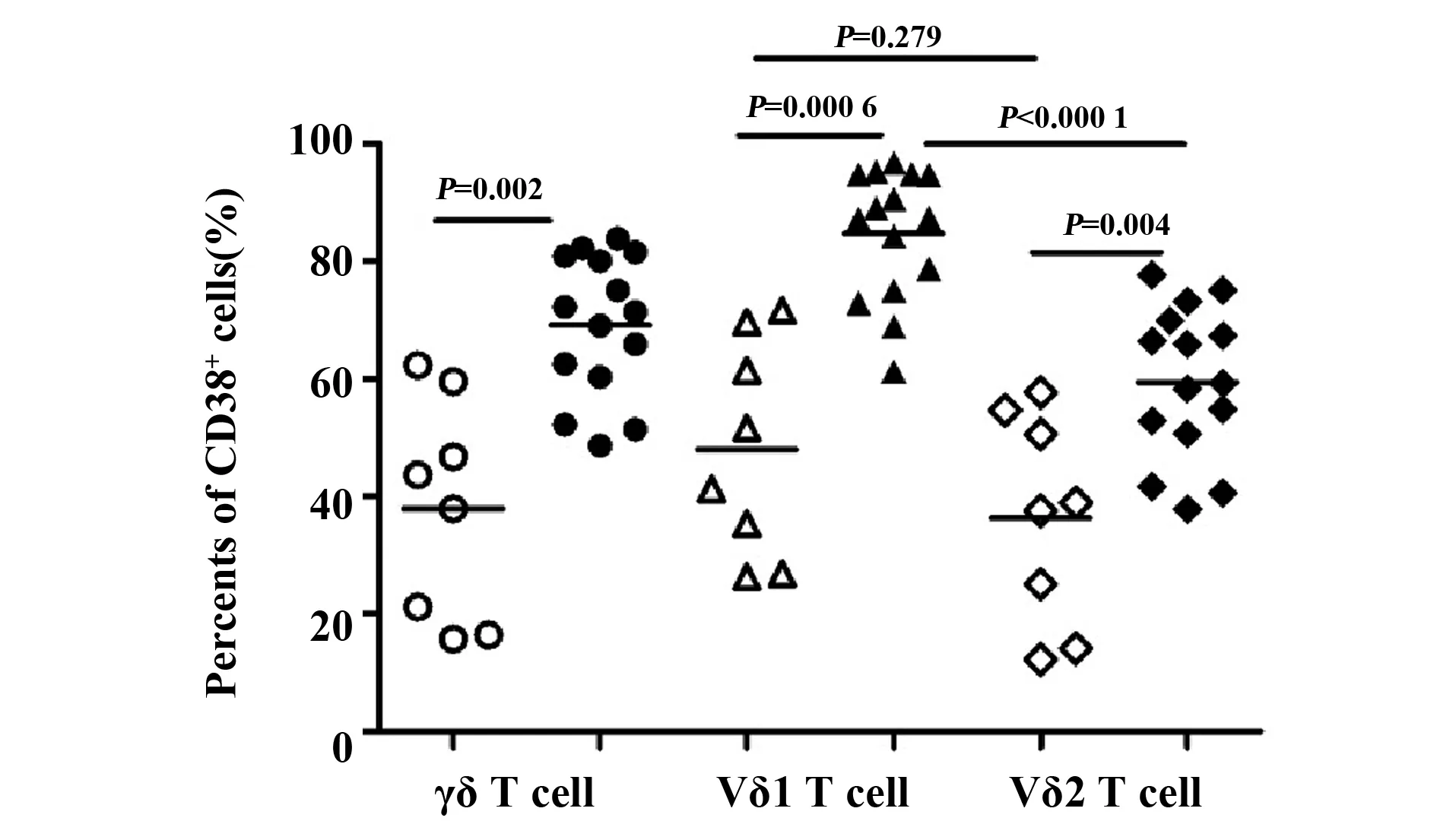
图2 健康对照组(n=8)和急性HIV感染者(n=15)γδ T细胞及其亚群活化水平的比较Fig.2 Comparisons of activation of γδ T cell and their subsets between healthy controls(n=8) and acute HIV-infected patients(n=15)Note:Hollow represents healthy control:γδ T cell(○),Vδ1 T cell(△),Vδ2 T cell(◇);Solid represents acute HIV-infected patients:γδ T cell(●),Vδ1 T cell(▲),Vδ2 T cell(◆).
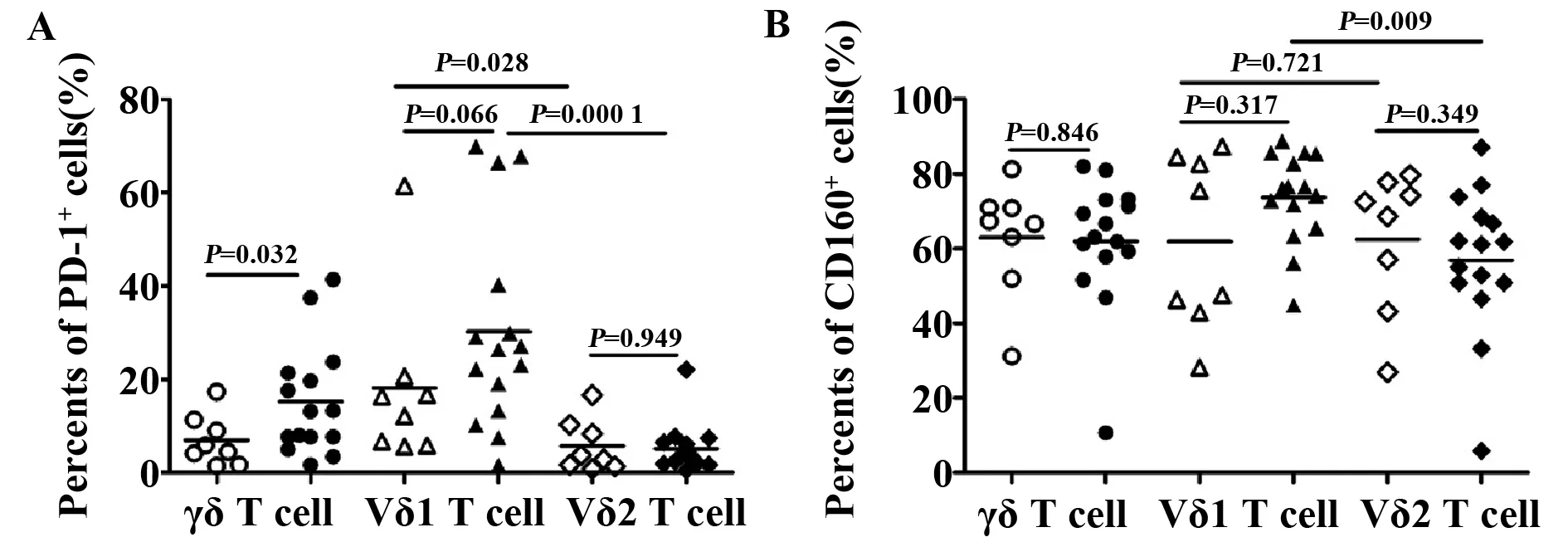
图3 健康对照组(n=8)和急性HIV感染者(n=15)γδ T细胞及其亚群抑制性分子的表达Fig.3 Expression of inhibitors on γδ T cell and their subsets from both healthy controls(n=8) and acute HIV-infected patients(n=15)Note:A.PD-1;B.CD160.Hollow represents healthy control:γδ T cell(○),Vδ1 T cell(△),Vδ2 T cell(◇);Solid represents acute HIV-infected patients:γδ T cell(●),Vδ1 T cell(▲),Vδ2 T cell(◆).
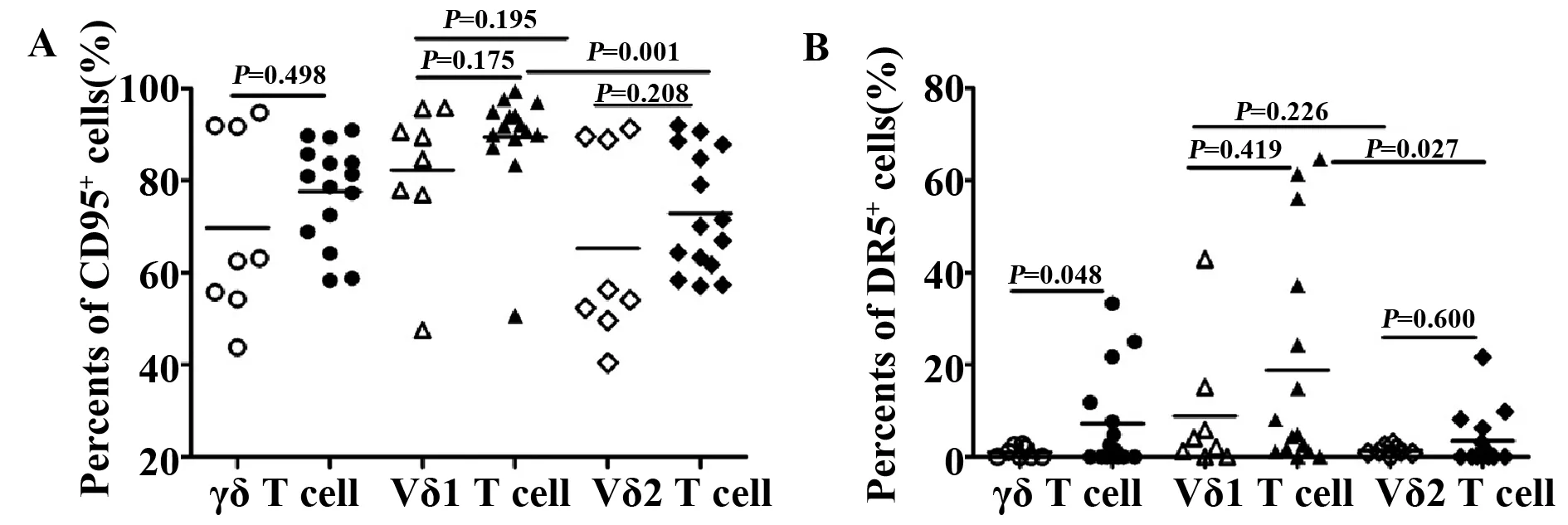
图4 健康对照组(n=8)和急性HIV感染者(n=15)γδ T细胞及其亚群凋亡分子的表达Fig.4 Expression of apoptosis markers on γδ T cell and their subsets from both healthy controls(n=8) nd acute HIV-infected patients(n=15)Note:A.CD95;B.TRAIL-DR5.Hollow represents healthy control:γδ T cell(○),Vδ1 T cell(△),Vδ2 T cell(◇);Solid represents acute HIV-infected patients:γδ T cell(●),Vδ1 T cell(▲),Vδ2 T cell(◆).
2.5急性期HIV感染者γδ T细胞表面凋亡分子的表达 与健康对照组相比较,急性HIV感染者CD95+γδ T细胞、CD95+Vδ1 T细胞和CD95+Vδ2 T细胞的比例增加,但差异无显著统计学意义。此外,急性HIV感染者DR5+γδ T细胞的比例较健康对照组显著增加(P=0.048),而DR5+Vδ1 T细胞和DR5+Vδ2 T细胞的比例与健康对照组相比,差异无显著统计学意义。但在急性HIV感染者中,CD95+Vδ1T细胞和DR5+Vδ1T细胞的比例均显著高于CD95+Vδ2T细胞和DR5+Vδ2T细胞的比例(P=0.001,P=0.027),见图4。
3 讨论
慢性免疫活化、CD4+T细胞的减少是HIV感染及疾病进展的主要特征[11,12]。急性HIV感染者γδ T细胞、Vδ1和Vδ2 T细胞高度活化,且Vδ2 T细胞比例较健康对照组显著减少。慢性病毒感染中,免疫活化可以导致机体免疫细胞耗竭,抑制分子的表达增加,并与T细胞功能缺陷相关[3,5,13]。然而,急性HIV感染中γδ T细胞抑制性分子的表达还不清楚。本研究结果显示,与健康对照组相比,急性HIV感染者PD-1+γδ T细胞的比例显著增加,而CD160+γδ T细胞的比例无显著变化。研究报道,共刺激分子的表达与细胞的分化状态相关,CD160、PD-1主要表达在记忆性CD4+或CD8+T细胞上[14,15]。本研究尚未对γδ T细胞、Vδ1和Vδ2 T细胞的分化状态进行分析,因此未在急性HIV感染者和健康对照组中发现γδ T细胞及其亚群CD160、PD-1表达的差异。此外,T细胞活化或增殖后,CD160的表达并不上调[15],这也可以解释本研究中急性HIV感染者γδ T细胞表面CD160表达不上调的原因。研究结果显示,PD-1+记忆性CD4+T细胞比例增加与HIV感染儿童CD4+T细胞增殖能力降低和炎症性细胞因子分泌增加相关[4]。CD160的表达可单独影响CD8+T细胞增殖、穿孔素的表达和细胞因子分泌,而不依赖PD-1的表达[15]。正常情况下,Vδ2 T细胞几乎不表达PD-1,而一旦被激活后,PD-1表达大量增加。PD-1/PD-L1的相互作用通过下调IFN-γ的产生和细胞毒活性而降低Vδ2 T细胞的抗肿瘤活性[16]。但PD-1、CD160等抑制性分子如何调节HIV感染者γδ T细胞及其亚群的功能还需进一步研究。
HIV感染者pDC产生大量的IFN-α,促进TRAIL、DR5、Fas和FasL的表达,进而引起CD4+T细胞凋亡[17-19]。本研究发现,与健康对照组相比,急性HIV感染者γδ T细胞表面CD95(Fas)的表达无显著变化,而TRAIL-DR5的表达显著增加,这可能与急性HIV感染者血浆中存在高水平的IFN-α有关[20]。前期研究发现,AIDS患者γδ T细胞可杀伤自体HIV感染的CD4+T细胞[21]。因此推测,通过TRAIL/TRAIL受体途径,而不是Fas/FaL途径,诱导HIV感染CD4+T细胞凋亡是γδ T细胞杀伤HIV感染的CD4+T细胞的机制之一。此外,本研究显示,急性HIV感染者Vδ2 T细胞的数量减少,活化增加。然而,阻断Fas并不能阻止包膜蛋白诱导的细胞死亡,且gp120也不能改变Vδ2 T细胞Fas和FasL的表达[22]。因此,HIV感染者Vδ2 T细胞数量减少的主要原因并不是活化诱导的细胞凋亡,可能是由于HIV直接感染或HIVgp120与Vδ2 T细胞表面CCR5结合导致的[1,22,23]。
本研究首次在急性HIV感染者中发现Vδ1 T细胞活化、抑制和凋亡分子的表达均显著高于Vδ2 T细胞,表明Vδ1 T细胞在HIV感染及疾病进展中起引更为重要的作用。研究发现,HIV感染疾病快速进展者中,Vδ1T细胞的比例显著增高[7],并可杀伤HIV感染的CD4+T细胞或旁路CD4+T细胞,引起HIV感染者CD4+T细胞减少,进而加速疾病进展[24,25]。但目前对于Vδ1 T细胞的研究相对较少,且本研究采用的样本量较少,需要在大样本中对结果进行验证,并深入研究Vδ1 T细胞在HIV感染及疾病进展中的机制。
参考文献:
[1] Pauza CD,Poonia B,Li H,etal.gammadelta T cells in HIV disease:past,present,and future [J].Front Immunol,2014,5:687.
[2] Moir S,Chun TW,Fauci AS.Pathogenic mechanisms of HIV disease [J].Annu Rev Pathol,2011,6:223-248.
[3] Wykes MN,Lewin SR.Immune checkpoint blockade in infectious diseases [J].Nat Rev Immunol,2018,18(2):91-104.
[4] Foldi J,Kozhaya L,McCarty B,etal.HIV-infected children have elevated levels of PD-1+memory CD4 T cells with low proliferative capacity and high inflammatory cytokine effector functions [J].J Infect Dis,2017,216(6):641-650.
[5] Larsson M,Shankar EM,Che KF,etal.Molecular signatures of T-cell inhibition in HIV-1 infection [J].Retrovirology,2013,10:31.
[6] Damouche A,Pourcher G,Pourcher V,etal.High proportion of PD-1-expressing CD4+T cells in adipose tissue constitutes an immunomodulatory microenvironment that may support HIV persistence [J].Eur J Immunol,2017,47(12):2113-2123.
[7] Li Z,Jiao Y,Hu Y,etal.Distortion of memory Vdelta2 gammadelta T cells contributes to immune dysfunction in chronic HIV infection [J].Cell Mol Immunol,2015,12(5):604-614.
[8] Li Z,Li W,Li N,etal.gammadelta T cells are involved in acute HIV infection and associated with AIDS progression[J].PLoS One,2014,9(9):e106064.
[9] Fiebig EW,Wright DJ,Rawal BD,etal.Dynamics of HIV viremia and antibody seroconversion in plasma donors:implications for diagnosis and staging of primary HIV infection [J].AIDS,2003,17(13):1871-1879.
[10] Cohen MS,Gay CL,Busch MP,etal.The detection of acute HIV infection [J].J Infect Dis,2010,202(Suppl 2):S270-277.
[11] Douek DC,Roederer M,Koup RA.Emerging concepts in the immunopathogenesis of AIDS [J].Annu Rev Med,2009,60:471-484.
[12] Karim R,Mack WJ,Stiller T,etal.Association of HIV clinical disease progression with profiles of early immune activation:results from a cluster analysis approach [J].AIDS,2013,27(9):1473-1481.
[13] Vigano S,Perreau M,Pantaleo G,etal.Positive and negative regulation of cellular immune responses in physiologic conditions and diseases [J].Clin Dev Immunol,2012,2012:485781.
[14] Chibueze CE,Yoshimitsu M,Arima N.CD160 expression defines a uniquely exhausted subset of T lymphocytes in HTLV-1 infection [J].Biochem Biophys Res Commun,2014,453(3):379-384.
[15] Vigano S,Banga R,Bellanger F,etal.CD160-associated CD8 T-cell functional impairment is independent of PD-1 expression[J].PLoS Pathog,2014,10(9):e1004380.
[16] Xiang Z,Tu W.Dual Face of Vgamma9Vdelta2-T cells in tumor immunology:anti-versus pro-tumoral activities [J].Front Immunol,2017,8:1041.
[17] Herbeuval JP,Nilsson J,Boasso A,etal.Differential expression of IFN-alpha and TRAIL/DR5 in lymphoid tissue of progressor versus nonprogressor HIV-1-infected patients [J].Proc Natl Acad Sci U S A,2006,103(18):7000-7005.
[18] Herbeuval JP,Grivel JC,Boasso A,etal.CD4+T-cell death induced by infectious and noninfectious HIV-1:role of type 1 interferon-dependent,TRAIL/DR5-mediated apoptosis [J].Blood,2005,106(10):3524-3531.
[19] Saidi H,Bras M,Formaglio P,etal.HMGB1 is involved in IFN-alpha production and TRAIL expression by HIV-1-exposed plasmacytoid dendritic cells:impact of the crosstalk with NK cells [J].PLoS Pathog,2016,12(2):e1005407.
[20] von Sydow M,Sonnerborg A,Gaines H,etal.Interferon-alpha and tumor necrosis factor-alpha in serum of patients in various stages of HIV-1 infection [J].AIDS Res Hum Retroviruses,1991,7(4):375-380.
[21] 李 珍,焦艳梅,崔莲仙,等.AIDS患者γδ T细胞能够杀伤自体HIV感染的CD4+T细胞 [J].基础医学与临床,2012,32(7):778-782.
Li Z,Jiao YM,Cui LX,etal.Lysis of autologous HIV-infected CD4+T cells by γδT cells from AIDS patients[J].Basic Clin Med,2012,32(7):778-782.
[22] Li H,Chaudhry S,Poonia B,etal.Depletion and dysfunction of Vgamma2Vdelta2 T cells in HIV disease:mechanisms,impacts and therapeutic implications [J].Cell Mol Immunol,2013,10(1):42-49.
[23] Soriano-Sarabia N,Archin NM,Bateson R,etal.Peripheral Vgamma9Vdelta2 T cells are a novel reservoir of latent HIV infection [J].PLoS Pathog,2015,11(10):e1005201.
[24] Sindhu ST,Ahmad R,Morisset R,etal.Peripheral blood cytotoxic gammadelta T lymphocytes from patients with human immunodeficiency virus type 1 infection and AIDS lyse uninfected CD4+T cells,and their cytocidal potential correlates with viral load [J].J Virol,2003,77(3):1848-1855.
[25] Fausther-Bovendo H,Wauquier N,Cherfils-Vicini J,etal.NKG2C is a major triggering receptor involved in the V[delta]1 T cell-mediated cytotoxicity against HIV-infected CD4 T cells [J].AIDS,2008,22(2):217-226.