不同时间骨髓间充质干细胞移植对大鼠脑创伤疗效的影响
2018-07-06王英杰
王英杰 王 晶 石 鑫
(承德医学院,承德 067000)
骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)是一种骨髓来源的多功能细胞,具有很强的自我更新和多方向分化的能力;能够在内环境的作用下迁移至受到损伤的组织部位,对组织的结构和(或)功能进行修复;并且具有较强的免疫调节功能,进行异体移植时可避免免疫排斥反应[1]。因此,BMSCs在临床多种疾病治疗中的应用得到了很大的重视。
现阶段的研究显示,创伤性脑损伤(Traumatic brain injury,TBI)后,预防神经细胞的死亡是挽救脑创伤患者最直接最有效的手段[2]。当TBI发生后,创伤性的主要作用位置就在大脑的海马区,无论是原发性的创伤,还是出现继发性的创伤,这些都是左右海马区正常工作的主要诱因[3]。自噬(Autophagy)为所有真核细胞内最为普遍的生理表现,是保证机体内环境相对稳定的状态[4]。有研究表明抑制自噬具有减轻TBI和提高神经功能恢复的作用[5]。本实验通过建立大鼠脑损伤模型,并使用BMSCs进行治疗,检测动物行为学的变化[6],以及自噬相关蛋白的表达,研究BMSCs在不同时间的移植对大鼠脑损伤治疗效果的影响,为BMSCs在临床上治疗脑损伤提供一定的实验依据。
1 材料与方法
1.1动物 BMSCs的供体动物:SPF级幼年雄性SD大鼠6只,3~5周龄,体重90~110 g。BMSCs的受体动物:SPF级成年雌性SD大鼠90只,体重180~220 g,均购自于北京维通利华动物公司。
1.2方法
1.2.1BMSCs的分离及培养 使用乙醚麻醉大鼠,然后脱颈处死大鼠,在无菌的条件下将股骨和胫骨分离,暴露骨髓腔。用DMEM高糖培养基冲洗骨髓腔,并收集冲洗液,1 000 r/min低温离心10 min后弃去上清液,用10%胎牛血清的DMEM高糖培养基重悬细胞。计数后按1×106cm-2密度接种于培养瓶中,置于37℃、5%CO2孵箱中培养,48 h后进行第一次换液,第二次以后换液间隔2~3 d 1次。待细胞95%融合时,使用0.25%胰酶消化,按1∶2的比例进行传代,细胞传至第3代用于实验[7]。
1.2.2实验动物与分组 SPF级健康成年雌性SD大鼠50只,体质量180~220 g。在实验前让大鼠自由进食饮水,适应性饲养1周。将50只SD雌性大鼠随机分为5组,每组10只:对照组、脑创伤模型组、早期治疗组、中期治疗组、晚期治疗组。治疗组分别在造模成功后的1 d、28 d、56 d 经尾静脉注射BMSCs与DMEM悬液1.0 ml(1×106ml-1),对照组以及模型组给予等剂量的生理盐水。
1.2.3脑组织形态学检测 大鼠采取腹腔麻醉法,使用10%水合氯醛,按照0.3 ml/100 g的剂量对大鼠进行麻醉,麻醉后将大鼠断头,分离脑组织,于视交叉后1和6 mm的位置冠状面切开修整组织块,最后剩下大鼠脑的海马位置,在4%多聚甲醛固定液中固定48 h,按照梯度乙醇脱水、二甲苯透明、浸蜡、石蜡包埋、5 μm连续切片。进行HE染色,光学显微镜下观察,拍照留图。
1.2.4Morris水迷宫测试 对照组、模型组、早、中、晚期治疗组大鼠分别于伤后6、7、8、9 d进行水迷宫测试。检测时,把安全岛采取随机的方式放到水迷宫四个象限(N、S、E、W)中的一个象限中,加水,高过安全岛1 cm,水的温度维持在22℃~24℃,摄像机及计算机会自动追踪大鼠的活动路线,以及寻找时间。180 s内仍没找到安全岛,则潜伏期时间为180 s。
1.2.5免疫印迹法检测LC-3和Beclin-1的表达量 将所获取的大鼠脑海马组织从-80℃超低温冰箱中取出,然后将脑组织剪碎,按照100 mg/ml的比例加入裂解液,12 000 r/min低温离心15 min,然后凝胶电泳分离后,转移至 PVDF膜上。5% 脱脂奶粉37℃ 封闭 1.5 h,一抗孵育,并在4℃环境下过夜,第二日二抗孵育2 h。用ECL显色液进行曝光,使用Image J软件进行分析,以β-actin作为内参进行半定量分析。
2 结果
2.1BMSCs的形态学观察 原代BMSCs在48 h之内贴壁,以分散的克隆聚集方式增殖,细胞形态基本为均匀星形或梭形,核居中,偶有宽大扁平的多边形细胞。经过BMSCs纯化,其他非贴壁细胞,通过换液逐渐减少。2 周后原代细胞 95% 融合,进行传代。传代后细胞呈现漩涡状和放射状集落生长倾向,随着传代次数增加,细胞形态更为均一,为梭形成纤维细胞样。见图1。
2.2HE染色组织形态学改变 HE染色结果显示,在对照组中脑的组织结构没有发生改变,血管的管腔中没有发现异常,血管的管壁平整,神经细胞形态规则;在创伤后,模型组神经元细胞胞体出现形状的改变,胞浆染色降低,细胞核出现深度染色,能够看到在细胞之间出现了明显的间隙,并且伴有坏死的神经元细胞出现,早、中期治疗组与模型组比较病理改变明显减轻,晚期治疗组没有减轻,有加重趋势。见图2。
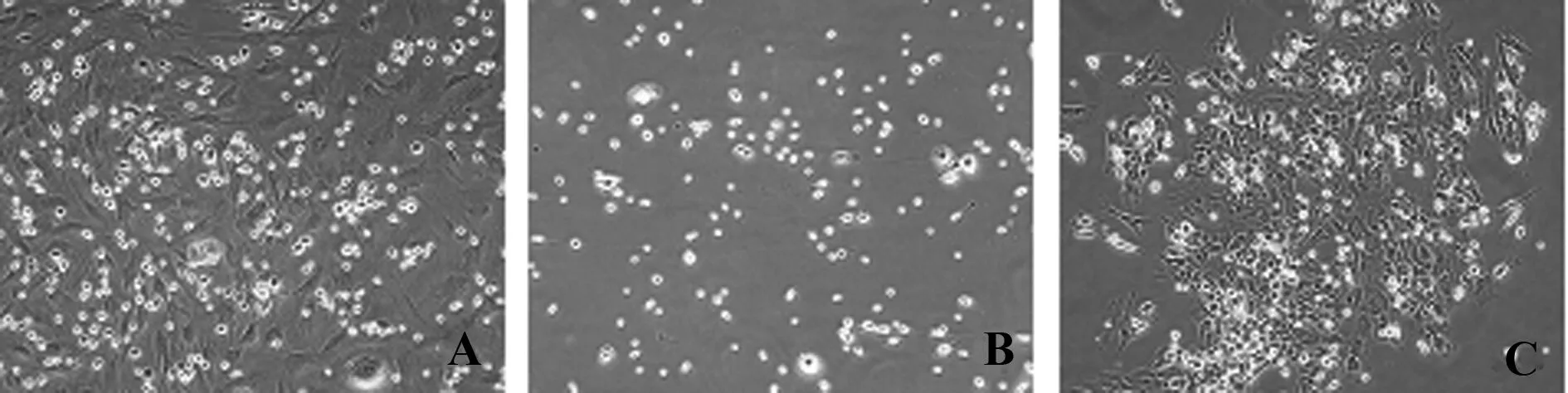
图1 BMSCs的形态学观察(× 200)Fig.1 Morphological observation of BMSC(× 200)Note: A.95% BMSCs;B.Primary cells;C.The third passage BMSCs.
2.3Morris水迷宫结果 因为在脑创伤后,大鼠的运动能力会受到一定的影响,所以设置的实验时间在每组创伤后的第6、7、8以及9天进行Morris水迷宫检测。实验结果显示,模型组在伤后第8天和第9天搜索安全岛潜伏期明显要比对照组时间增加。早、中期治疗组在伤后第8天以及第9天搜索安全岛潜伏期要比对照组有显著的缩短,说明大鼠的记忆功能得到了一定的恢复,晚期治疗组搜索安全岛潜伏期与模型组差异不明显。见图3、4和表1。
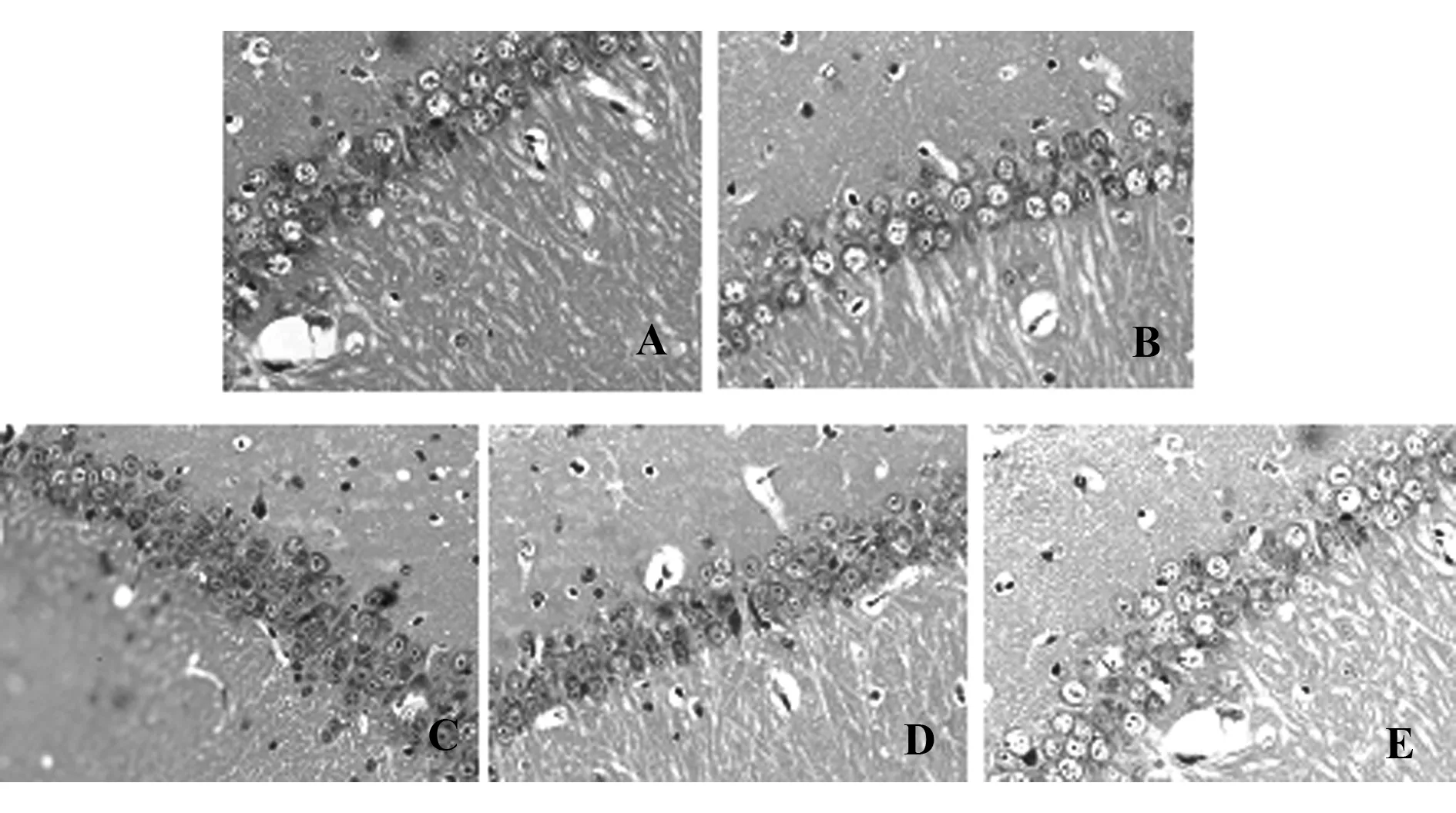
图2 各组HE结果(×200)Fig.2 Each group of HE results(× 200)Note: A.Control group;B.Model group;C.Early treatment group;D.Middle treatment group;E.Late treatment group.
2.4LC-3和Beclin-1的Western blot检测结果 LC-3结果显示出深浅不同的双条带LC-3Ⅰ和LC-3Ⅱ。对照组LC-3和Beclin-1蛋白有微量基础表达。与对照组相比较,模型组LC-3和Beclin-1蛋白的表达有显著升高(P<0.05);与模型组相比,早、中期治疗组蛋白表达明显减弱(P<0.05),但仍高于对照组表达量,晚期治疗组与模型组相比较蛋白的表达没有明显的差异。见图5、6。
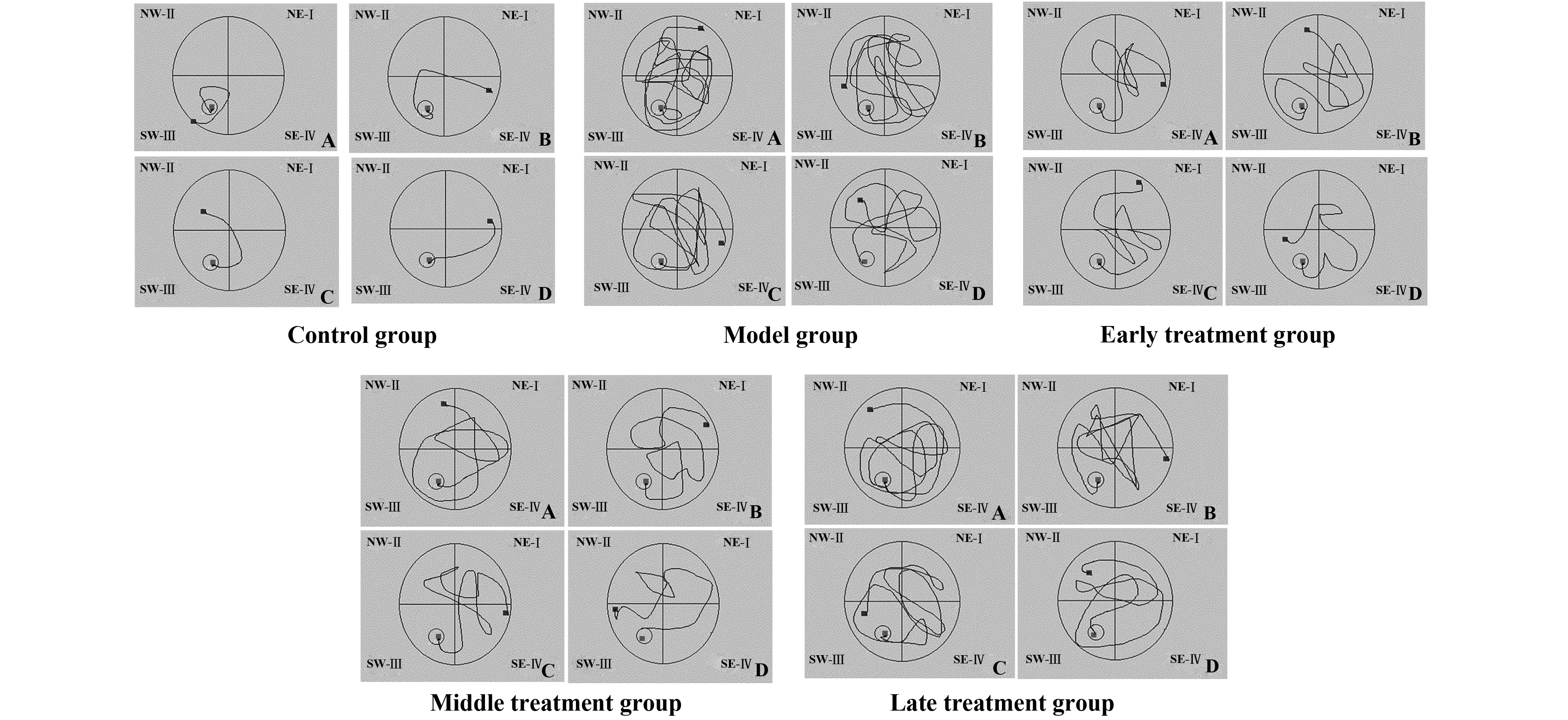
图3 各组水迷宫运动轨迹Fig.3 Moving track of control group in Morris water mazeNote: A.6 d;B.7 d;C.8 d;D.9 d.
表1水迷宫运动变化数据
Tab.1Movementdataofwatermaze
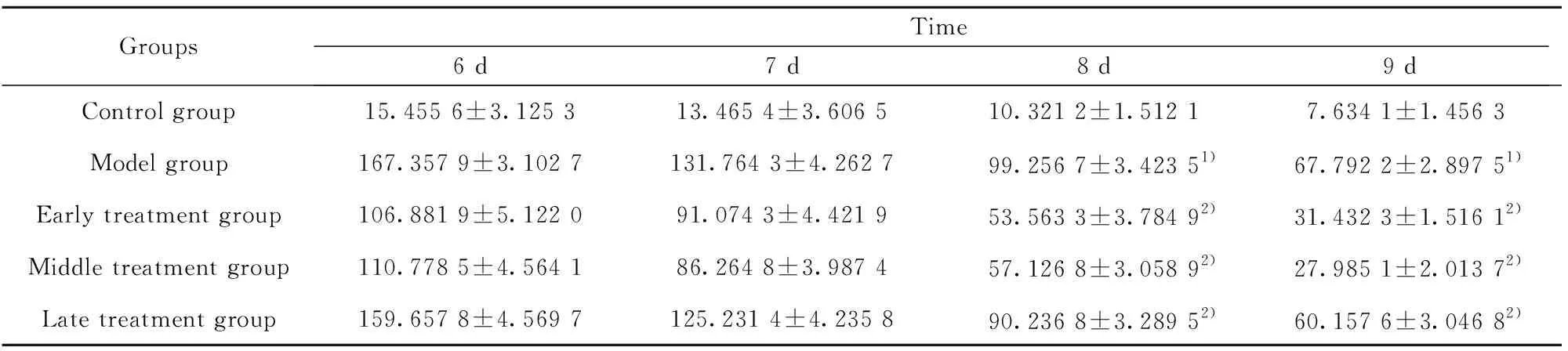
GroupsTime6 d7 d8 d9 dControl group15.455 6±3.125 313.465 4±3.606 510.321 2±1.512 17.634 1±1.456 3Model group167.357 9±3.102 7131.764 3±4.262 799.256 7±3.423 51)67.792 2±2.897 51)Early treatment group106.881 9±5.122 091.074 3±4.421 953.563 3±3.784 92)31.432 3±1.516 12)Middle treatment group110.778 5±4.564 186.264 8±3.987 457.126 8±3.058 92)27.985 1±2.013 72)Late treatment group159.657 8±4.569 7125.231 4±4.235 890.236 8±3.289 52)60.157 6±3.046 82)
Note:1)P<0.05 vs control group;2)P<0.05 vs model group.
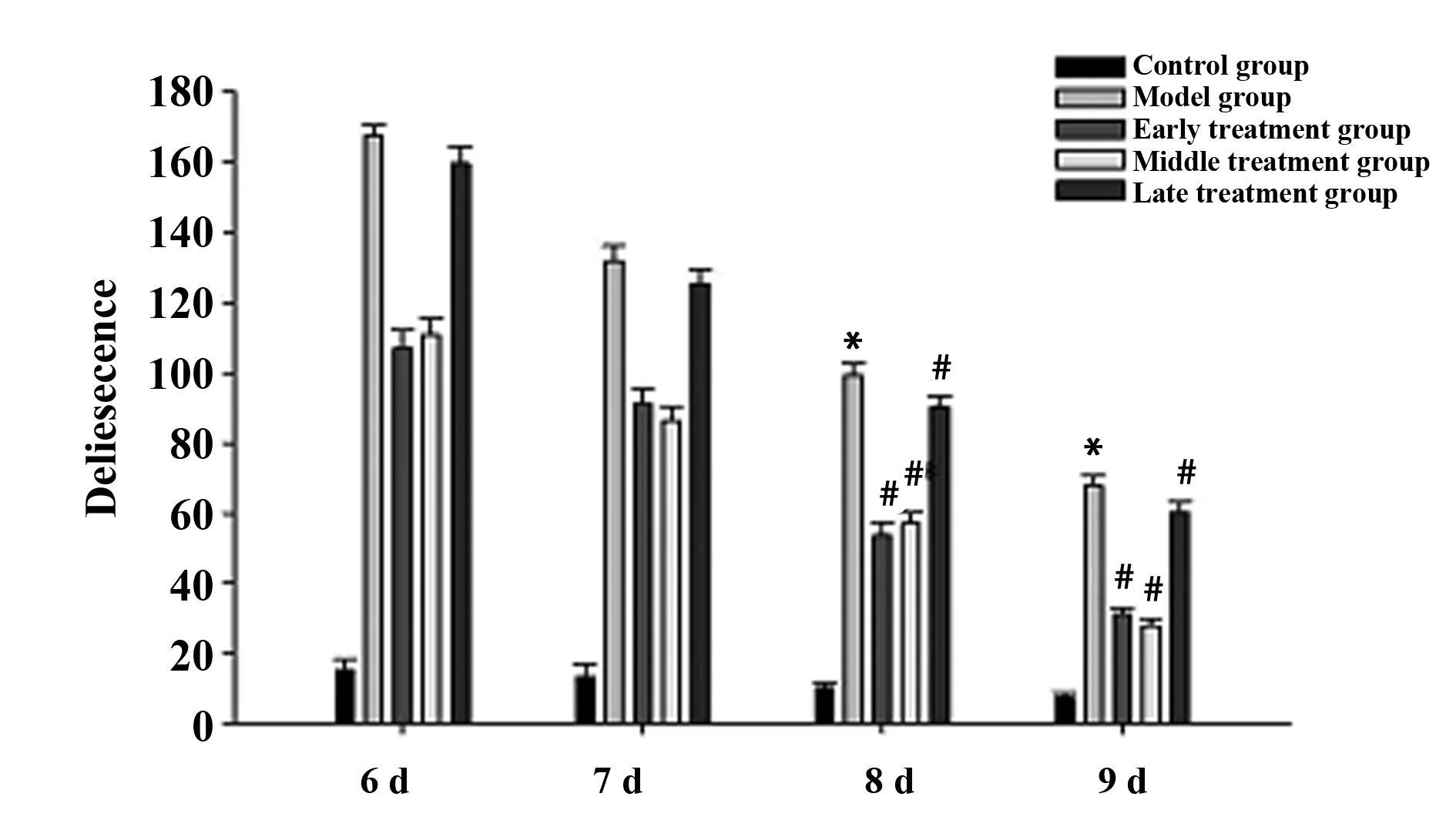
图4 各组水迷宫比较Fig.4 Comparison of delitescence in water maze among groups after injuryNote: *.P<0.05 vs control group;#.P<0.05 vs model group.
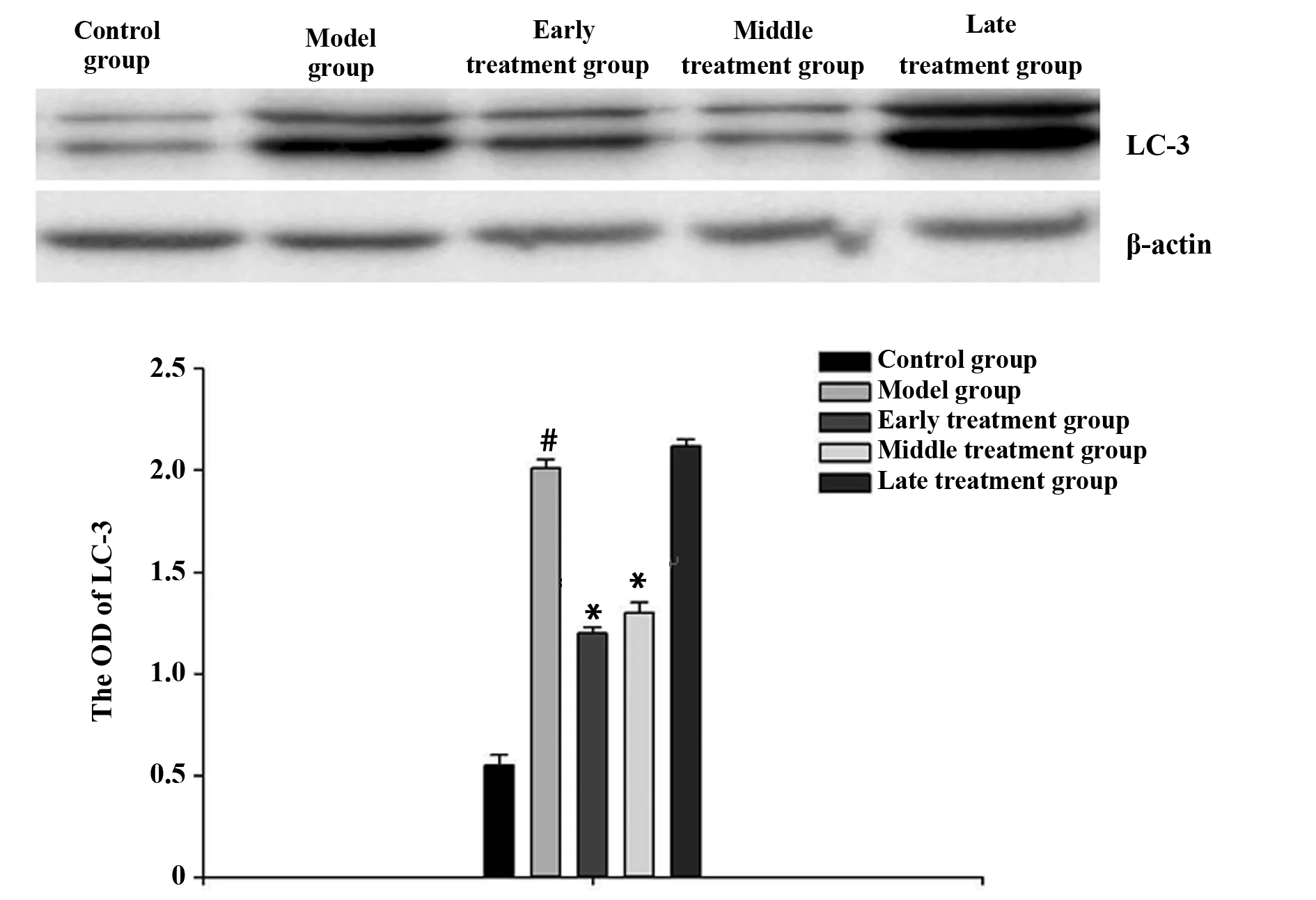
图5 各组LC-3的蛋白表达Fig.5 Protein expression of LC-3 in each groupNote: Model group vs control group,#.P<0.05;early treatment and middle treatment group vs model group,*.P<0.05.
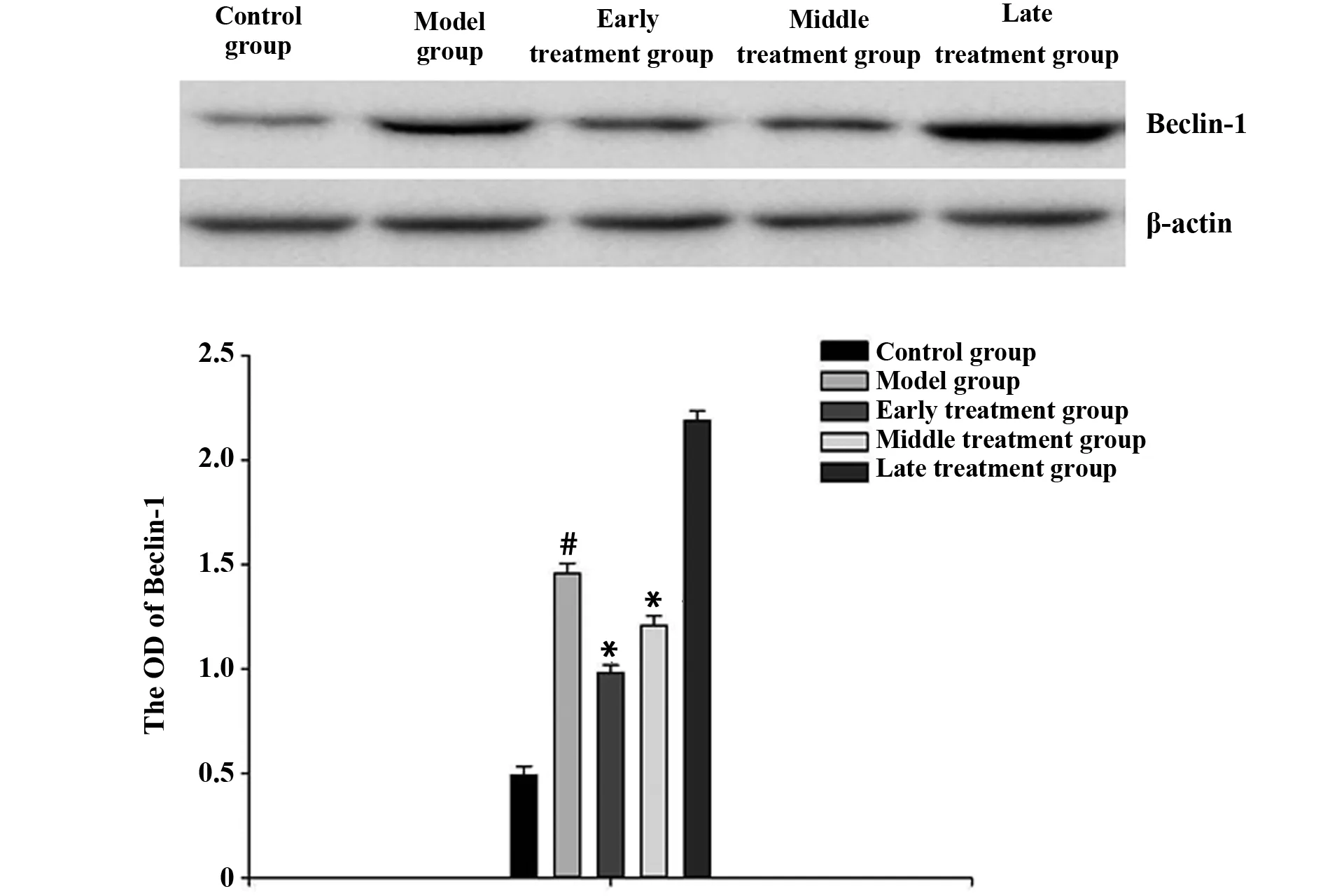
图6 各组Beclin-1的蛋白表达Fig.6 Protein expression of Beclin-1 in each groupNote: Model group vs control group,#.P<0.05;early treatment and middle treatment group vs model group,*.P<0.05 .
3 讨论
BMSCs是一种来源于骨髓的多功能细胞,具有很强的自我更新和多方向分化的能力,能够在内环境的作用下迁移到受损伤的组织位置,对组织的结构和功能进行修复;并且拥有较强的免疫调节功能,进行异体移植时能够避免免疫排斥反应[8]。所以,BMSCs在临床许多疾病的治疗中都发挥了关键性的作用。大量研究证实,BMSCs在心脏、肝脏、肺、肾脏等多个组织器官的损伤中发挥着重要的治疗作用。在心肌梗塞、缺血性心脏病等心脏损伤模型中,发现BMSCs可以促进心肌细胞再生、增加新生血管的形成,进而促进损伤的修复[9]。LC-3:微管相关蛋白轻链3(Microtubule associated protein 1 light chain 3,MAP1-LC3),是酵母ATG8的同系物,细胞自噬体膜通用标记物,其有两种分子存在形式,即LC3-Ⅰ及LC3-Ⅱ,其中LC3-Ⅱ是自噬体形成的关键分子被广泛用作检测哺乳动物中的自噬活性,LC-3Ⅱ/LC-3Ⅰ的比值与自噬体的多少有直接关系[10]。通过免疫蛋白印迹的实验方法能够看到LC-3蛋白的表达可以形成深浅的双条带,即LC-3Ⅰ及LC-3Ⅱ。在正常的细胞里,LC-3Ⅰ和 LC-3Ⅱ都能够被发现,当自噬被激活的状态下,LC-3Ⅱ的蛋白表达会出现升高的趋势。这些促使自噬体的进一步形成。所以LC-3Ⅱ的蛋白表达情况就能够视为自噬是否被激活的标准[11]。
Beclin-1作为自噬的相关基因同样也是哺乳动物中酵母Apg6/Vps30的同系产物,是自噬的相关因子中的重要组成之一,Beclin-1的表达也被用于检测自噬的活性[12]。Beclin-1和磷酸肌醇3激酶(Vps34)相互作用,是吞噬小体形成的关键因素[13]。
本实验的实验结果显示:HE染色结果,模型组神经元细胞胞体发生明显改变,胞浆染色降低,细胞核出现深度染色,并且伴有坏死的神经元细胞出现,早、中期治疗组同模型组比较病理可以看到有明显的减轻,晚期治疗组并不明显,这说明在一定程度上BMSCs的早、中期治疗对大鼠脑创伤后的恢复起到了一定的作用;Morris水迷宫结果显示,在脑创伤后,模型组在搜索安全岛所用的时间明显比对照组时间多,早、中期治疗组的搜索时间要比模型组有了明显的好转,晚期治疗组效果不明显,这说明大鼠脑创伤后通过早、中期的BMSCs治疗,大鼠的空间记忆功能有了一定程度的改善;Western blot检测结果显示,模型组LC-3和Beclin-1蛋白表达出现了显著升高,与模型组相比,早、中期治疗组蛋白表达明显减弱,而晚期治疗组与模型组相比较蛋白的表达没有明显的差异,这进一步说明大鼠脑创伤后通过早、中期的BMSCs治疗对大鼠脑创伤后的恢复起到了一定的作用。经实验初步证实,大鼠在受到脑损伤后,及时给予BMSCs治疗,大鼠在病理改变上有了一定的损伤恢复,在空间学习能力上也有了相对应的加强,这进一步说明了BMSCs的及时应用能够给治疗带来积极的作用。另外,本文只对BMSCs治疗的时间方面,进行了不同时间点的研究,具体在治疗过程中,是否存在着治疗剂量的差别,还有待进一步的研究。
综上所述,本研究证实了BMSCs对创伤性脑损伤的早、中期治疗有明显的作用效果,在创伤性脑损伤的晚期作用效果不明显,为BMSCs面向临床的应用提供了有力的理论和实验依据。
参考文献:
[1] Mezey E.The therapeutic potential of bone marrow-derived stromal cells[J].J Cell Biochem,2011,112(10):2683-2687.
[2] 仇 波,李心国,王 勇,等.颅脑创伤模型小鼠海马水通道蛋白1表达及作用[J].中国现代神经疾病杂志,2014,14(3):245-251.
Qiu B,Li XG,Wang Y,etal.The expression and function of hippocampal water channel protein 1 in the rat model of brain trauma[J].J Chin Modern Neurol Dis,2014,14(3): 245-251.
[3] 张 琳,颜 荣,刘晓智,等.脑创伤后海马区生存素蛋白促进神经再生的研究[J].中华实验外科杂志,2015,32(3):542-545.
Zhang L,Yan R,Liu XZ,etal.Study on the promotion of neurogenesis in hippocampus after traumatic brain injury[J].Chin J Exp Surg,2015,32(3): 542-545.
[4] 王海杰,谭玉珍.细胞自噬的形态学特征和功能意义[J].解剖学报,2009,40(5):844-849.
Wang HJ,Tan YZ.Morphological characteristics and functional significance of autophagy in cells[J].J Anatomy,2009,40(5):844-849.
[5] 何 韬,谭玉珍,王海杰.自噬在巨噬细胞清除凋亡淋巴细胞中的作用[J].解剖学报,2008,39(4):514-518.
He T,Tan YZ,Wang HJ.The role of autophagy in the removal of apoptotic lymphocytes from macrophages[J].J Anatomy,2008,39(4):514-518.
[6] 何 颖,李冬梅,陶文雁,等.不同类型音乐对老年大鼠学习记忆能力及免疫机能的影响[J].中国免疫学杂志,2014,30(2):182-186.
He Y,Li DM,Tao WY,etal.Effects of different types of music on learning and memory ability and immune function in aged rats[J].Chin J Immunol,2014,30(2):182-186.
[7] 康 岩,李志杰,王丽娜,等.骨髓间充质干细胞分离鉴定及在糖尿病大鼠肾脏保护中的机制研究[J].中国免疫学杂志,2017,33(5):673-678.
Kang Y,Li ZJ,Wang LN,etal.Study on the isolation and identification of bone marrow mesenchymal stem cells and the mechanism of renal protection in diabetic rats[J].Chin J Immunol,2017,33(5):673-678.
[8] Chen H,Xia R,Li Z,etal.Mesenchymal stem cells combined with hepatocyte growth factor therapy for attenuating ischaemic myocardial fibrosis:assessment using multimodal molecular imaging[J].Scientific Rep,2016,67(13):1680-1680.
[9] Liu D,Gong L,Zhu H,etal.Curcumin inhibits transforming growth factor β induced differentiation of mouse lung fibroblasts to myofibroblasts[J].Front Pharmacol,2016,7:419.
[10] Jiang L,Zhang X,Zheng X,etal.Apoptosis,senescence,and autophagy in rat nucleus pulposus cells:Implications for diabetic intervertebral disc degeneration[J].J Orthopaedic Res,2013,31(5):692-702.
[11] Wang Z,Yang Y,Lu T,etal.Protective effect of autophagy inhibition on ischemia-reperfusioninduced injury of N2a cells[J].J Huazhong Univ Sci Technol Med Sci,2013,33:810-816.
[12] Liang X H,Jackson S,Seaman M,etal.Induction of autophagy and inhibition of tumorigenesis by beclin 1[J].Nature,1999,402(6762):672-676.
[13] Kang R,Zeh HJ,Lotze MT,etal.The Beclin 1 network regulates autophagy and apoptosis[J].Cell Death Differentiation,2011,18(4):571-580.