2015-2017年我国猪繁殖与呼吸综合征流行毒株遗传变异分析
2018-07-04刘晓东熊伯立杜元钊王小龙杨旭兵马振乾刘红祥张学伟朱小丽
刘晓东,熊伯立,杜元钊,王小龙,杨旭兵,马振乾,刘红祥,张学伟,朱小丽,高 丰
(1. 吉林大学动物医学学院,吉林长春 130012;2. 青岛易邦生物工程有限公司,山东青岛 266000;3. 上杭县蛟洋镇畜牧兽医水产局,福建上杭 364204;4. 福建省农业科学院畜牧兽医研究所,福建福州 350000)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(PRRS virus,PRRSV)引起的一种高度接触性传染病,临床上主要以各年龄猪的呼吸道症状和妊娠母猪晚期流产、早产,产弱仔、死胎或木乃伊胎为特征。我国PRRS疫情于1995年底首先发生在华北地区的规模化猪场,继而短时间内迅速传遍全国。自2006年以来,我国又出现了高致病性PRRSV,并对我国养猪业造成了巨大经济损失[1]。
GP5是PRRSV的主要结构蛋白之一,属于病毒的囊膜糖蛋白,能够诱导产生具有保护作用的中和抗体,并在病毒诱导细胞凋亡和识别细胞表面受体等方面发挥着极其重要的生物学功能。美洲型和欧洲型毒株的GP5蛋白分别为200和201个氨基酸,含有2~4个糖基化位点和一段31个氨基酸的信号肽。GP5蛋白具有较好的免疫原性,且其诱导的中和抗体出现之后,抗血清主要识别GP5蛋白。有研究表明,抗GP5抗体的效价跟血清对病毒的中和作用呈正相关[2]。本研究通过对2015-2017年所分离的PRRSVGP5基因序列进行分析,为当前PRRS防疫及研究提供一定的理论基础。
1 材料与方法
1.1 病毒样品
2015-2017年全国15省份58株PRRSV感染的临床样品。
1.2 主要试剂
RNA提取试剂盒:购于TAKARA公司;高保真反转录(RT)试剂盒:购于罗氏公司;LATaq DNA聚合酶:购于宝生物工程(大连)有限公司。
1.3 检测与测序
按照文献[3]介绍的RT-PCR方法进行检测。利用病毒RNA提取试剂盒提取总RNA,用RT试剂盒进行反转录反应。ORF5引物为:
上游:CATTTCATACACCTGAGACCAT;下游:AGATCATATATCATCACTGGCT。
反应条件为:50 ℃ 30 min,94 ℃ 2 min;94 ℃15 s,54 ℃ 30 s,68 ℃ 1 min,共 32 个循环,68 ℃延长10 min;15 g/L 凝胶电泳,150 V,25 min。将RT-PCR产物送大连宝生物公司进行测序。
1.4 分子进化分析
利用序列分析软件DNA star Lasergene,对所选毒株ORF5基因进行序列比对,分析其同源性,利用MEGA6软件制作进化树。
2 结果与分析
2.1 RT-PCR检测
对所检测样品GP5基因进行RT-PCR检测,检测到773 bp的目的条带,表明所检样品均为PRRSV(图1)。
图1 RT-PCR检测结果
2.2 分离毒株与代表毒株进化树
对58株野毒株GP5基因进行序列分析发现,以VR2332 MLV为代表的第一亚群有6株,以TJ2006/JXA12006/HUN42008为代表的第四亚群35株,以NADC30为代表的第五亚群11株,新亚群6株,没有分离到以CH1R/CH1A为代表的第二亚群,以及以HB1/HB2为代表的第三亚群毒株(图2)。
2.3 分离毒株与标准毒株间核苷酸及氨基酸同源性分析
将分离的野毒株核苷酸与标准毒株核苷酸,通过DNASTAR进行同源性对比发现:与第一亚群在同一分支的6株野毒株与第一亚群同源性为93.7%~99.3%,与其他亚群同源性为83.1%~91.4%;与第四亚群在同一分支的35株野毒株与第四亚群同源性为94.9%~99.7%,与其他亚群同源性为83.3%~94.4%;与NADC30为代表的第五亚群在同一分支的11株野毒与第五亚群同源性为94.2%~99.7%,与其他亚群同源性为82.3%~90.2%;6株新亚群之间的同源性为93.7%~99.2%,与其他亚群同源性为82.1%~85.6%。
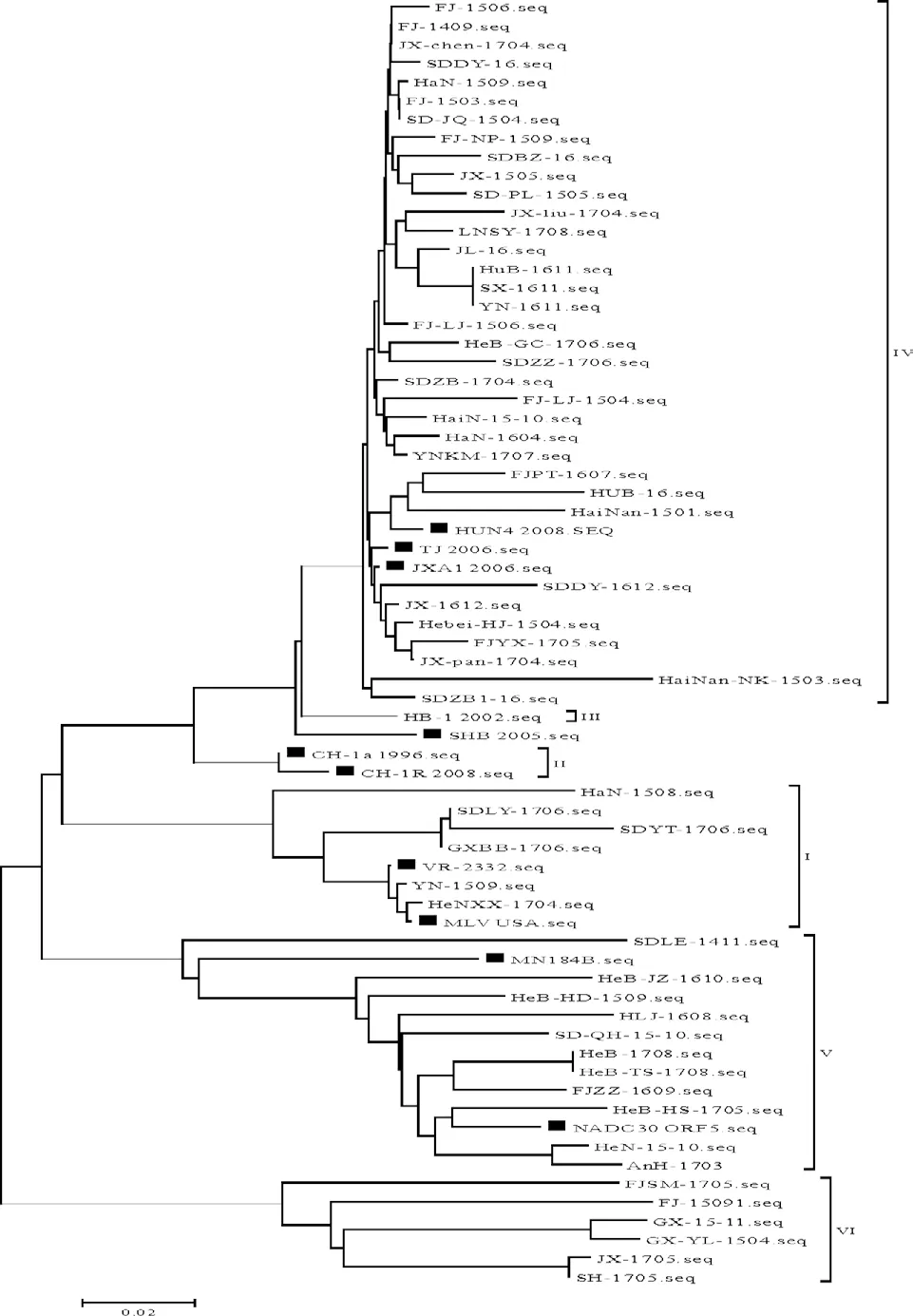
图2 PRRSV分离株遗传进化树
氨基酸对比发现:6株第一亚群野毒株与代表毒株VR2332同源性为92.8%~98.9%,与其他亚群同源性为81.8%~89.3%;第四亚群的35株野毒与代表毒株TJ-F92、JXA1等同源性为93.1%~99.4%,与其他亚群同源性为82.7%~95.1%;11株第五亚群与代表毒株NADC30同源性为94.1%~98.9%,与其他亚群同源性为81.3%~89.1%;新亚群6株野毒之间同源性为93.2%~97.85%,与其他亚群同源性为81.6%~85.3%。
2.4 氨基酸序列进化分析
与PRRSV GP5相关的毒力位点为氨基酸第13和151位[4-5]。以VR2332为代表的第一亚群毒株毒力位点为R13、R151,以CH1R为代表的第二亚群毒株毒力位点为R13、R151,以HB-2为代表的第三亚群毒株毒力位点为R13-Q13,以JXA1/TJ2006为代表的第四亚群毒株毒力位点为R13、R151,以NADC30为代表的第五亚群毒株毒力位点为Q13、K151。分离的第一亚群6株野毒株中,有2株(YN-1509/HeNXX-1704)的第13位点为Q13,其他均为R13;第四亚群的35株野毒株的第13位点均为R13;第五亚群11株野毒株的第13位点,除HeB-JZ-1610为P13外,其他均为Q13;6株新亚群野毒中,FJSM-1705为R13,FJ-15091/gx-15-11/gx-yl-1504为Q13,JX-1705/SH-1705为P13。6株分离的第一亚群毒株氨基酸151位点中,HENXX为G151,其他为R151;第四亚群中,11株为R151,其他为K151;分离的11株第五亚群毒株中,FJZZ-1609为R151,其他为K151;分离的6株新亚群均为K151。
PRRSV氨基酸序列的中和表位是位于第37~44位的SH(F/L)QLIYN,其中F/L39为中和抗体的表达位点[6]。以VR2332毒株为代表的第一亚群为L39,以CH1R毒株为代表的第二亚群为F39,以HB-2毒株为代表的第三亚群为F39,以TJ2006/JXA1、HUN4毒株为代表的第四亚群为I39,以NADC30毒株为代表的第五亚群为L39。2015-2017年所分离的58株野毒株中,6株第一亚群野毒株的中和抗体位点为L39,35株第四亚群野毒株中和抗体位点为I39,11株第五亚群中和抗体的位点为L39,6株新亚群中和抗体的位点为S39。
对 于 3个 N-糖 基 化 位 点(N33、N44和N51),N33有变化,N44与N51没有变化。标准毒株中,第一亚群为N33,第二亚群为N34,第三亚群N34,第四亚群中的代表毒株均为N34N35,第五亚群的代表毒株均为N34S35。2015-2017年分离的毒株中,有6株为第一亚群,其中SDLY-1706/SDYT-1706第33位点为S33,其他4株为N33。35株第四亚群中,LNSY-1708/JL-16/YNKM-1707/SDDY-1612为S35,其他31株为N35;第34位点变化较大的有N34、G34、S34。11株第五亚群中,第34、35位氨基酸位点均为N34S35。6株第六亚群中第33、34、35位氨基酸位点均为G33N34S35(图3)。

图3 2015-2017年分离PRRSV株氨基酸分析
3 讨论
自2006年江西省暴发高致病性PRRS疫情[1]后,PRRSV由于感染压力及自然选择,其基因序列不断发生变异和重组,从而使该病防控成为难题。目前有效的疫苗免疫仍是防治PRRS的最有效手段。PRRSVGP5基因编码的蛋白是PRRSV主要的免疫原性蛋白,是刺激机体产生中和抗体的重要蛋白。在2015-2017年分离的58株PRRSV毒株中,有6株属于以VR2332为代表的第一亚群,35株属于以JXA1/TJM-F92为代表的第四亚群,11株属于NADC30为代表的第五亚群,6株属于新亚群。由此可以发现,我国PRRSV毒株存在易变异和多样性等特点,并且所分离毒株并没有严格的地域差异,这为PRRS的防疫带来了更大挑战。
囊膜糖蛋白GP5在PRRSV感染的细胞内虽然表达水平较低,但它却是主要的免疫原性蛋白。在不同毒株间,GP5蛋白是各结构蛋白中变异最大的[7],其氨基酸位点变化可以改变中和抗体效果。在2015-2017年所分离的58株野毒株中,6株第一亚群野毒株中和抗体位点为L39,35株第四亚群野毒株中和抗体位点为I39,11株第五亚群中和抗体位点为L39,6株新亚群中和抗体的位点为S39。由此可推断中和表位在不断变化并逐步变异。GP5蛋白一些主要位点的变异并无地域性差
异,随着时间的推移和基因亚型的改变,中和保护位点也在不断发生变化。从2015-2017年的分离株基因分析来看,GP5蛋白第151位毒力位点发生的变化较大,由第一亚群R151向第六亚群K151转变,这与李广兴[8]等的研究一致。野毒株R151变异主要影响PRRSV中和抗体抑制病毒的效果,但关于病毒毒力的影响尚未见报道[4]。由此推测,不同地方分离毒株间存在一定的毒力差异;GP5蛋白第151位毒力位点的不同导致不同亚群GP5抗体抑制PRRSV的能力存在差异。关于3个N-糖基化位点(N33、N44和N51)的变化,N33变化较大,而N44与N51则没有变化。由此推断,N-糖链糖基化位点也在变异,但是这个突变是否影响病毒毒力,有待进一步证实。
4 结论
通过以上结果可以得出以下结论:我国PRRSV毒株呈多亚群共存,不同亚群毒株毒力及中和保护位点存在差异,同一亚群毒株毒力及保护位点也有差异。这些基因序列的变化为该病防疫带来了较大压力。因此,针对PRRS防控,必须进行田间毒株的检测和基因分析,然后选择相应基因型毒株疫苗进行免疫,切勿盲目选择疫苗,以免造成经济损失。
[1] TIAN K,YU X,ZHAO T,et al. Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J]. PLos one,2007,2:e526.
[2] 谷红,杨汉春,郭鑫,等. PRRSV BJ-4株ORF5基因的原核表达与重组蛋白的纯化[J].畜牧兽医学报,2004,35(1):64-69.
[3] 童光志,周艳君,郝晓芳,等. 高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007,29(5):323-326.
[4] ALLENDE R,KUTISH G F,LAEGREID W,et al.Mutations in the genome of porcine reproductive and respiratory syndrome virus responsible or the attenuation phenotype[J]. Archives of virology,2000,145(6):1149-161.
[5] YANG S X. Comparative sequence analysis of open reading frames 2 to 7 of the modified live vaccine virus and other North American isolates of the porcine reproductive and respiratory syndrome virus [J]. Archives of virology,1998,143(3):601-612.
[6] PLAGEMANN P G. The primary GP5 neutralization epitope of North American isolates of porcine reproductive and respiratory syndrome virus[J]. Veterinary immunology and immunopathology,2004,102(3):263-275.
[7] 张春玲,臧克伟,张婉华,等. 猪繁殖与呼吸综合征病毒(PRRSV)S-1株GP5蛋白和N蛋白的原核表达[J]. 江西农业大学报,2007,29(6):876-878.
[8] 李广兴,李沛然,李鹏冲,等. 2006-2012年猪繁殖与呼吸综合征病毒东北毒株GP5和M基因变异分析[J]. 东北林业大学学报,2016,47(3):1-10.
