CCK8和PGE2对CVB体外攻击人外周血pDC的调控①
2018-07-06贾苗苗齐莉莉刘文宣贾娴娴
贾苗苗 齐莉莉 李 慧 高 翔 刘文宣 贾娴娴
(河北医科大学基础医学院病原生物学教研室,石家庄 050017)
树突状细胞(Dendritic cells,DC)是机体功能最强的专职抗原递呈细胞,能通过模式识别受体高效地摄取、加工处理和递呈抗原,继而激活naïve T 细胞[1]。DC处于启动、调控、并维持免疫应答的中心环节,DC失控将会导致严重的疾病状态[2-4]。Toll样受体(Toll-like receptors,TLR)是一类重要模式识别受体,人类CD1c-CD123highCD303+CD304+浆细胞样DC(plasmacytoid dendritic cells,pDC)选择性表达TLR7和TLR9[5]。CD1c+CD123low传统的DC(conventional DC,cDC)包括循环中的髓样DC(myeloid dendritic cells,mDC)表达TLR1、TLR2、 TLR3、TLR4、TLR5、TLR6、TLR7[6],和在体外产生的单核细胞来源的DC(moDC)表达TLR1、TLR2、 TLR3、TLR4、TLR5、TLR8[7]。在人类,TLR9只在pDC上表达,一旦暴露到病毒触发器,pDC快速生产大量的Ⅰ型IFN[8],不仅可以直接抑制病毒的复制,而且还诱导NK细胞、B细胞、T细胞、cDC的激活,诱导和放大抗病毒免疫应答。恰当的固有免疫应答可以防止病原体的感染,维持机体的健康,但是TLR信号的无限制活化将会引起机体功能的严重紊乱,导致严重的免疫病理损伤。因此,TLR信号系统必须得以严格的控制,以达到免疫稳态和避免免疫相关的病理损伤。大量研究表明柯萨奇病毒B(Coxsackie virus B,CVB)触发的pDC活化在导致病毒性心肌炎患者严重组织病理损伤中发挥了关键作用[9,10],但目前关于pDC功能调控机制的研究却并不深入。
胆囊收缩素(Cholecystokinin,CCK)是一种典型的脑肠肽和免疫调节肽。在体内以多种分子形式存在,八肽胆囊收缩素(Cholecystokinin octapeptide,CCK8)是体内含量最高且具有CCK全部生物活性的最小分子形式。它通过内分泌、旁分泌以及自分泌等多种方式作用于靶细胞,与CCK1受体(CCK1R)或CCK2受体(CCK2R)结合,介导相应的适应性细胞保护作用。近几年来,本课题组做了许多有关CCK8抗内毒素休克和抗炎维持机体内稳态的研究工作[11-13]。在炎症刺激因素作用下,单核细胞、巨噬细胞、成纤维细胞等多种细胞可以分泌PGE2,这表明体内炎症反应局部的pDC是暴露于PGE2的环境中的。PGE2可以调节DC的多种生物学功能,比如成熟细胞因子的生产、T细胞的活化和凋亡。所以,本研究旨在体外模拟体内,探讨PGE2存在时免疫调节肽CCK8能否参与调控柯萨奇病毒B诱导的人外周血浆细胞样树突状细胞(pDC)的活化,以期对CVB导致的病毒性心肌炎的治疗提供新的思路。
1 材料与方法
1.1实验材料、试剂 CCK8、PGE2购自Sigma公司,CVB为本实验室保存,Human CD304 MicroBeads、LS Columns购自Miltenyi Biotec公司,重组人白细胞介素3(Recombinant human interleukin 3,IL-3)购自Pepro Tech公司,Rabbit anti-human CCK1R及Mouse anti-human CCK2R购自Santa Cruz公司,FITC anti-human CD303、PE anti-human CD1c、PE/Cy5 anti-human CD123、FITC anti-human CD80、FITC anti-human CD86和FITC anti-human MHC class Ⅱ以及其所需相应的同型对照抗体均购自BD公司,PrimescriptTMRT reagent kit、SYRP Premix Ex TagTMKit购自大连宝生物公司,TRIzol Reagent购自Invitrogen公司,Human IFN-α ELISA Kit购自eBioscience公司。
1.2方法
1.2.1细胞来源及培养 新鲜分离的健康志愿者抗凝外周血白细胞由河北省血液中心提供,通过淋巴细胞分离液密度梯度离心,获得外周血单个核细胞(PBMC),加入 Human CD304 MicroBeads,采用 mini MACS 免疫磁珠分离系统分离纯化CD304+pDC。分离纯化的pDC在含IL-3(10 ng/ml)的RPMI1640完全培养基中,37℃ 5%CO2,培养4 d,分化为静息状态的pDC,然后离心弃上清,加入CVB(100 TCID50)攻击pDC 30 min,离心弃上清后加入含有CCK8或PGE2的完全培养基培养24 h。具体分为五组:control组;CVB组;CVB+CCK8组;CVB+PGE2组;CVB+PGE2+CCK8组。
1.2.2流式细胞技术检测pDC纯度 收集Human CD304 MicroBeads 分选的pDC,用PBS洗1次,分别加入FITC anti-human CD303、PE anti-human CD1c、PE/Cy5 anti-human CD123抗体,4℃避光孵育30 min,PBS洗2遍,流式细胞仪检测鉴定CD1c-CD123highCD303+pDC细胞纯度。
1.2.3RT-PCR检测胆囊收缩素受体mRNA的表达 收集免疫磁珠分选纯化的pDC和经CVB 体外攻击的pDC,根据Trizol说明书提取细胞总RNA,检测RNA纯度和完整性后反转录成cDNA,以cDNA为模板,在ABI 7500 Real-time PCR仪上进行实时荧光定量PCR反应,检测CCK1R和CCK2R mRNA的表达;琼脂糖凝胶电泳及测序验证PCR产物的特异性。引物由上海生物技术工程有限公司合成如表1。
1.2.4免疫荧光技术检测胆囊收缩素受体的表达 收集免疫磁珠分选纯化的pDC和经CVB体外感染的pDC,4%多聚甲醛固定,分别加入一抗(兔抗人CCK1R抗体和鼠抗人CCK2R抗体),二抗(FITC标记的山羊抗兔和texas red标记的山羊抗小鼠IgG),另外采用DAPI复染细胞核,PBS代替一抗作阴性对照,PC12细胞做阳性对照细胞。甘油封片后,于激光共聚焦显微镜下采集图像,观察CCK1R和CCK2R 蛋白的表达。
1.2.5流式细胞术检测细胞表型 分组培养pDC,control组;CVB组;CVB+PGE2(10-7mol/L)组;CVB+CCK8(10-8mol/L)组;CVB+PGE2(10-7mol/L)+ CCK8(10-8mol/L)组,收集不同处理组的pDC,用PBS洗1次,分别加入 FITC anti-human CD80、FITC anti-human CD86、FITC anti-human MHC class Ⅱ和FITC anti-human CCR7抗体,4℃避光孵育30 min,PBS洗2遍,流式细胞仪检测。每次实验用同型抗体作为对照。用平均荧光强度(mean)表示CD80、CD86、MHC Ⅱ和CCR7蛋白表达量。
1.2.6ELISA技术检测细胞因子的含量 纯化pDC按上述不同因素处理培养24 h后,收集培养上清,按ELISA试剂盒说明书操作流程检测人IFN-α的含量。
1.2.7RT-PCR检测IFN-α mRNA的表达 收集不同处理组的pDC,根据Trizol说明书提取细胞总RNA,检测RNA纯度和完整性后反转录成cDNA,以cDNA为模板,在ABI 7500 Real-time PCR仪上进行实时荧光定量PCR反应,检测IFN-α mRNA的表达。引物由上海生物技术工程有限公司合成,如表2。
2 结果
2.1CCK受体在pDC上的表达 免疫磁珠分选纯化的pDC,流式细胞仪检测结果显示CD303阳性细胞大于99%,同时高表达CD123,提示CD1c-CD123highCD303+pDC纯度大于99%,结果如图1所示。分选获得的pDC在含IL-3(10 ng/ml)的RPMI1640完全培养基中培养4 d,分化为静息状态的pDC,然后给予CVB(100 TCID50)体外攻击30 min。收集细胞,检测不同状态的pDC CCK1R和CCK2R表达。经统计学分析发现,CCK1R、CCK2R蛋白表达及mRNA表达在CVB体外攻击后均增加(P<0.05 vs control),结果如图2、3所示,提示CCK8系统可能参与了CVB体外攻击人外周血pDC的调控。然而,我们在人外周血pDC中并没有检测到CCK mRNA,也未发现CCK蛋白的表达。提示,CCK8并非通过自分泌而是旁分泌或内分泌的方式作用于pDC,参与免疫调节作用。
2.2CCK8和PGE2对CVB诱导的协同刺激分子表达的影响 未经CVB诱导的pDC表达较低水平的CD80、CD86及HLA-DR;经CVB诱导的pDC协同刺激分子CD80、CD86和HLA-DR的表达显著增高(P<0.05);CCK8(10-8mol/L)可以抑制CVB诱导的CD80、CD86和HLA-DR的表达,提示CCK8可抑制CVB诱导的pDC表型成熟(P<0.05 vs CVB组);然而PGE2(10-7mol/L)对CVB诱导的协同刺激分子CD80、 CD86和HLA-DR的表达增高有促进作用(P<0.05 vs CVB组)。提示CCK8和PGE2双向调控CVB诱导的pDC协同刺激分子的表达,结果如图4所示。
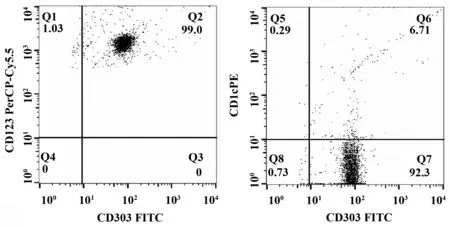
图1 流式细胞技术检测pDC纯度Fig.1 Detect purity of pDC by flow cytometryNote:The purity of CD1c-CD123highCD303+pDC was 99%.
表1CCK1R和CCK22R引物序列
Tab.1PrimersequencesofCCK1RandCCK2R
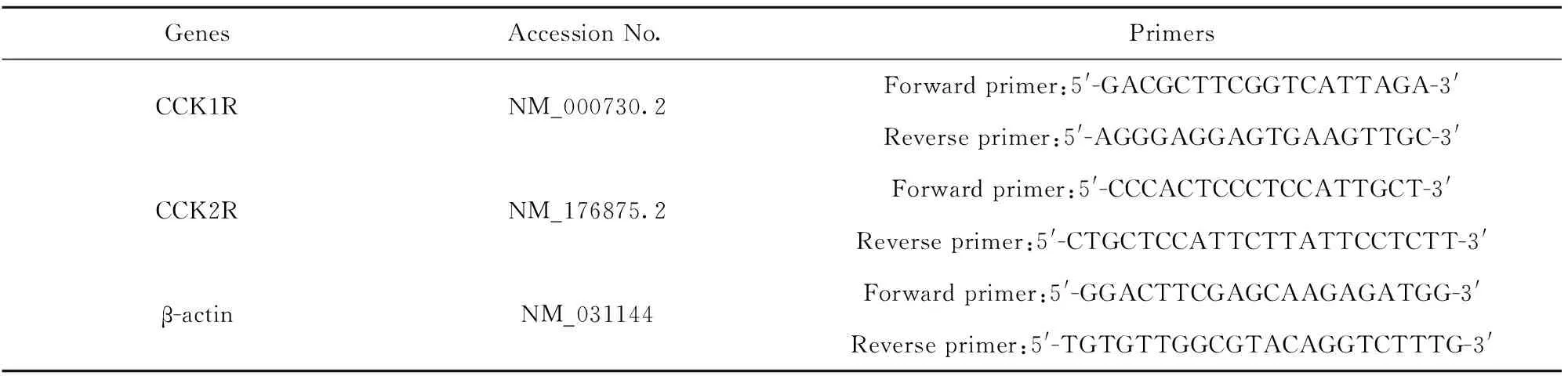
GenesAccession No.PrimersCCK1RNM_000730.2Forward primer:5'-GACGCTTCGGTCATTAGA-3'Reverse primer:5'-AGGGAGGAGTGAAGTTGC-3'CCK2RNM_176875.2Forward primer:5'-CCCACTCCCTCCATTGCT-3'Reverse primer:5'-CTGCTCCATTCTTATTCCTCTT-3'β-actinNM_031144Forward primer:5'-GGACTTCGAGCAAGAGATGG-3'Reverse primer:5'-TGTGTTGGCGTACAGGTCTTTG-3'
表2IFN-α引物序列
Tab.2PrimersequencesofIFN-α

GenesAccession No.PrimersIFN-αNM_002171Forward primer:5'-GGAGGAAGGATTGAAAACTGG-3'Reverse primer:5'-GATGAAGTGAGACATCAGAATGG-3'
2.3CCK8和PGE2对CVB诱导趋化因子受体表达的影响 未经CVB诱导的pDC表达较低水平的CCR7;经CVB诱导的pDC协同刺激分子CCR7的表达显著增高(P<0.05);CCK8(10-8mol/L)可以促进CVB诱导的CCR7的表达,提示CCK8可促进CVB诱导的pDC的趋化(P<0.05 vs CVB组);PGE2(10-7mol/L)对CVB诱导的趋化因子受体CCR7的表达增高也有促进作用(P<0.05 vs CVB组)。提示CCK8和PGE2均可促进CVB诱导的pDC趋化,结果如图5所示。
2.4CCK8和PGE2对CVB诱导pDC产生IFN-α的调控 收集不同因素作用后的各组细胞的培养上清,用ELISA法检测IFN-α的含量,RT-PCR检测IFN-α mRNA的表达。未经CVB诱导的pDC,表达较低水平的IFN-α mRNA;经CVB诱导的pDC,IFN-α mRNA的表达显著增高(P<0.05);CCK8可以剂量依赖性抑制IFN-α mRNA表达的增高(P<0.05 vs CVB组),且对pDC存活无明显影响;PGE2(10-7mol/L) 对CVB诱导IFN-α mRNA的表达有促进作用(P<0.05 vs CVB组)。同时,培养上清中IFN-α含量检测结果也证明体外给予CCK8(10-8mol/L),可以抑制CVB诱导的pDC分泌IFN-α(P<0.05 vs CVB组),相反PGE2可以促进pDC分泌IFN-α(P<0.05 vs CVB组)。提示CCK8和PGE2参与了CVB诱导pDC产生Ⅰ型干扰素的双向调控作用,结果如图6所示。

图2 RT-PCR检测CCK1R和CCK2R mRNA的表达Fig.2 Detect CCK1R and CCK2R mRNA by RT-PCRNote:The mRNA expression of CCK1R and CCK2R was up-regulated by CVB attack.*.P<0.05.


图3免疫荧光技术检测CCK1R和CCK2R蛋白的表达
Fig.3ExpressionofCCK1RandCCK2Rproteindetectedbyimmunofluorescencetechnique
Note: Green fluorescence stands for CCK1R protein;Red fluorescence stands for CCK2R protein.A.Control group;B.CVB group;C.Control group;D.CVB group.The expression of CCK1R and CCK2R was up-regulated by CVB attack.*.P<0.05 vs Control,t-test.

图4 流式细胞技术检测协同刺激分子的表达Fig.4 Expression of costimulatory molecules detect by flow cytometryNote:CCK8 repressed the expression of costimulatory molecules on CVB-attacked pDC.P<0.05,CVB+CCK8 vs CVB,t-test,while PGE2 promoted it(*.P<0.05).

图5 流式细胞技术检测CCR7的表达Fig.5 Expression of CCR7 detected by flow cytometryNote:CCK8 and PGE2 promoted the expression of CCR7 on CVB-attacked pDC.*.P<0.05.
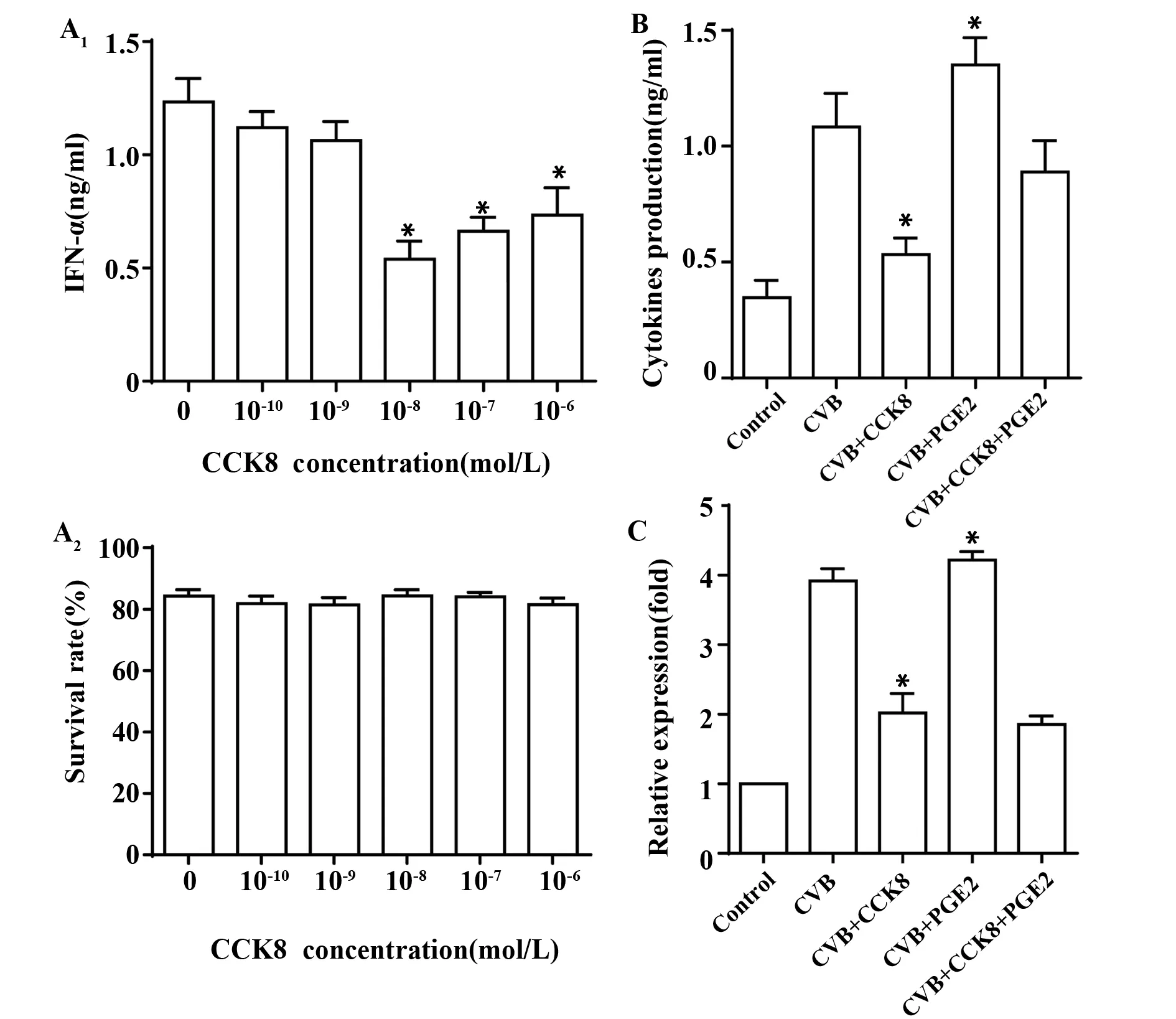
图6 RT-PCR和ELISA 法检测IFN-α的合成和分泌Fig.6 Synthesis and secretion of IFN-α detected by RT-PCR and ELISANote:A.Exogenous CCK8 inhibited the IFN-α synthesis,dose-dependently,in vitro;B.CCK8(10-8mol/L)inhibited CVB induced IFN-α mRNA expression,while PGE2 promoted;C.CCK8(10-8mol/L)inhibited CVB induced IFN-α secretion,while PGE2 promoted.*.P<0.05.
3 讨论
CVB是一种常见的肠道病毒,感染后大部分患者表现为隐性感染或只表现为一般感冒症状,少数患者则表现为严重的心肌炎,甚至导致猝死,也可发展为扩张性心肌病[14]。有研究证实,CVB 感染导致的心肌炎并非由CVB 直接破坏心肌细胞引起,很大程度上是由于过强的免疫应答导致的心肌损伤[15]。因此,不同的临床表现与不同的免疫反应有关。病毒感染,可以激活浆细胞样树突状细胞(pDCs),并迅速产生大量Ⅰ型IFN,这不仅可以直接抑制病毒复制而且还可诱导NK细胞、B细胞、T细胞、cDCs发生免疫应答。但Ⅰ型IFN的大量产生和免疫系统的过度活化也将对机体组织造成免疫病理损伤[16]。CVB触发的pDCs细胞活化在导致病毒性心肌炎患者严重组织病理损伤中发挥了关键作用,但目前关于pDCs细胞功能负向调控机制的研究却并不深入。有研究提示餐后释放的胆囊收缩素(Cholecystokinin,CCK)类物质,除了干预消化系统功能外,还能干预神经信号的转导以及免疫应答反应,之间存在异常复杂的相互作用。CCK是一个激素家族,CCK8是拥有完整生物活性的最小片段。人外周血pDC是病毒感染的主要防御者。我们的研究证明体外给予CVB,刺激活化人外周血pDC,CCK1R和CCK2R的表达显著升高,pDCs的活化对它们的表达有明显的正向调节作用。CCK受体表达的增加可能是人体应激状态下神经、内分泌、免疫系统的一种保护性机制或者是它们之间进行的信息传递。我们的研究结果表明作为一种免疫调节因子的CCK8,体外可以抑制CVB刺激诱导的pDCs表型的成熟,而且,CCK8会抑制CVB诱导的IFN-α的合成与分泌。体外由CCK8所诱导的对人pDC活化的调节,也许将为CVB感染后引起的病毒性心肌炎提供以调控免疫为基础的新疗法。机体存在精密的负向免疫调控机制以保证 TLR 信号的适度活化,CCK8因此将会被用于免疫应答调节,以防止TLR 通路过度活化引发的免疫应答紊乱。
在炎症刺激因素作用下,单核细胞、巨噬细胞、成纤维细胞等多种细胞可以分泌PGE2,这表明体内炎症反应局部的pDC是暴露于PGE2的环境中的。PGE2可以调节DC的多种生物学功能[17],比如成熟细胞因子的生产、T细胞的活化和凋亡。同时也观察了在PGE2存在时CCK8对pDCs表型成熟的影响。结果表明,体外PGE2单独作用可以促进抑制CVB刺激诱导的pDCs表型的成熟和IFN-α的合成与分泌。而CCK8(10-8mol/L)能抑制PGE2(10-7mol/L)对CVB诱导的pDC协同刺激分子CD80、CD86和HLA-DR的表达以及IFN-α的合成与分泌的促进作用。提示CCK8和PGE2可以双向调控CVB诱导pDC的免疫应答水平。
CCK8作为一种免疫抑制剂或细胞激素参与调控CVB诱导的人类pDCs活化,从而防止发生免疫过度引发的免疫病理损伤,这已非常清楚。我们前期研究结果证明CCK8可以通过CCK2R调节重要的信号分子TRAF6的表达,进而抑制TLR9诱导的pDC的活化。TRAF6是NF-κB、MAPK、IRF7等激活过程中重要的衔接蛋白,CCK受体属于G蛋白偶联受体(GPCR),TLR-MyD88-TRAF6和GPCR-PI3K/PKA/PKC/CAMK信号通路之间的相互联系机制尚未明了,这需要更深入的研究来解决。但所有这些结果提醒我们,CCK8对于pDCs免疫功能的调节不容忽视,这将为CVB 感染导致的心肌炎提供新的治疗手段。
参考文献:
[1] Benvenuti F.The dendritic cell synapse:a life dedicated to T cell activation[J].Front Immunol,2016,7:70.
[2] 叶丽萍,胡静涛,王春凤.树突状细胞与轮状病毒相互作用机制研究进展[J].中国免疫学杂志,2017,33(6):947-950.
Ye LP,Hu JT,Wang CF.Recent progress in the mechanism of interaction between dendritic cells and rotavirus[J].Chin J Immunol,2017,33(6):947-950.
[3] McGovern N,Shin A,Low G,etal.Human fetal dendritic cells promote prenatal T-cell immune suppression through arginase-2[J].Nature,2017,546(7660):662-666.
[4] Anguille S,Van de Velde AL,Smits EL,etal.Dendritic cell vaccination as postremission treatment to prevent or delay relapse in acute myeloid leukemia[J].Blood,2017,130(15):1713-1721.
[5] Macri C,Pang ES,Patton T,etal.Dendritic cell subsets[J].Semin Cell Dev Biol,2017,doi:10.1016/j.semcdb.2017.12.009.
[6] Patel VI,Metcalf JP.Identification and characterization of human dendritic cell subsets in the steady state:a review of our current knowledge[J].J Investig Med,2016,64(4):833-847.
[7] Alculumbre S,Pattarini L.Purification of human dendritic cell subsets from peripheral blood[J].Methods Mol Biol,2016,1423:153-167.
[8] Stead SO,McInnes SJP,Kireta S,etal.Manipulating human dendritic cell phenotype and function with targeted porous silicon nanoparticles[J].Biomaterials,2018,155:92-102.
[9] Hamalainen S,Nurminen N,Ahlfors H,etal.Coxsackievirus B1 reveals strain specific differences in plasmacytoid dendritic cell mediated immunogenicity[J].J Med Virol,2014,86(8):1412-1420.
[10] Wu F,Fan X,Yue Y,etal.A vesicular stomatitis virus-based mucosal vaccine promotes dendritic cell maturation and elicits preferable immune response against coxsackievirus B3 induced viral myocarditis[J].Vaccine,2014,32(31):3917-3926.
[11] Jia X,Cong B,Zhang J,etal.CCK8 negatively regulates the TLR9-induced activation of human peripheral blood pDCs by targeting TRAF6 signaling[J].Eur J Immunol,2014,44(2):489-499.
[12] Zhang JG,Liu JX,Jia XX,etal.Cholecystokinin octapeptide regulates the differentiation and effector cytokine production of CD4(+)T cells in vitro[J].Int Immunopharmacol,2014,20(2):307-315.
[13] Zhang D,Li H,Geng J,etal.The therapeutic effects of cholecystokinin octapeptide on rat liver and kidney microcirculation disorder in endotoxic shock[J].Immunopharmacol Immunotoxicol,2017,39(1):2-10.
[14] Liao Y,Chen KH,Dong XM,etal.A role of pre-mir-10a coding region variant in host susceptibility to coxsackie virus-induced myocarditis[J].Eur Rev Med Pharmacol Sci,2015,19(18):3500-3507.
[15] Cen Z,Guo Y,Kong Q,etal.IL-10-producing B cells involved in the pathogenesis of Coxsackie virus B3-induced acute viral myocarditis[J].Int J Clin Exp Pathol,2015,8(1):830-835.
[16] Teijaro JR.Type I interferons in viral control and immune regulation[J].Curr Opin Virol,2016,16:31-40.
[17] Maric J,Ravindran A,Mazzurana L,etal.PGE2 suppresses human group 2 innate lymphoid cell function[J].J Allergy Clin Immunol,2018,141(5):1761-1773.