低毒性金葡萄球菌肠毒素A D227A突变体的原核表达、纯化及鉴定①
2018-07-06刘雪婷曾丽萍张建国邹泽红陶爱林
刘雪婷 曾丽萍 谢 洋 张建国 邹泽红 陶爱林
(广州医科大学附属第二医院,广东省过敏反应与免疫重点实验室,呼吸疾病国家重点实验室,广州 510260)
金黄色葡萄球菌肠毒素A(Staphylococcal Enterotoxins A,SEA)的研制是国内外抗肿瘤新药研究的热点之一。SEA是一种细菌超抗原,在极低剂量时(以ng计)即可直接与抗原提呈细胞APC的MHC-Ⅱ类分子和T细胞抗原识别受体(TCR)Vβ片段高亲和力地结合,刺激T细胞增殖并释放TNF-α、TNF-β、IFN-γ、IL-2、IL-6和IL-12等多种细胞因子[1-3]。实验证明,TNF-α、TNF-β和IFN-γ具有明显的抗肿瘤作用;TNF-α和TNF-β 还有显著的抗肿瘤协同效应,而IFN-γ 和 TNF 有利促进肿瘤细胞表达MHCⅡ类分子及黏附分子,有利于细胞毒T淋巴细胞(Cytotoxic T lymphocyte,CTL)与肿瘤细胞的结合,增强肿瘤刺激宿主免疫系统的能力[4,5]。
然而,SEA除了有效发挥激活T细胞而参与杀伤MHCⅡ阳性的肿瘤细胞的积极作用,却也是世界范围内人类最常见的细菌毒素,可引起食物中毒和中毒性休克综合征[4-6]。食物中毒的主要症状是摄取受污染食物后1~4 h内发生的恶心、呕吐、腹部痉挛和腹泻,甚至导致危及生命的中毒性休克综合征[4-6]。SEA的这些“毒性作用”,被认为是限制SEA在临床上进一步推广应用的原因[4-6]。研究表明,精氨酸替代第225(H)或者227(D)位氨基酸后,SEA与MHCⅡ的亲和力将降低1 000倍[7],消除了原来SEA诱导的呕吐,但仍保留其免疫活性[7-9]。本研究通过PCR技术克隆SEAD227A基因,建立原核表达系统,重组表达了SEAD227A蛋白,为SEA的毒性弱化及临床应用奠定基础。
1 材料与方法
1.1实验材料、试剂 DNA序列合成、测序以及引物合成均由铂尚生物技术(上海)有限公司完成;T4 DNA连接酶、PrimeSTAR HS超保真DNA聚合酶、NdeⅠ和XhoⅠ限制性内切酶购自TaKaRa;克隆宿主大肠杆菌JM109、表达宿主大肠杆菌Rosetta BlueTM由本实验室保存;蛋白预染Marker、显色液Pierce ECL Western blot Substrate购于Thermo公司;StrepⅡ亲和填料购于GE公司;StrepⅡ单克隆抗体购于Merck公司。
1.2实验方法
1.2.1金葡菌基因组DNA的提取 配制细菌裂解液:20 mmol/L Tris-HCl,pH8.0,2 mmol/L sodium EDTA,1.2% Triton X-100,20 g/L溶菌酶(使用前加入)。挑取待测菌株单个菌落接种于5 ml的LB培养基中,于37℃摇床振荡过夜。在1.5 ml的离心管中加入1 ml细菌的过夜培养物,13 000~16 000 g(离心半径为8 cm)离心1 min沉淀菌细胞,去上清(最大细胞数<2×109)。参照Qiagen DNA提取试剂盒说明书进行提取。
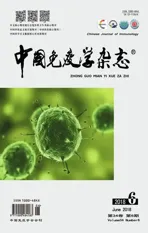
1.2.2PCR扩增SEA成熟肽基因 以金葡菌基因组DNA为模板,PCR获得SEA基因片段。引物序列为F1,5′-AGCGAGAAAAGCGAAGAAAT-3′及R1 5′-ACTTGTATATAAATATATAT-3′。PCR反应条件为:预变性 94℃ 5 min,变性 94℃ 30 s,退火 60℃ 30 s,延伸 72℃ 60 s,32个循环,延伸72℃ 5 min,扩增片段长度为702 bp。PCR 扩增产物用1.0%琼脂糖凝胶电泳进行鉴定。
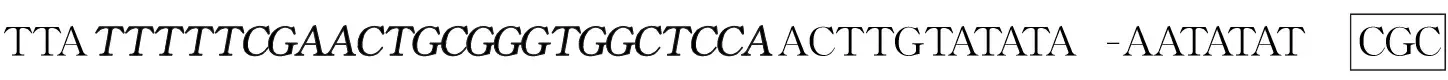
1.2.4pET44a-SEAD227A载体的构建及鉴定 限制性核酸内切酶NdeⅠ和XhoⅠ对PCR产物(SEAD227A)及质粒pET44a进行双酶切后,在T4 DNA连接酶作用下16℃连接过夜。用氯化钙法制备感受态,连接产物转化大肠杆菌JM109,将转化的菌液涂布于含氨苄青霉素的LB平板上,37℃培养12 h,进行菌落PCR鉴定,并挑取阳性克隆,扩大培养后小量提取质粒,进行NdeⅠ和XhoⅠ双酶切鉴定,阳性质粒送铂尚生物技术(上海)有限公司测序。使用在线BLAST软件(http://blast.ncbi.nlm.nih.gov/BlastAlign.cgi)将结果与SEA基因进行比对。
1.2.5SEAD227A基因在大肠杆菌的诱导表达与鉴定 重组质粒pET44a-SEAD227A转化大肠杆菌表达菌株Rosetta,37℃,LB培养基中扩增。当浓度达到0.6(600 nm)时,加入1 mmol/L IPTG 37℃诱导6 h。4℃,4 300 g离心30 min,收集菌体。SDS-PAGE检测蛋白表达结果,并通过Western blot鉴定目的蛋白。
1.2.6包涵体的清洗 扩大培养表达菌,用破碎缓冲液(25 mmol/L Phosphate Buffer,150 mmol/L NaCl,2 mmol/L EDTA,10%甘油,pH7.5)悬浮菌体,超声波破碎菌体后4 300 g离心30 min,收集包涵体。用清洗液(50 mmol/L Tris,2%TritonX-100,1 mmol/L EDTA,pH7.5)清洗包涵体2次。SDS-PAGE电泳分析目的蛋白在包涵体及破碎上清的表达情况及包涵体的清洗效果。
1.2.7包涵体的复性 包涵体溶于变性溶液(6 mol/L 盐酸胍,10 mmol/L DTT,100 mmol/L Tris,2 mmol/L EDTA,pH8.0)中,包涵体浓度为0.5 mg/ml。通过梯度透析法对变性的包涵体进行复性。在4℃下,依次用含4、2及1 mol/L尿素的复性液(150 mmol/L NaCl,50 mmol/L Tris,1 mmol/L EDTA,1 mmol/L 半胱氨酸,3 mmol/L GSSG,3 mmol/L GSH,0.2%L-精氨酸和10%甘油;pH8.0)各透析1次,再用不含尿素的复性液透析3次,每次8~12 h取透析后液体,4℃ 15 000 g离心,20 min取上清。
1.2.8重组SEAD227A蛋白的纯化 复性后的rSEAD227A蛋白透析于平衡液(150 mmol/L NaCl,50 mmol/L Tris,1 mmol/L EDTA;pH8.0),并通过AKTA avant 25蛋白纯化仪和StrepⅡ亲和层析进行纯化。结合在StrepⅡ亲和填料上的目的蛋白用洗脱缓冲液(NaCl 150 mmol/L、EDTA 1 mmol/L、Tris-HCl 10 mmol/L、脱硫生物素2.5 mmol/L,pH8.0)进行洗脱。纯化后的rSEAD227A蛋白SDS-PAGE电泳分析目的蛋白的纯化效果。
1.2.9高效液相色谱-二级质谱联用系统(LC-MS/MS)鉴定重组SEAD227A蛋白 纯化后的重组SEAD227A蛋白经胰蛋白酶消化后,肽段用样品溶解液(0.1%甲酸、2%乙腈)溶解,充分振荡涡旋,4℃,10 000 g 离心10 min,上清转移到上样管中,高效液相色谱-二级质谱联用系统(LC-MS/MS)进行质谱鉴定。色谱柱为75 μm×150 mm,C18,3 μm,液相参数为流动相A:0.1%甲酸,流动相B:0.1%甲酸,80%ACN,流速:300 nl/min,分析时间:40 min,有效梯度:B相从5%上升至90%。分离后的肽段直接进入质谱仪Thermo Scientific Q Exactive进行在线检测。一级质谱分辨率70 000,扫描范围350~1 800 m/z,二级质谱分辨率17 500。质谱原始文件经过MM File Conversion软件处理转换,得到MGF格式文件,然后用MASCOT检索uniprot数据库。分析肽段与数据库SEA蛋白的匹配情况。
2 结果
2.1SEAD227A基因的克隆 以金葡菌提取的基因组DNA为模板,PCR扩增得到SEA基因片段,扩增产物用1.0%琼脂糖凝胶电泳,可见在702 bp处有明显的扩增条带,大小与理论值702 bp相符(图1B)。以SEA模板,通过引物设计引入突变位点、NdeⅠ和XhoⅠ酶切位点和StrepⅡ纯化标签对应的碱基,PCR扩增得到含有D227A突变的SEA基因片段,大小与理论值751 bp相符(图1C)。
2.2pET44a-SEAD227A质粒的构建 限制性核酸内切酶NdeⅠ和XhoⅠ对PCR产物(SEAD227A)及质粒pET44a进行双酶切后,在T4 DNA连接酶连接后的连接产物转化大肠杆菌JM109。通过NdeⅠ和XhoⅠ双酶切法和PCR法对重组质粒进行鉴定(图2B、C),测序结果显示,第679~681位碱基由GAT(对应氨基酸序列为天冬氨酸)突变为GCG(丙氨酸),其余序列与SEA序列一致,pET44a-SEAD227A重组质粒构建成功。
2.3重组SEAD227A在大肠杆菌Rosetta的诱导表达 重组质粒pET44a-SEAD227A转化大肠杆菌表达菌株Rosetta。37℃,1 mmol/L IPTG诱导6 h后,SDS-PAGE电泳显示rSEAD227A大小与理论值31 kD相符,用 Quantity one 软件对 SDS-PAGE 电泳结果图进行灰度估算,rSEAD227A表达量占菌体蛋白的50%以上,提示rSEAD227A在大肠杆菌中高效表达(图3,泳道2和4)。
2.4重组SEAD227A包涵体的清洗与复性 菌体破碎后,rSEAD227A以包涵体形式存在于沉淀中(图4,泳道1)。用清洗液洗涤两次后包涵体纯度达80%以上(图4,泳道4)。包涵体透析复性后,纯度达90%以上(图5)。
2.5重组SEAD227A蛋白的纯化 用StrepⅡ亲和层析纯化复性后的SEAD227A蛋白,SDS-PAGE电泳分析显示只有单一条带,纯化效果良好,纯度大于95%(图6)。
图1 SEAD227A基因的克隆Fig.1 Cloning of SEAD227A geneNote: A.Schematic presentation of PCR for SEAD227A.SEAD227A mutation was inserted to the C-terminal of SEA and tagged with Strep-tag Ⅱ at the C-terminal.B-C.PCR amplified products of SEA gene(B) and SEAD227A(C) respectively.Each gel image the DNA ladder was indicated on the left side,arrows indicated the PCR products and their expected sizes were labeled below as well.
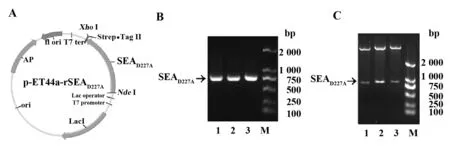
图2 PCR和双酶切法鉴定pET44a-SEAD227A质粒Fig.2 Identification of pET44a-SEAD227A plasmid by PCR and double restriction enzyme digestion assaysNote: A.Map of recombinant expression plasmid pET44a-SEAD227A;B.Identification of the pET44a-SEAD227A by PCR assay.1-3.Agarose gel electrophoresis of PCR products of different clones after using primers for PCR detection;C.Identification of the pET44a-SEAD227A by restrictive enzyme digestion assay with NdeⅠ and XhoⅠ.1-3.Agarose gel electrophoresis of products of different clones after restrictive enzyme digestion.
2.6免疫印迹鉴定纯化后的rSEAD227A免疫印迹结果表明亲和层析纯化后的rSEAD227A可以被StrepⅡ单克隆抗体特异性识别(图7)。
2.7LC-MS/MS鉴定重组SEAD227A蛋白 LC-MS/MS分析证实,胰酶消化后的rSEAD227A肽段与数据库的SEA的序列(NCBI登陆号AAA26681)匹配率为77.4%。图8为其中三条代表性肽段的二级质谱峰图。
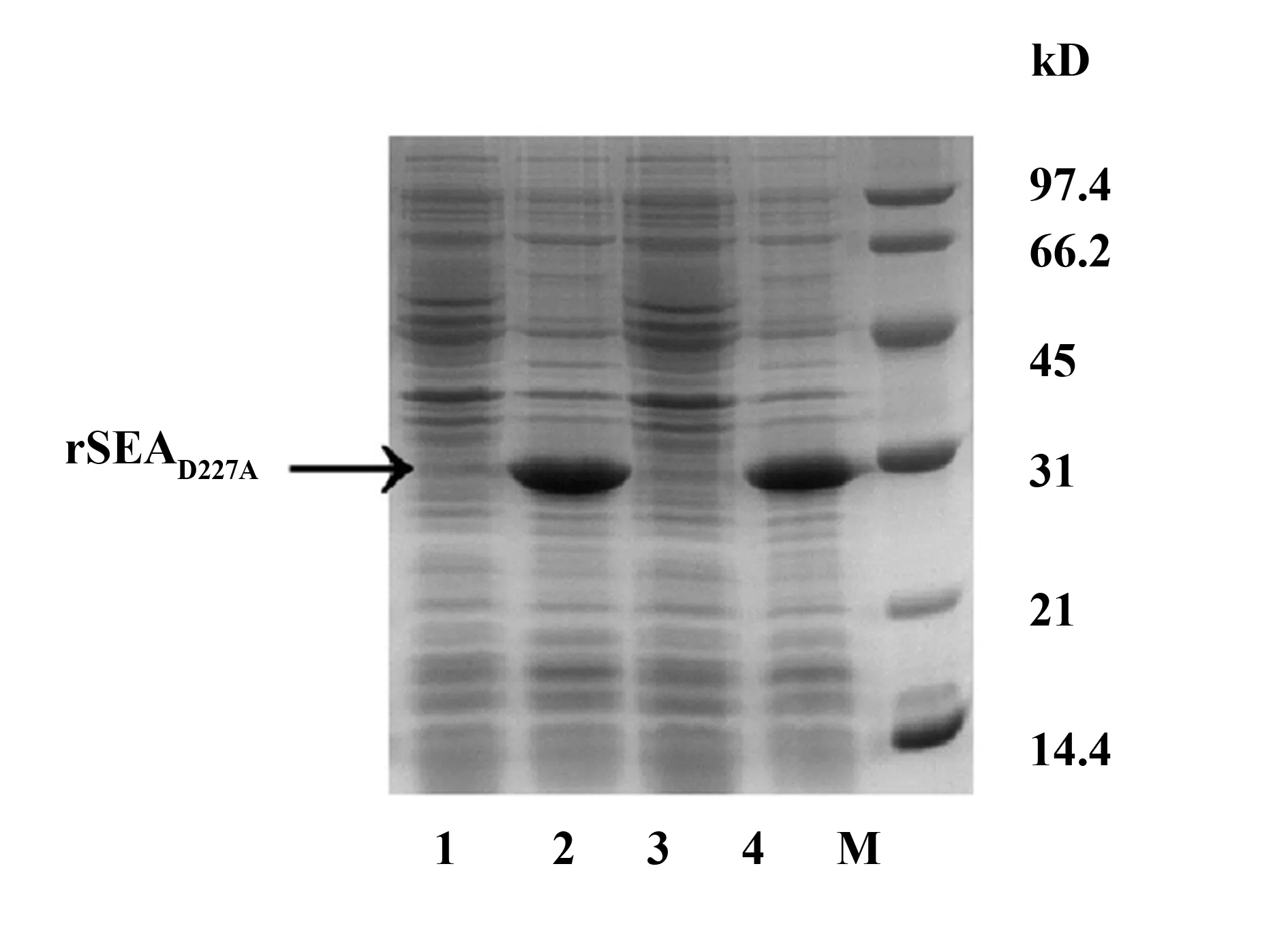
图3 SDS-PAGE分析rSEAD227A的诱导表达Fig.3 Analysis of expression of rSEAD227A by SDS-PAGENote: SDS-PAGE analysis of inducible expression of rSEAD227A.1,2.Lysates of E.coli cells harboring rSEAD227A before(1,3) and after(2,4) IPTG induction.M.Low-molecular-weight standard.
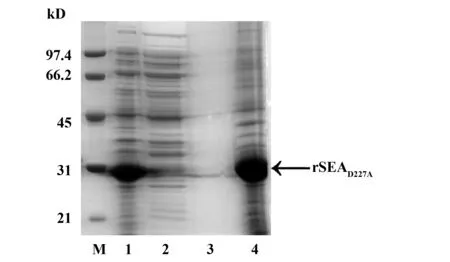
图4 SDS-PAGE 分析rSEAD227A包涵体表达情况及包涵体的清洗Fig.4 SDS-PAGE analysis showed expression of rSEAD227A inclusion bodies before and after two washes with wash bufferNote: M.Low-molecular-weight standard;1.Lysates of E.coli cells harboring rSEAD227A after IPTG induction;2.Pellet after cell lysis(inclusion bodies);3.supernatant after washing of inclusion bodies;4.Inclusion bodies after washing step.
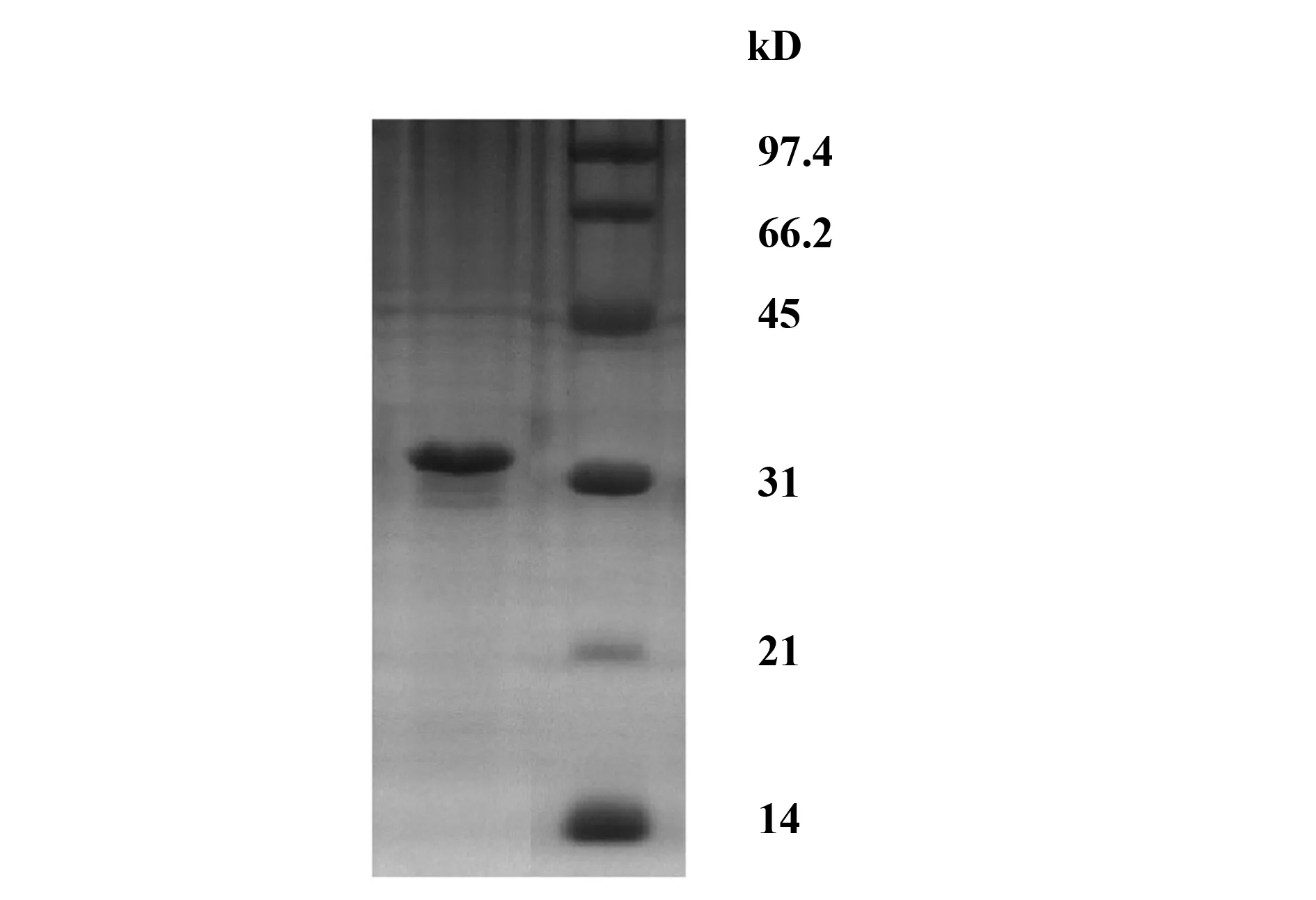
图5 SDS-PAGE分析复性后的rSEAD227A包涵体Fig.5 SDS-PAGE analysis of refolded rSEAD227A inclusion bodies
图6 SDS-PAGE分析纯化后的rSEAD227A蛋白Fig.6 SDS-PAGE analysis of purified rSEAD227A protein by Strep-T actin affinity chromatography
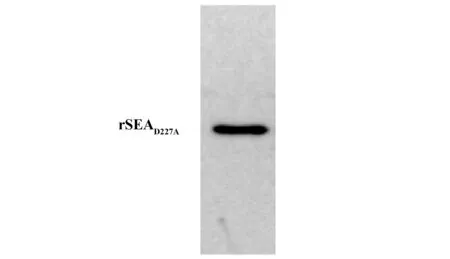
图7 免疫印迹分析纯化后的rSEAD227AFig.7 Immunoblot analysis of purified rSEAD227A
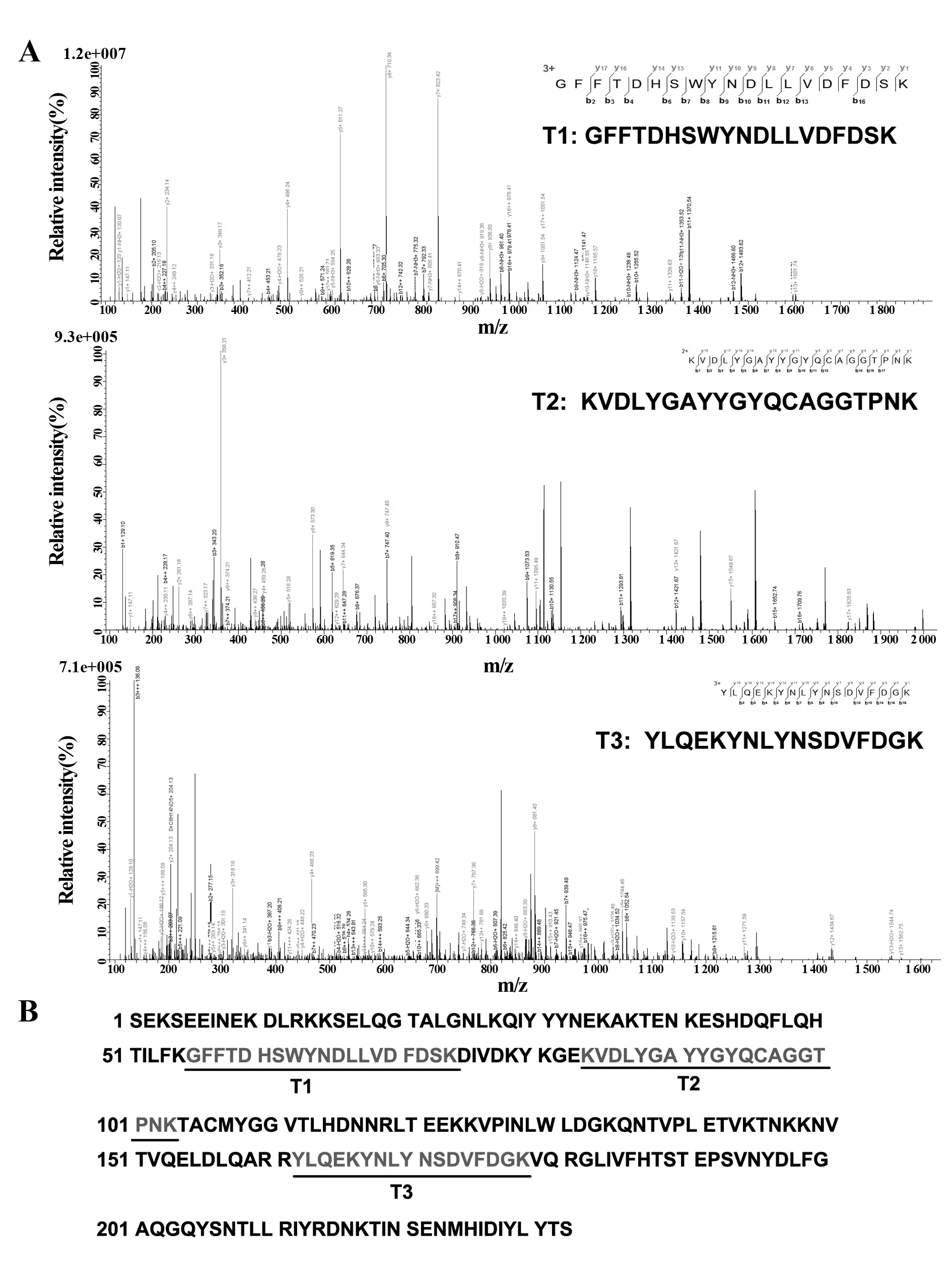
图8 LC-MS/MS质谱鉴定胰酶消化后的rSEAD227A蛋白Fig.8 Identification of tryptic digested rSEAD227A peptide sequences by LC-MS/MS mass spectrometryNote: A.Full-scan ion evaporation mass spectra of representative peptide fragment derived from the tryptic digests of rSEAD227A;B.Amino acid sequence coverage of representative peptide fragment matched with the known SEA sequences.
3 讨论
在多数临床试验中,SEA具有非常大的毒副作用,可引起发热、恶心、呕吐及肝脏和心脏毒性,限制了其临床应用。针对SEA中与MHCⅡ类分子的结合位点进行突变,可大大降低它在表达MHCⅡ类分子组织的滞留和系统毒性。已有研究报道建立了C215 Fab-SEA/D227A(SEA蛋白的第227位氨基酸由天冬氨酸D突变成丙氨酸A),该突变可以降低SEA对MHCⅡ抗原的结合力,使SEA与MHCⅡ抗原的结合力降低1 000倍,从而降低T细胞对机体正常组织中的MHCⅡ+抗原细胞杀伤能力,降低毒副作用,同时该突变仍具有显著的抗肿瘤效应[7,8]。越来越多的研究证实,D227A突变确实可以一定程度地降低SEA与MHCⅡ结合能力,使SEA毒性减弱[10-14];由SEAD227A和其他肿瘤靶向分子,如由人血管内皮生长因子(Vascular endothelial growth factor,VEGF)等组成融合蛋白可极为有效地抑制动物实体肿瘤的生长,因此可能成为各种癌症的潜在治疗药物[10-14]。
已有的动物实验,对使用突变的SEAD227A或者由其组成融合蛋白治疗效果的良好评价[10-14],为进一步利用本研究获得的高纯度rSEAD227A蛋白去进行深入的生物活性、细胞及动物学研究提供了信心。由于SEA的表达在侵袭性金黄色葡萄球菌菌株和食物中毒菌株中较常见[4-6],因此低毒性但仍保留其免疫活性、高纯度的rSEAD227A及其抗体可用于控制葡萄球菌食物中毒和食源性疾病的治疗尝试。
本研究以金葡菌基因组DNA为模板,以SEA编码基因特异区段为引物,采用PCR扩增SEA成熟肽编码基因,再通过PCR方法引入D227A突变,成功克隆SEAD227A基因。SEAD227A克隆到pET-44a载体后,经菌落PCR及酶切鉴定筛选出阳性克隆后再进行DNA测序及比对分析,第679~681位碱基由GAT(对应氨基酸序列为天冬氨酸)突变为GCG(丙氨酸),其余序列与SEA序列一致性达100%。已有研究报道将重组金黄色葡萄球菌肠毒素A突变体D227A在大肠杆菌BL21DE3表达,利用组氨酸标签和镍离子亲和层析系统进行纯化,采用HPLC检测其纯度[15]。鉴于SEAD227A基因结构含有较多稀有密码子,较之同类研究使用的BL21表达菌株[15],我们选择大肠杆菌表达菌株Rosetta为宿主表达菌。Rosetta菌株来源于BL21宿主菌,该菌株含有原本在大肠杆菌中的稀有密码子(AUA、AGG、AGA、CUA、CCC和GGA),更有利于SEAD227A的高效表达[16]。包涵体经盐酸胍变性后,依据影响包涵体蛋白正确复性的各种因素,使用利于蛋白复性的缓冲液系统(添加氧化还原对GSH/GSSG、精氨酸、半胱氨酸、适合的盐浓度和甘油),梯度透析使蛋白复性,经StrepⅡ亲和层析纯化后获得了高纯度的目的蛋白纯度。采用高效液相色谱-二级质谱联用系统(LC-MS/MS)进行蛋白序列鉴定,鉴定结果显示胰酶消化后的rSEAD227A肽段与数据库的SEA的序列(NCBI登陆号AAA26681)匹配率为77.4%,较之同类研究的HPLC鉴定结果更为精准地解析重组蛋白[15]。精氨酸替代第225(H)或者227(D)位氨基酸后,为研发rSEAD227A和其他肿瘤靶向分子组成的肿瘤抑制剂奠定了基础,可能成为我们拥有自主知识产权的靶向抗癌新药。
参考文献:
[1] Ohno S,Takanashi M,Sudo K,etal.Systemically injected exosomes targeted to egfr deliver antitumor microrna to breast cancer cells[J].Mol Ther,2012,21(1):185-191.
[2] Pinchuk IV,Beswick EJ,Reyes VE.Staphylococcal enterotoxins[J].Toxins,2010,2(8):2177-2197.
[3] Krakauer T.Update on staphylococcal superantigen-induced signaling pathways and therapeutic interventions[J].Toxins,2013,5(9):1629-1654.
[4] Landskron G,De la Fuente M,Thuwajit P,etal.Chronic inflammation and cytokines in the tumor microenvironment[J].J Immunol Res,2014,2014:149185.
[5] Krakauer T,Pradhan K,Stiles BG.Staphylococcal superantigens spark host-mediated danger signals[J].Front Immunol,2016,7:23.
[6] Kadariya J,Smith TC,Thapaliya D.Staphylococcus aureus and staphylococcal food-borne disease:An ongoing challenge in public health[J].Bio Med Res Int,2014,2014:827965.
[7] Abrahmsen L,Dohlsten M,Segren S,etal.Characterization of two distinct MHC class Ⅱ binding sites in the superantigen staphylococcal enterotoxin A[J].EMBO J,1995,14(13):2978-2986.
[8] Hansson J,Ohlsson L,Persson R,etal.Genetically engineered superantigens as tolerable antitumor agents[J].Proc Natl Acad Sci U S A,1997,94(6):2489-2494.
[9] Hu DL,Omoe K,Sashinami H,etal.Immunization with a nontoxic mutant of staphylococcal enterotoxin a,SEAD227A,protects against enterotoxin-induced emesis in house musk shrews[J].J Infect Dis,2009,199(3):302-310.
[10] Sun J,Zhao L,Teng L,etal.Solid tumor-targeted infiltrating cytotoxic t lymphocytes retained by a superantigen fusion protein[J].PLoS One,2011,6(2):e16642.
[11] Xu Q,Zhang X,Yue J,etal.Human tgfalpha-derived peptide tgfalphal3 fused with superantigen for immunotherapy of egfr-expressing tumours[J].BMC Biotechnol,2010,10:91.
[12] Boehncke WH,Hardt-Weinelt K,Nilsson H,etal.Antagonistic effects of the staphylococcal enterotoxin a mutant,sea(f47a/d227a),on psoriasis in the scid-hu xenogeneic transplantation model[J].J Invest Dermatol,2001,116(4):596-601.
[13] Takemura S,Kudo T,Asano R,etal.A mutated superantigen sea d227a fusion diabody specific to muc1 and cd3 in targeted cancer immunotherapy for bile duct carcinoma[J].Cancer Immunol Immunother,2002,51(1):33-44.
[14] Sun Q,Jiang S,Han B,etal.Cytotoxic t lymphocyte-dependent tumor growth inhibition by a vascular endothelial growth factor-superantigen conjugate[J].Biochem Biophysical Res Communicat,2012,427(4):711-717.
[15] 张海英.重组金黄色葡萄球菌肠毒素A突变体D227A蛋白的表达、纯化和鉴定[J].海峡药学,2013,25(2):243-245.
Zhang HY.Expression,purification and identification of low-toxic staphylococcal enterotoxin a with D227A mutation[J].Strait Pharmaceutical J,2013,25(2):243-245.
[16] Tegel H,Ottosson J,Hober S.Enhancing the protein production levels in Escherichia coli with a strong promoter[J].FEBS J,2011,278:729-739.