厄斯考维菌产羰基还原酶的发酵条件优化
2018-07-06,,
,,
(1. 浙江工业大学 药学院,浙江 杭州 310014;2. 浙江医药高等专科学校 制药工程学院,浙江 宁波 315100)
手性化合物广泛应用于构建具有生物活性的药物和天然产物[1],有机金属催化[2-3]和生物催化[4-6]是手性合成的常用方法.相比于金属催化,生物催化具有立体选择性高、转化条件温和及生产过程绿色等优势[7-8].因此,生物催化被广泛应用于光学纯化合物的合成[9-10].
近年来,由于手性芳香醇的用途广泛,生物催化羰基化合物不对称还原制备手性芳香醇备受关注,成为生物催化研究热点之一[11-12].化合物(R)-1-(3-氯苯基)乙醇构成的药物,可用于调控运动神经元细胞基因的转录,合成更多的运动神经蛋白,阻止肌肉的坏死[13-14],对脊髓性肌萎缩症状有治疗效果.该手性醇还是多种肾上腺受体激动剂,如药物SR58611和BRL37344的构建模块[15-16].已有报道该手性醇的生物法制备,Zhu等[17]采用来自极端嗜热菌(Pyrococcusfuriosus)的醇脱氢酶催化合成(R)-1-(3-氯苯基)乙醇,对映体过量值(e.e.值)和转化率为分别为99%和75%,还原反应过程中需要加入异丙醇以实现辅助因子NADH的原位再生.Perna等[18]利用来自乳杆菌(Lactobacillusreuteri)的羰基还原酶催化3-氯苯乙酮合成(R)-1-(3-氯苯基)乙醇,转化率100%,e.e.值>99%,但当底物质量浓度>5 g/L,转化率<70%.本研究通过筛选取自全国各地的50 份土样,得到一株高选择性羰基还原酶菌种厄斯考维菌(Oerskoviaturbata)ZJPH1604,利用该菌株不对称还原3-氯苯乙酮制备(R)-1-(3-氯苯基)乙醇,e.e.值>99.9%.为提高产酶能力,对菌种发酵培养基组成进行了优化,通过对影响产酶的多个因素进行考察,并对重要因素采用中心组合实验设计(Central composite design),确定最优产酶条件.
1 材料与方法
1.1 实验材料
骚动厄斯考维菌(Oerskoviaturbata)ZJPH1604,由本课题组从土壤中筛选得到;3-氯苯乙酮购自韶远科技(上海)有限公司,外消旋1-(3-氯苯基)乙醇由实验室合成制得(纯度>95.1%).
富集培养基:3-氯苯乙酮3.0 g/L,(NH4)2SO42.0 g/L,KH2PO42.0 g/L,NaCl 1.0 g/L,MgSO40.5 g/L,pH6.5.
固体培养基:葡萄糖10.0 g/L,酵母提取物6.0 g/L,(NH4)2SO43.0 g/L,KH2PO41.5 g/L,NaCl 0.8 g/L,MgSO40.8 g/L,琼脂粉20.0 g/L,pH 6.5.
初始发酵培养基:葡萄糖10.0 g/L,酵母提取物10.0 g/L,(NH4)2SO42.0 g/L,KH2PO42.0 g/L,NaCl 1.0 g/L,MgSO40.5.0 g/L,pH 6.5.
1.2 检测方法
1.2.1 酶活力测定
在30 ℃,200 r/min反应条件下,每分钟还原3-氯苯乙酮生成1 μmol产物(R)-1-(3-氯苯基)乙醇所需要的酶量定义为一个活力单位U.羰基还原酶的酶活力(Enzyme activity)以1 g干菌体中所含有的酶活力单位表示,U/g. 取发酵液,离心分离菌体(9 000×g,4 ℃, 15 min),以磷酸盐缓冲溶液 (0. 1 mol/ L,pH 6. 5) 洗涤,离心后称取菌体(湿重)1.0 g重悬于10 mL磷酸缓冲液中,加入100 μmol/L 3-氯苯乙酮,温度30 ℃,摇床转速200 r/min,反应1 h,离心得上清液用10 mL乙酸乙酯萃取,用气相色谱检测产物浓度,计算其酶活力.
1.2.2 气相分析方法
GC-2014气相色谱仪(日本SHIMADZU公司),气相柱为Varian公司生产的CP-Chirasil-Dex毛细管手性色谱柱(25 m×0.25 mm×0.25 μm);载气为氮气,柱流速2.0 mL/min;升温程序为柱温120 ℃,保持2 min,以8 ℃/min升至160 ℃;进样口温度250 ℃;检测器为FID,温度250 ℃;进样量1 μL,分流比15︰1,气相色谱图如图1所示,溶剂(乙酸乙酯)保留时间为1.101 min,内标(十二烷)保留时间为3.315 min,S-产物醇保留时间为6.953 min,R-产物醇保留时间为7.215 min.产物的光学纯度由对映体过量值e.e.表征为
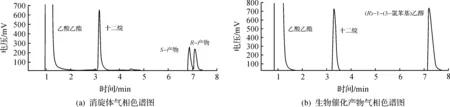
图1 产物气相色谱分析图Fig.1 GC analysis of the product

1.3 实验部分
1.3.1 菌种筛选
取1 g土样加入到10 mL的生理盐水并摇匀,吸取200 μL稀释液加入富集培养基,30 ℃,200 r/min,培养5~7 d.将富集培养基分别稀释10-2,10-4倍,各吸取100 μL涂布在平板培养基上,30 ℃恒温培养2~3 d.对平板培养基长出的菌株进行转化能力考察,确定目标菌株.筛菌流程:富集培养→平板初筛→菌种复筛→种子培养→发酵培养→生物转化→气相色谱检测产物→获得目标菌株.
1.3.2 菌种鉴定
利用Hitachi(日立)-7650透射电子显微镜对ZJPH1604菌进行细胞形态观察,并由上海生工测序16S rDNA,将所得基因序列与GenBank保藏的基因序列对比分析,结合系统发育树,以确定该菌的种属.
1.3.3 菌体发酵培养
从培养成熟的平板培养基中挑取1 环菌体接入装液量为100 mL的种子培养基中(250 mL锥形瓶),温度30 ℃,摇床转速200 r/min,培养12 h,获得种子液. 将培养好的种子液按照体积分数为8%的接种量转接至装有100 mL发酵培养基中(250 mL锥形瓶),温度30 ℃,摇床转速200 r/min,培养34 h.
1.3.4 中心组合实验设计
对初始培养基成分中的碳源、氮源及金属离子进行优化,通过单因素实验法,选取酵母提取物、(NH4)2SO4和KH2PO4等3 个重要因素,利用Design Expert 8.0.6软件进行Box-Behnken中心组合实验设计(3 因素3 水平),以酶活(U/g)为响应值,共需17 组实验,每组设3 个平行样.实验设计软件Design Expert 8.0.6对实验数据自动进行回归分析,用F(Fischer)检验评价数学模型方程的显著性,方程的拟合性由确定系数R2确定.
2 结果与讨论
2.1 菌种筛选与鉴定
从50 份土样中筛选得到具有羰基还原酶活性可催化3-氯苯乙酮的菌株,通过复筛,获得能高选择性催化合成(R)-1-(3-氯苯基)乙醇的菌株ZJPH1604(产物e.e.值>99.9%).经保守序列对比,该菌与骚动厄斯考维菌(Oerskoviaturbata,GenBank保藏号:X79454.1)的相似度为99.0%.菌落形态:菌落呈白色、不规则状,有光泽,表面湿润、光滑,略微隆起.细胞形态:细体呈粗细不均的棒杆状[(0.5~0.8)μm×(1.0~3.5)μm],可单个、成对排列或聚集成丛,经革兰氏染色检验,结果呈阴性.结合菌体形态和基因保守序列对比分析,鉴定该菌为骚动厄斯考维菌(Oerskoviaturbata)ZJPH1604,该菌株保藏于中国典型培养物保藏中心,保藏号:CCTCC M 2016541.
2.2 单因素实验考察
培养基成分(如碳源、氮源及金属离子)对菌体酶活和生物量影响较大,优化实验以酶活为主要考察指标,通过优化培养基各成分质量浓度以提高酶活.实验表明:以葡萄糖为碳源,在初始质量浓度为10 g/L时,酶活为12.0 U/g,而在15.0 g/L时酶活最高达到13.5 U/g(图2a);氮源选取酵母提取物,当质量浓度为25.0 g/L时酶活达到15.6 U/g(图2b);4.0 g/L为KH2PO4的最佳质量浓度,酶活为20.6 U/g(图2c);(NH4)2SO4质量浓度为2.5 g/L时,酶活为27.1 U/g(图2d);NaCl质量浓度为0.6 g/L时,酶活为27.8 U/g(图2e);MgSO4质量浓度为0.8 g/L时,酶活达28.7 U/g(图2f).经单因素优化,酶活由初酶活12.0 U/g提高到28.7 U/g,提高了1.4倍.
2.3 显著因素的筛选
在单因素实验基础上,按照Design Expert 8.0.6软件的设计,对培养基中6 种成分(葡萄糖,酵母提取物,NaCl,(NH4)2SO4,KH2PO4,MgSO4)的质量浓度进行N=12的6 因素Plackett-Burman考察,结果如表1所示.当P值<0.05时,说明该因素对结果影响显著,所得酵母提取物、(NH4)2SO4和KH2PO4的P值分别为0.008 4,0.013 8,0.005 8,均小于0.05,表明酵母提取物、(NH4)2SO4和KH2PO4对酶活影响显著.

表1 Plackett-Burman实验因素、水平和结果分析Table 1 Levels of variables and statistical analysis of Plackett-Burman


图2 各单因素质量浓度对酶活及菌体生物量的影响Fig.2 Effect of single factors’ concentration on the enzyme activity and biomass
2.4 中心组合实验设计
采用Box-Behnken响应面试验设计,确定显著影响因子的最优水平.由SAS 8.0软件拟合得到多元回归模型为
酶活=21.20+0.46X1+0.72X2-0.63X3-
0.66X1X2-2.03X1X3-0.73X2X3-
4.12X12-5.37X22-4.56X32
利用Design Expert 8.0.6软件对数据进行二次多项式方差分析,结果如表2所示.该模型P=0.013 3<0.05,失拟值为0.112 9,表明该模型分析结果可信,各因素对酶活影响显著.决定系数R2=0.94,说明该模型预测值与实际值相关联度高,可以用于预测实验结果.由响应面回归分析和回归方程拟合绘制响应面,如图3~5所示.
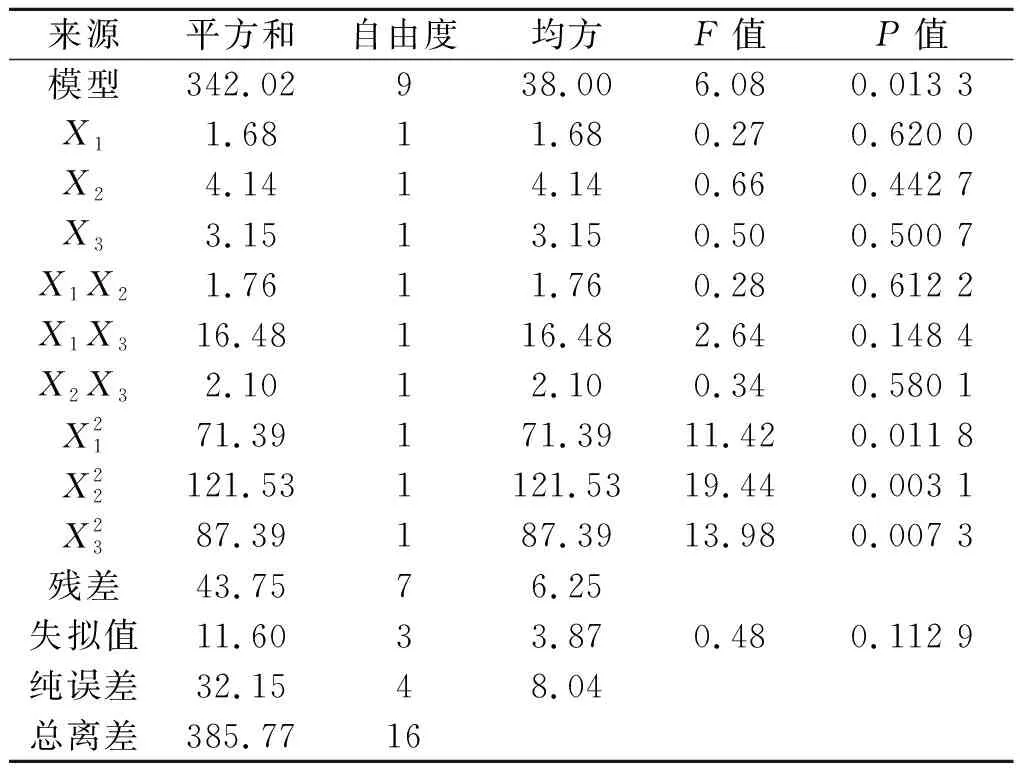
表2 回归模型系数显著性检验Table 2 Significance test of the regression coefficients
如响应面图3~5所示,两两因素((NH4)2SO4/酵母提取物,KH2PO4/酵母提取物,KH2PO4/(NH4)2SO4)构成的响应面图形呈现上凸的山丘状,表明酶活存在极大值点;经对酶活数据进行分析,预计最大酶活为32.0 U/g,3 因素最优质量浓度分别为酵母提取物30.0 g/L,(NH4)2SO42.6 g/L,KH2PO42.8 g/L.

图3 (NH4)2SO4和酵母提取物质量浓度对酶活的影响Fig.3 Effect of(NH4)2SO4 and yeast extract concentration on enzyme activity

图4 KH2PO4和酵母提取物质量浓度对酶活的影响Fig.4 Effect of KH2PO4 and yeast extractconcentration on enzyme activity
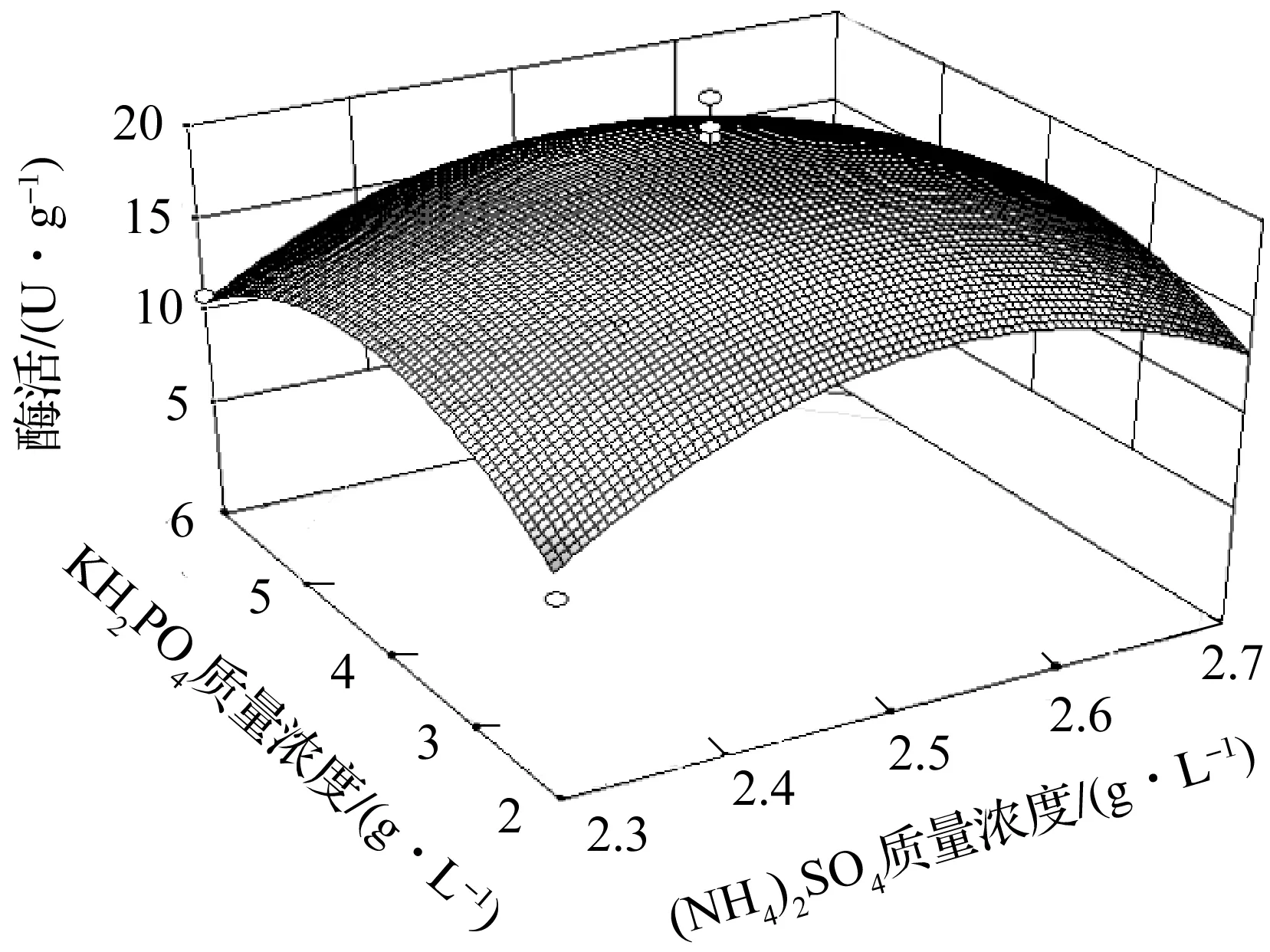
图5 KH2PO4 和(NH4)2SO4质量浓度对酶活的影响Fig.5 Effect of KH2PO4 and(NH4)2SO4 extract concentration on enzyme activity
模型预测值准确性的验证实验表明:在优化条件下进行5 组250 mL摇瓶发酵实验,得酶活分别为31.5,32.1,32.3,31.3,31.9 U/g,其平均酶活为31.8 U/g,与预测值(32.0 U/g)非常接近,相对误差为0.6%,证明该模型能较准确地预测发酵水平.
3 结 论
从土样中筛选得到一株产羰基还原酶的菌株,经鉴定为骚动厄斯考维菌(Oerskoviaturbata)ZJPH1604,该菌能高选择性催化底物3-氯苯乙酮得光学纯R型产物.利用单因素实验,确定最佳培养基组成为葡萄糖15.0 g/L,酵母提取物25.0 g/L,NaCl 0.6 g/L,KH2PO44.0 g/L,MgSO40.8 g/L.进一步利用中心组合实验得到最优培养基组成:葡萄糖15 g/L,酵母提取物30.0 g/L,(NH4)2SO42.6 g/L,KH2PO42.8 g/L,NaCl 0.6 g/L,MgSO40.8 g/L.在优化条件下,酶活由初始酶活12.0 U/g提高到32.0 U/g,较优化前提高了166.7%.菌株ZJPH1604所产羰基还原酶具很好的催化选择性,产物e.e.值>99.9%,具有用于工业化生产的潜力.
参考文献:
[1] VALADEZ-BLANCO R,LIVINGSTON A G. Enantioselective whole-cell biotransformation of acetophenone to S-phenylethanol byRhodotorulaglutinisPart I. Product formation kinetics and feeding strategies in aqueous media[J]. Biochemical engineering journal,2009,46: 44-53.
[2] 宋庆宝,夏婷,安晓霞.手性三齿Schiff-base配体的合成及其催化的不对称Henry反应研究[J].浙江工业大学学报,2014,42(1):73-76.
[3] 苗晓,王来来.过渡金属/磷配体催化不对称氢化反应研究进展[J].分子催化,2014,28(3):282-293.
[4] RAUTER M,KASPRAK J,DENTER S,et al. MARION R,JAKUB K. Reusability of ADH and GDH producingArxulaadeninivoranscells andcell extract for the production of 1-(S)-phenylethanol[J]. Journal of molecular catalysis B: enzymatic,2014,108: 72-76.
[5] 欧阳启,黄金,王普,等.离子液体对热带假丝酵母细胞生物相容性的研究[J].浙江工业大学学报,2013,41(3):254-259.
[6] 石海芳,黄金,王普,等.利用纤维床生物反应器制备左乙拉西坦关键手性中间体[J].浙江工业大学学报,2013,41(4):422-443.
[7] LI B J,LI Y X. Whole-cell biotransformation systems for reduction of prochiral carbonyl compounds to chiral alcohol inEscherichiacoli[J]. Scientific reports,2014(4): 235-238.
[8] SCHMID A,DORDICK J S. Industrial biocatalysis today and tomorrow[J].Nature,2001,409: 258-268.
[9] XU G P,WANG H B,WU Z L. Efficient bioreductive production of(S)-N-Boc-3-hydroxy- piperidine using ketoreductase Ch KRED03[J]. Process biochemistry,2016,51: 881-885.
[10] CONTENTE M L,SERRA I,BRAMBILLA M,et al. Stereoselective reduction of aromatic ketones by a new ketoreductase fromPichiaglucozyma[J]. Applied microbiology and biotechnology,2016,100: 193-201.
[11] XU Q,XU X,HUANG H,et al. Efficient synthesis of (R)-2-chloro-1-phenylethol using a yeast carbonyl reductase with broad substrate spectrum and 2-propanol as cosubstrate[J]. Biochemical engineering journal,2015,103: 277-285.
[12] MAKINO Y,ITOH N. Development of an improved phenylacetaldehyde reductase mutant by an efficient selection proce-
dure[J]. Applied microbiology and biotechnology,2014,98: 4437-4443.
[13] HOFF B H,SUNDBY E. Preparation of pharmaceutical important fluorinated 1-arylethanols using isolated enzymes[J]. Bioorganic chemistry,2013,51: 31-47.
[14] THURMOND J,BUTCHBACH M E,PALOMO M,et al. Synthesis and biological evaluation of novel 2,4-diaminoquinazoline derivatives as SMN2 promoter activators for the potential treatment of spinal muscular atrophy[J]. Journal of medicinal chemistry,2008,51: 449-469.
[15] CONSOLI D,LEGGIO G M,MAZZOLA C. et al. Behavioral effects of theβ3adrenoceptor agonist SR58611A: is it the putative prototype of a new class of antidepressant/anxiolytic drugs[J]. European journal of pharmacology,2007,573: 139-147.
[16] YU T,LI J F,ZHU L J,et al. Reduction of m-chlorophenacyl chloride coupled with regeneration of NADPH by recombinantEscherichiacolicells co-expressing both carbonyl reductase and glucose 1-dehydrogenase[J]. Annals of microbiology,2016,66: 343-350.
[17] ZHU D M,HYATT B A,HUA L. Enzymatic hydrogen transfer reduction of α-chloro aromatic ketones catalyzed by a hyperthermophilic alcohol dehydrogenase [J]. Journal of molecular catalysis B: enzymatic,2009,56: 272-276.
[18] PERNA F M,RICI M A,SCILIMATI A,et al. Cheap and environmentally sustainable stereoselective arylketones reduction byLactobacillusreuteriwhole cells[J]. Journal of molecular catalysis B: enzymatic,2015,124: 29-37.
