姜黄素-PLGA纳米粒对RG2大鼠神经胶质瘤模型的影响
2018-07-05周春辉郭宝瑞胡晨浩张剑宁
周春辉,郭宝瑞,胡晨浩,张剑宁*
0 引言
姜黄素是姜黄的活性成分,对多种癌症[包括胶质母细胞瘤(GBM)]有显著的抗肿瘤作用,但姜黄素吸收差,生物利用度低。另外,胶质母细胞瘤化疗失败的主要原因之一是血脑屏障,为了克服这一障碍,需要高剂量使用抗肿瘤药物,导致毒副作用增强。因此,对胶质母细胞瘤更有效、更安全的治疗需要穿越血脑屏障,靶向肿瘤,这可以通过药物递送系统来实现[1-2]。
纳米结构脂质载体是一种作为姜黄素递送系统的前景性药物[3]。体外研究证明,载姜黄素的纳米粒和纳米纤维对C6和9L神经胶质瘤细胞具有剂量依赖性的细胞毒副反应[4]。在结肠癌、宫颈癌和前列腺癌中,已显示出载姜黄素PLGA的功效[5]。在此基础上,本文旨在评估肿瘤内或静脉内施用载姜黄素PLGA-DSPE-PEG纳米粒对大鼠神经胶质瘤(RG2)肿瘤模型的抗肿瘤功效。
1 材料与方法
1.1 材料与仪器 姜黄素、乙腈(均为阿拉丁试剂),DSPE-PEG、卵磷脂(购自Lipid公司);医用PLGA(长春圣博玛生物材料有限公司)。
高效液相色谱仪(Agilent 1100,美国Agilent公司),包括紫外(UV)检测器(425 nm)和色谱柱(ODS2 C18200 mm×4.6 mm);超声波水浴仪(Branson B 220 Smith Kline,美国);Malvern Zetasizer Nano系列ZS装置。
48只成年雌性Wistar大鼠,体重250~300 g,由上海斯莱克实验动物中心提供,实验动物合格证编号:SCXK(沪)2012-0002。
1.2 姜黄素含量测定 根据Wichitnithad等[6]报道的方法,通过高效液相色谱(HPLC)分析姜黄素的含量。使用配有紫外(UV)检测器(425 nm)和色谱柱(ODS2 C18200 mm×4.6 mm)的Agilent HPLC系统(Agilent 1100,美国)。流动相包括乙腈和2% v/v乙酸(40∶60,v/v),流速为2.0 mL/min。色谱法通过线性、灵敏度、精密度、准确度和特异性验证。
1.3 Cur-NP的制备 在混合纳米粒的制备中,使用PLGA和1,2-二硬脂酰基-甘氨酰-3-磷酸乙醇胺-N-[氨基(PEG)-2000](DSPE-PEG)作为共聚物(铵盐)。通过超声乳化法制备PLGA-DSPE-PEG杂化纳米粒子[7]。将PLGA(共聚物比为85∶15)溶于乙腈(2.5 μg/ml)中,获得有机相。在有机相制备过程中,加入姜黄素[姜黄素/PLGA(w/w)=20%]。将卵磷脂和DSPE-PEG分别溶解在4% (v/v)乙醇中,然后与去离子水混合获得水相。将水相加入到有机相(比例为10∶1)中,并使用超声波水浴仪(Branson B 220 Smith Kline,美国)在频率42 kHz和功率100 W下,在玻璃小瓶中超声处理5 min。将纳米粒在10 kDa分子尺寸可渗透膜(微孔,10 kDa)的过滤离心管中离心,并使用磷酸盐缓冲液(PBS,pH=7.4)洗涤3次。将获得的纳米粒分散体在-80 ℃下冷冻干燥24 h。
1.4 纳米粒的表征 通过Malvern Zetasizer Nano系列ZS装置测量纳米粒的粒径。通过HPLC法测定药物包载量。通过破坏有机溶剂的纳米粒结构,将乙腈加入纳米粒中以提取药物。将溶液通过0.2 μm膜过滤器过滤并注入HPLC柱。采用透析法测定姜黄素的体外释放行为[8]。将纳米粒分散于PBS中并置于2 000 Da孔径的透析袋内,将该透析袋置于37 ℃的磁力搅拌器(100 r/min)搅拌的水浴中。以预定的时间间隔,采用HPLC法对整个释放基质进行提取与分析。
1.5 体外实验 将含5×103细胞的RG2细胞悬浮液100 μl加入96孔平底板中。将细胞在培养箱中保持过夜以使其附着于孔。第2天用姜黄素溶液(12.5、25、50、100、200 μmol/L)处理细胞并孵育72 h。用WST-1 [5-(2,4-二磺基苯基)-2-(4-碘苯基)-3-(4-硝基苯基)-2H-四唑内盐]测试进行细胞活力检测。
1.6 动物研究 研究列入48只成年雌性Wistar大鼠(250~300 g)。将动物饲养于标准动物房中,并在给药前给予0.05 mg环孢菌素5 d。
脑肿瘤的诱导方法:使用Yemisci等[9]和Geletneky等[10]的改良方法。经腹膜内施用氯胺酮(80 mg/kg)和木霉素(10 mg/kg)混合物麻醉后,将50×104个RG2细胞/5 μl细胞注射到大鼠脑中。为获得所需数量的RG2细胞,将RG2细胞悬浮液加入到DMEM培养液中,于2 000 r/min离心5 min,细胞在显微镜下计数。
RG2细胞的注入方法:将大鼠置于立体定位仪(图1A、图1B)中。将头皮剃光,将含有50×104RG2细胞的5 μl细胞悬液用Hamilton玻璃注射器单侧注射到右前纹状体,坐标为前后-0.5 mm,侧面+3.0 mm,腹侧-6 mm。手术中,通过直肠探针连续监测体温,并用恒温盘保持在(37.0±1) ℃。RG2细胞植入后,对大鼠进行日常活动和全身健康随访,处死对环境无兴趣、对外部刺激无反应、不进行自体喂养且红眼的大鼠。
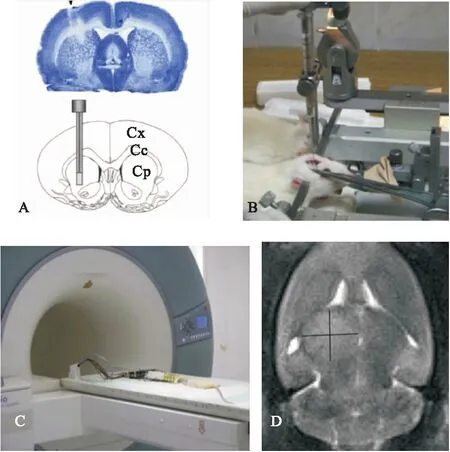
图1将RG2细胞注入右侧纹状体前后-0.5mm,侧面+3.0mm,腹侧-6mm
注:A.RG2细胞注射后大鼠脑的冠状切片;B.立体定位仪定位;C.3 Tesla MR单元的大鼠成像,开发直径3.5 cm 圆形环元件的手工制造的8通道仅接收相位阵列表面线圈;D.脑肿瘤的出现和头尾向的冠状面MR图像体积的测量(高度)和从左到右长度的测量(横向)
模型验证:在肿瘤细胞植入后10 d,通过磁共振成像(MR)评估脑肿瘤的存在和大小。MR成像测量肿瘤大小后,脑肿瘤体积15~30 mm2的大鼠纳入研究组。在MR成像同一天,将药物溶液或制剂注射到静脉注射组大鼠的尾静脉中,和与肿瘤内治疗组细胞着床的同一坐标的脑内。肿瘤内和静脉内注入的药液体积或纳米粒分散体积[在含有Tween-20(0.1%,w/v)的PBS中制备]均为大鼠肿瘤耐受量(20 μl)。注射前该制剂在UV光下灭菌30 min[11]。
实验分组:将大鼠随机分为7组,每组6只:①未经处理(对照组);②经瘤内空白纳米粒处理(不含姜黄素);③静脉注射空白纳米粒(不含姜黄素);④瘤内姜黄素处理(25 μmol/L);⑤用姜黄素静脉注射(25 μmol/L姜黄素溶液,不含纳米粒)处理;⑥用包含25 μmol/L姜黄素的Cur-NP负载瘤内处理;⑦用姜黄素瘤内注射(25 μmol/L姜黄素溶液)用包含25 μmol/L姜黄素的静脉内Cur-NP处理(表1)。
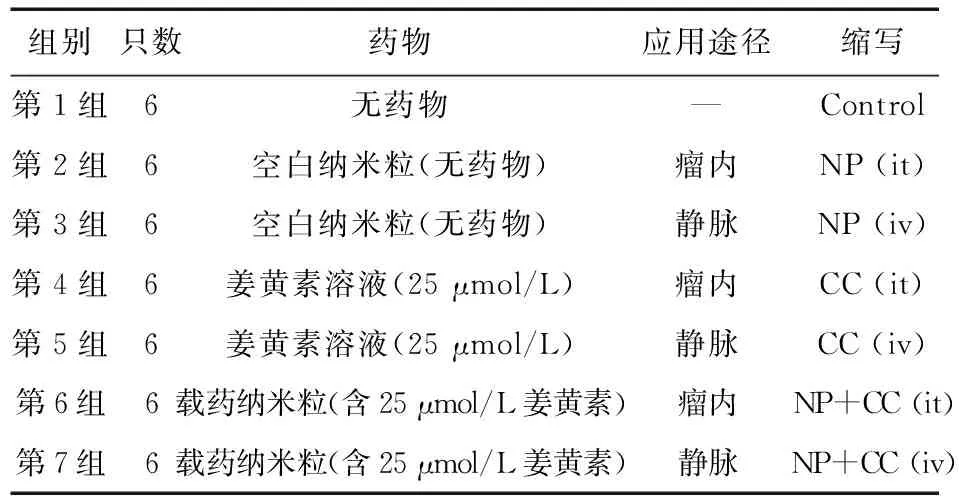
表1 研究分组
注:NP:纳米粒,CC:姜黄素;it:肿瘤内,iv:静脉注射
2 结果
Cur-NP的粒径为(169±4.8)nm,多分散性指数(PI)为0.22,该药物包封率为35%±1.2%。体外药物释放研究表明姜黄素的释放在168 h结束(图2)。
2.1 脑肿瘤的影像学和病理学 在48只实验小鼠中,经RG2细胞注射10 d后,42只大鼠出现了脑肿瘤,并对其进行了静脉内或肿瘤内注射。MR成像显示肿瘤粗糙,T2高信号,伴有压迫和疝出现,根据其大小而定。对大脑的宏观检测中,我们在RG2细胞注射部位观察到灰色占位性病变。显微镜下,肿瘤细胞呈多形性核团,胶质母细胞瘤的出血、坏死和微血管增生特征明显。肿瘤完全由肿瘤细胞组成,无炎症反应(图3)。对照组(组1)4只小鼠在第2次MR成像前死亡,可能原因是增加的颅内压和脑疝。
2.2 治疗对肿瘤大小和病理的影响 根据两者治疗后的MR成像和病理测量肿瘤大小,
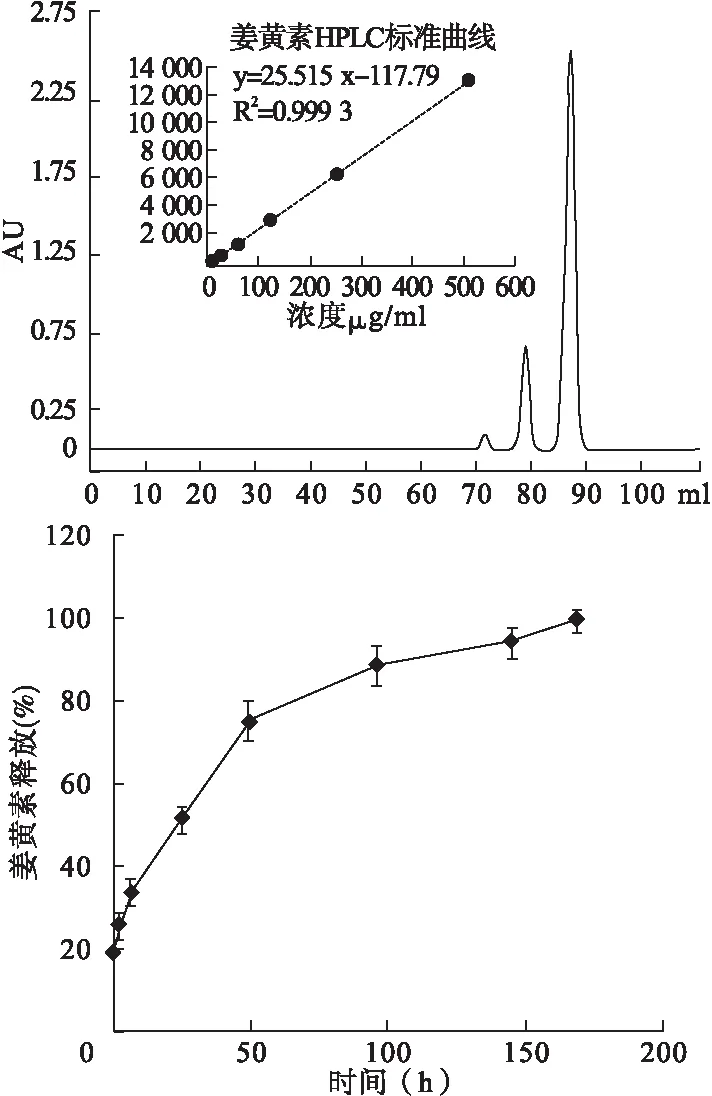
图2姜黄素HPLC色谱图、标准曲线及姜黄素-PLGA-DSPE-PEG杂化纳米粒的体外药物释放曲线(n=3)
图3瘤内注射载Cur-NP前后苏木精-伊红染色的大鼠脑肿瘤组织病理学图像
注:药物注射前(A、B、C)可见微血管增生(A,40×),假栅栏状坏死和多形性(B,100×)和致密肿瘤细胞(C,400×);瘤内注射载Cur-NP后(D、E、F),可见血管增生减少(D,40×)和假栅栏状坏死和多形性减少(E,100×)。在400×放大倍数下观察到巨核细胞和含铁血黄素巨噬细胞(F)治疗前仅由MR成像确定。5 d后瘤内注射Cur-NP组肿瘤体积减小(P=0.028),而在未治疗对照组肿瘤体积增大(P=0.036),而其他组治疗前后差异无统计学意义(P>0.05)。结果表明,只有瘤内注射Cur-NP才能使肿瘤体积减小。见表2。

表2 研究组治疗前后的肿瘤体积(mm3)
注:*Wilcoxon符号秩检验
肿瘤大小百分比变化比较见表3。结果显示,静脉内Cur-NP组(第3组)或静脉内Cur-NP组(第7组)的肿瘤体积变化率与对照组比较差异无统计学意义(P=0.095或P=0.381),其肿瘤体积增加并无显著差异。结合表2和表3的结果,可见注射姜黄素组(第4组)或瘤内Cur-NP组(第6组)比其他组有更好的抗肿瘤作用,表明只有肿瘤内应用姜黄素具有抗肿瘤的作用。此外,负载姜黄素的纳米粒子瘤内注射,与单用姜黄素比较,能更著地减小脑肿瘤体积。
3 讨论
姜黄素是一种对神经胶质细胞具有抗肿瘤活性的植物化学成分,其作用包含各种机制,如诱导细胞凋亡或自噬,上调双特异性磷酸酶-2,抑制细胞外信号调节激酶和c-Jun N端激酶,下调细胞增殖及端粒酶有关的基因活性。已有姜黄素对神经胶质细胞的抗肿瘤活性的报道[12-13]。姜黄素与化疗药物联合应用是预防和治疗肿瘤研究的热点之一,在临床化疗中具有抗癌、逆转耐药及减毒的多重作用[14],有助于提高化疗疗效,已有多项临床试验表明,姜黄素对多种癌症有显著的抗肿瘤作用[15-18]。但姜黄素稳定性和溶解性低,其临床试验疗效报道也曾出现无效结论。因此,通过纳米递送系统解决姜黄素的稳定性、溶解性低的问题,对于姜黄素的应用具有重要意义,尤其是在治疗脑肿瘤方面,纳米粒子疗法比传统疗法更有优势,可通过血脑屏障和增加药物在靶组织的浓度[19]。
为了利用药物输送系统,提高姜黄素的稳定性和生物利用度,降低药物的毒性,我们使用了PLGA和DSPE-PEG制备杂化纳米粒子来包载姜黄素。本研究用RG2细胞来诱导小鼠中的胶质母细胞瘤,与常用的其他模型相比,RG2模型具有非免疫原性的优点[20]。对在小鼠脑肿瘤模型中肿瘤微观结构和抗肿瘤药物的反应研究,通常用组织病理学进行评估。本研究中,除组织病理学评估外,还应用磁共振成像来测量肿瘤面积。鉴于MR成像和病理肿瘤测量的一致性,在小鼠不被处死的前提下,MR成像可以用来监测治疗大鼠脑内的肿瘤。
本研究中,对照组的肿瘤大小在5 d后显著增加。在应用于静脉内的空的或负载姜黄素的纳米粒子组中,肿瘤仍然在增长,表明静脉给药组通过血脑屏障的药物不足。然而,虽然静脉注射姜黄素不能引起肿瘤大小的减少,但存在限制肿瘤生长的趋势。同样,空纳米粒瘤内注射阻止肿瘤生长。由瘤内注射造成的损伤和局部炎症可能是瘤内给药抑制肿瘤生长纳米粒子引起的[21]。CurNP瘤内注射在胶质母细胞瘤上具有显著的抗肿瘤活性。纳米粒装载有抗肿瘤药物的瘤内注射,作为脑肿瘤组织给药方法,值得深入研究。
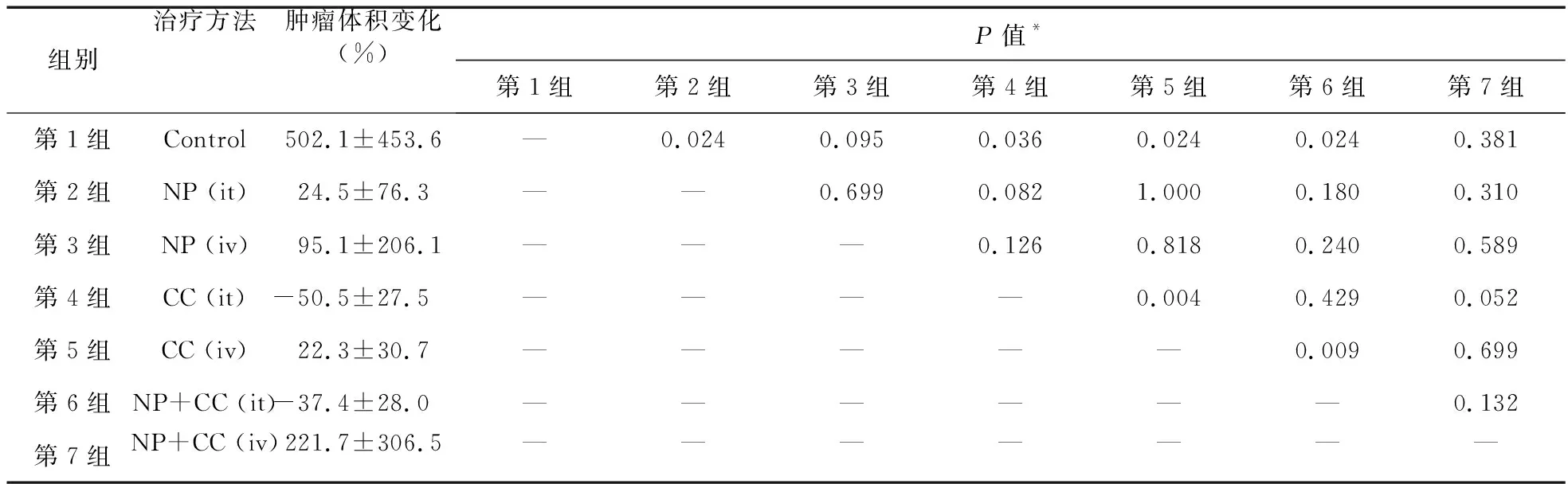
表3 研究组肿瘤体积变化百分比和组间统计学比较
注:*Mann Whitney U检验
本研究的主要局限是实验动物研究样本量较小。另一个问题是缺乏T1加权后的MR成像。然而,因为肿瘤并不总是以钆为基础的造影剂显示增强[22],T2加权影像学及病理切片显示肿瘤区域非常相似,因此,缺乏T1加权成像在本研究中不是一个主要限制。总之,包载姜黄素的PLGA-DSPE-PEG杂化纳米粒子瘤内应用显著减少肿瘤的大小,进一步研究还需要对PLGA-DSPE-PEG纳米粒子的工艺进行优化以适合放大生产,以及体内外对PLGA-DSPE-PEG纳米粒子进行系统性毒性和机制评价。
参考文献:
[1] 张立康,汪小珍,李婉姝,等.姜黄素在大鼠体内药代动力学和生物利用度研究[J].中国药理学通报,2011,27(10):1458-1462.
[2] 李晴宇,叶晓莉,陈玲,等.姜黄素PLGA纳米粒的制备及制剂学性质分析[J].实用药物与临床,2016,19(6):753-757.
[3] Madane RG,Mahajan HS.Curcumin-loaded nanostructured lipid carriers (NLCs) for nasal administration:design,characterization,andinvivostudy[J].Drug Deliv,2016,23(4):1326-1334.
[4] Guo G,Fu S,Zhou L,et al.Preparation of curcumin loaded poly(ε-caprolactone)-poly(ethylene glycol)-poly(ε-caprolactone) nanofibers and their in vitro antitumor activity against Glioma 9L cells[J].Nanoscale,2011,3(9):3825-3832.
[5] Yallapu MM,Khan S,Maher DM,et al.Anti-cancer activity of curcumin loaded nanoparticles in prostate cancer[J].Biomaterials,2014,35(30):8635-8648.
[6] Wichitnithad W,Jongaroonngamsang N,Pummangura S,et al.A simple isocratic HPLC method for the simultaneous determination of curcuminoids in commercial turmeric extracts[J].Phytochem Anal,2009,20(4):314-319.
[7] Fang RH,Aryal S,Hu CM,et al.Quick synthesis of lipid-polymer hybrid nanoparticles with low polydispersity using a single-step sonication method[J].Langmuir,2010,26(22):16958-16962.
[8] Wang S,Su R,Nie S,et al.Application of nanotechnology in improving bioavailability and bioactivity of diet-derived phytochemicals[J].J Nutr Biochem,2014,25(4):363-376.
[9] Yemisci M,Bozdag S,Cetin M,et al.Treatment of malignant gliomas with mitoxantrone-loaded poly (lactide-co-glycolide) microspheres[J].Neurosurgery,2006,59(6):1296-1302.
[10]Geletneky K,Kiprianova I,Ayache A,et al.Regression of advanced rat and human gliomas by local or systemic treatment with oncolytic parvovirus H-1 in rat models[J].Neuro Oncol,2010,12(8):804-814.
[11]Chenevert TL,McKeever PE,Ross BD.Monitoring early response of experimental brain tumors to therapy using diffusion magnetic resonance imaging[J].Clin Cancer Res,1997,3(9):1457-1466.
[12]Ramachandran C,Lollett IV,Escalon E,et al.Anticancer potential and mechanism of action of mango ginger (Curcuma amada Roxb.) supercritical CO extract in human glioblastoma cells[J].J Evid Based Complementary Altern Med,2015,20(2):109-119.
[13]赵心宇,孟秀香,贾莉,等.姜黄素抗肿瘤机制[J].实用药物与临床,2006,9(1):51-52.
[14]王亚华,应雪,张春春,等.替莫唑胺联合姜黄素对C6胶质瘤细胞凋亡的作用[J].实用医学杂志,2016,32(10):1564-1567.
[15]Kunnumakkara AB,Bordoloi D,Harsha C,et al.Curcumin mediates anticancer effects by modulating multiple cell signaling pathways[J].Clin Sci (Lond),2017,131(15):1781-1799.
[16]Gupta SC,Patchva S,Aggarwal BB.Therapeutic roles of curcumin:lessons learned from clinical trials[J].AAPS J,2013,15(1):195-218.
[17]张朋飞,孙剑经,刘华,等.姜黄素对人食管癌耐药细胞Eca-109/VCR生长和凋亡的影响[J].实用医学杂志,2017,33(13):2083-2087.
[18]余俊青,姚广裕,胡晓磊,等.姜黄素通过降低MT1-MMP表达抑制乳腺癌细胞的增殖与侵袭[J].实用医学杂志,2017,33(9):1394-1396.
[19]Karim R,Palazzo C,Evrard B,et al.Nanocarriers for the treatment of glioblastoma multiforme:current state-of-the-art[J].J Control Release,2016,227:23-37.
[20]Barth RF,Kaur B.Rat brain tumor models in experimental neuro-oncology:the C6,9L,T9,RG2,F98,BT4C,RT-2 and CNS-1 gliomas[J].J Neurooncol,2009,94(3):299-312.
[21]Thomas AA,Ernstoff MS,Fadul CE.Immunotherapy for the treatment of glioblastoma[J].Cancer J,2012,18(1):59-68.
[22]Hammoud MA,Sawaya R,Shi W,et al.Prognostic significance of preoperative MRI scans in glioblastoma multiforme[J].J Neurooncol,1996,27(1):65-73.
