UVRAG基因缺失促进饥饿诱导的肝脏脂肪变性
2018-07-05胡晓雯张沙沙AMBERNaz朱洪新
胡晓雯,张沙沙,安 琳,AMBER Naz,朱洪新
(上海交通大学Bio-X研究院遗传发育与精神神经疾病教育部重点实验室,上海200240)
肝脏脂肪变性指中性脂肪(主要是甘油三酯)在肝脏中积聚,通常是由肝细胞摄取血浆游离脂肪酸、肝脏脂肪酸合成与肝脏脂肪酸氧化、肝细胞分泌极低密度脂蛋白之间失衡导致.血浆中游离脂肪酸主要来自于食物摄取的脂肪分解及外周脂肪动员释放的游离脂肪酸.在24 h饥饿条件下,肝脏脂肪酸合成受到抑制,但外周脂肪动员增强,脂肪组织大量甘油三酯水解产生的游离脂肪酸经血液运输至肝脏,肝脏摄取的游离脂肪酸一部分在线粒体中进行β氧化供能,另一部分重新合成甘油三酯以脂滴形式储存,而有些甘油三脂可与胆固醇一起结合载脂蛋白,以极低密度脂蛋白的形式分泌到血液中.因此,血浆游离脂肪酸的增加导致肝脏摄取游离脂肪酸增多,肝脏新合成脂肪酸增多、肝脏脂肪酸氧化减少或肝细胞释放极低密度脂蛋白障碍均可促进饥饿诱导的脂质积聚[1].
自噬是在真核生物中经溶酶体途径降解细胞内含物的分解代谢过程,其功能是能够降解蛋白质、细胞器及糖原.近年的研究发现,自噬可选择性降解脂滴,其过程也称为脂噬[2-4].在营养充足的条件下细胞以脂滴形式储存过剩的脂质,这些脂质主要含甘油三酯和胆固醇酯为主的中性脂肪.在饥饿诱导下,肝脏从血浆中摄取的大量游离脂肪酸中的部分形成脂滴,同时饥饿促进肝脏自噬活性.自噬通过溶酶体脂酶降解脂滴从而调控脂代谢,影响肝脏脂质积聚.肝脏特异性敲除自噬相关基因Atg7促进饥饿诱导的小鼠肝脏甘油三脂和胆固醇的积聚,同时释放到血液中,极低密度脂蛋白显著减少[5].在体外培养肝细胞,自噬阻断导致脂滴数量和体积增大[5].
紫外线辐射耐受相关基因(ultraviolet resistance-associated gene,UVRAG)是一种自噬相关蛋白,具有多种生物学功能.UVRAG与自噬相关基因Beclin1的结合增强了Ⅲ型磷脂酰肌醇激酶Vps34的活性,从而促进自噬体的生成和成熟[6-7].此外,UVRAG在抗凋亡[8]、维持染色体稳定性[9]、调控内吞[7]及自噬性溶酶体再生[10]等方面也起着重要作用.本研究前期工作发现,UVRAG基因的缺失可导致小鼠自噬流阻断[11],故对UVRAG在饥饿诱导肝脏脂肪变性中的作用进行了研究.
1 材料与方法
1.1 实验小鼠
本工作所用UVRAG基因缺失小鼠信息已发表,具体见文献[11-12].本工作使用的实验小鼠均为FVB/NJ遗传背景的两月龄雄性小鼠,在无特殊病原菌(specif i c-pathogen-free,SPF)级条件下饲养,光照时间7:00—19:00,黑暗时间19:00—次日7:00.饲养环境维持恒温、恒湿及恒压.在正常条件下小鼠可自由摄取水和食物,且有充足的活动空间.所有动物实验操作符合国际研究委员会指导准则及上海市动物福利与保护委员会的要求,动物使用许可证号为[SYXK(SH)2011-0112].UVRAG基因缺失纯合子小鼠通过UVRAG基因缺失的杂合子雄鼠与雌鼠交配获得.在饥饿实验中,饥饿组小鼠饥饿24 h,但可自由摄取水.对照组小鼠则可自由获取食物和水.
1.2 试 剂
兔源性内参基因GAPDH多克隆抗体(SanTa Cruz公司),兔源性Phospho-AMPKα多克隆抗体及兔源性AMPKα多克隆抗体(Cell Signaling Technology公司),HRP标记的山羊抗兔IgG(麦约尔公司),油红(Oil red O)(Sigma-Aldrich公司),Trizol(Life Technologies公司).
1.3 油红染色
取肝脏组织,在最适切割温度(optimal cutting temperature,OCT)包埋后制备8µm连续冰冻切片.冰冻切片在60%异丙醇溶液中浸泡1 min,与油红染色液室温孵育15 min后用蒸馏水清洗5次,然后用60%异丙醇清洗3 s,再用蒸馏水清洗3次.最后用苏木精复染细胞核2 min.水溶性封片剂(VectorshieldTM)封片,在显微镜下观察并拍片记录.
1.4 组织总RNA提取及RT-PCR
取小鼠肝脏约20 mg,用Trizol提取组织总RNA.每个样本取500 ng总RNA用Takara反转录试剂盒合成cDNA.用Roche SYBR试剂盒进行荧光定量聚合酶链式反应(reverse transcription-polymerize chain reaction,RT-PCR)分析,GAPDH作为内参.RT-PCR基因引物序列见表1.
1.5 免疫印迹
取肝脏组织约20 mg,用含蛋白酶抑制剂及磷酸酶抑制剂的组织裂解液匀浆,收集含总蛋白的上清液.用NanoDrop分光光度计检测蛋白浓度.组织蛋白用12.5%的聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离后转移至硝酸纤维素膜.5%脱脂奶粉封闭,与一抗在4°C孵育过夜,用磷酸盐缓冲液(tris buあer solution tween,TBST)缓冲液洗膜后与二抗室温孵育1 h,用TBST缓冲液洗膜后与显影液孵育显色.
1.6 血糖检测
用小鼠眼球采血法获得全血置于用肝素浸润的1.5 mL离心管中,并在4°C条件下3 000 g离心5 min,取上清获得血浆.用Accu-Chek Active(罗康全活力型)血糖仪(Roche公司)检测血浆葡萄糖浓度.
1.7 血浆和肝脏中甘油三脂、总胆固醇和游离脂肪酸检测
血浆及肝脏中的甘油三脂、总胆固醇和游离脂肪酸质量比分别用Wako公司的LabAssayTMTriglyceride,LabAssayTMCholesterol及LabAssayTMNEFA试剂盒检测.具体操作按试剂盒说明书进行.
1.8 统计学方法
平均数用mean±SEM(standard error of mean)表示,多组间平均数比较采用单因素方差分析,p<0.05为差异显著.
2 结果
2.1 UVRAG基因缺失促进饥饿诱导的肝脏脂肪变性
在本研究前期工作中发现,UVRAG基因缺失会导致自噬流阻断[11].由于自噬在肝脏脂代谢中起着重要作用,因此推测UVRAG基因缺失会影响肝脏脂代谢.首先用油红染色方法检测UVRAG基因的缺失对饥饿诱导的小鼠肝脏中脂滴质量比的影响.在正常生理条件下,UVRAG基因缺失小鼠和野生型对照的小鼠肝脏脂滴均很少,无明显差异.在饥饿条件下,野生型小鼠肝脏脂滴显著增加,但是UVRAG基因缺失小鼠脂滴较野生型小鼠进一步增加(见图1(a),图中Fed为正常喂养组,Fasted为饥饿处理组;+/+为野生型雄鼠,−/−为UVRAG基因缺失雄鼠;n=5,6;p<0.05),表明UVRAG基因缺失能够促进饥饿诱导的肝脏脂滴形成.接着本工作对肝脏组织甘油三脂、总胆固醇及游离脂肪酸进行检测分析.在正常生理条件下,UVRAG基因缺失小鼠和野生型小鼠肝脏组织的甘油三脂无显著差异.在饥饿条件下,野生型小鼠肝脏甘油三脂显著上调,而UVRAG基因缺失小鼠肝脏甘油三酯质量比较野生型对照小鼠进一步增大,证实了UVRAG基因缺失促进小鼠肝脏组织脂质积聚.类似地,在正常生理条件下,UVRAG基因缺失小鼠肝脏总胆固醇和游离脂肪酸质量比与野生型小鼠对照无显著性差异,但在饥饿条件下UVRAG基因缺失小鼠肝脏总胆固醇及游离脂肪酸质量比较野生型对照显著增大(见图1(b)~(c)).这些结果表明,UVRAG基因缺失可促进饥饿诱导的肝脏组织脂质积聚.
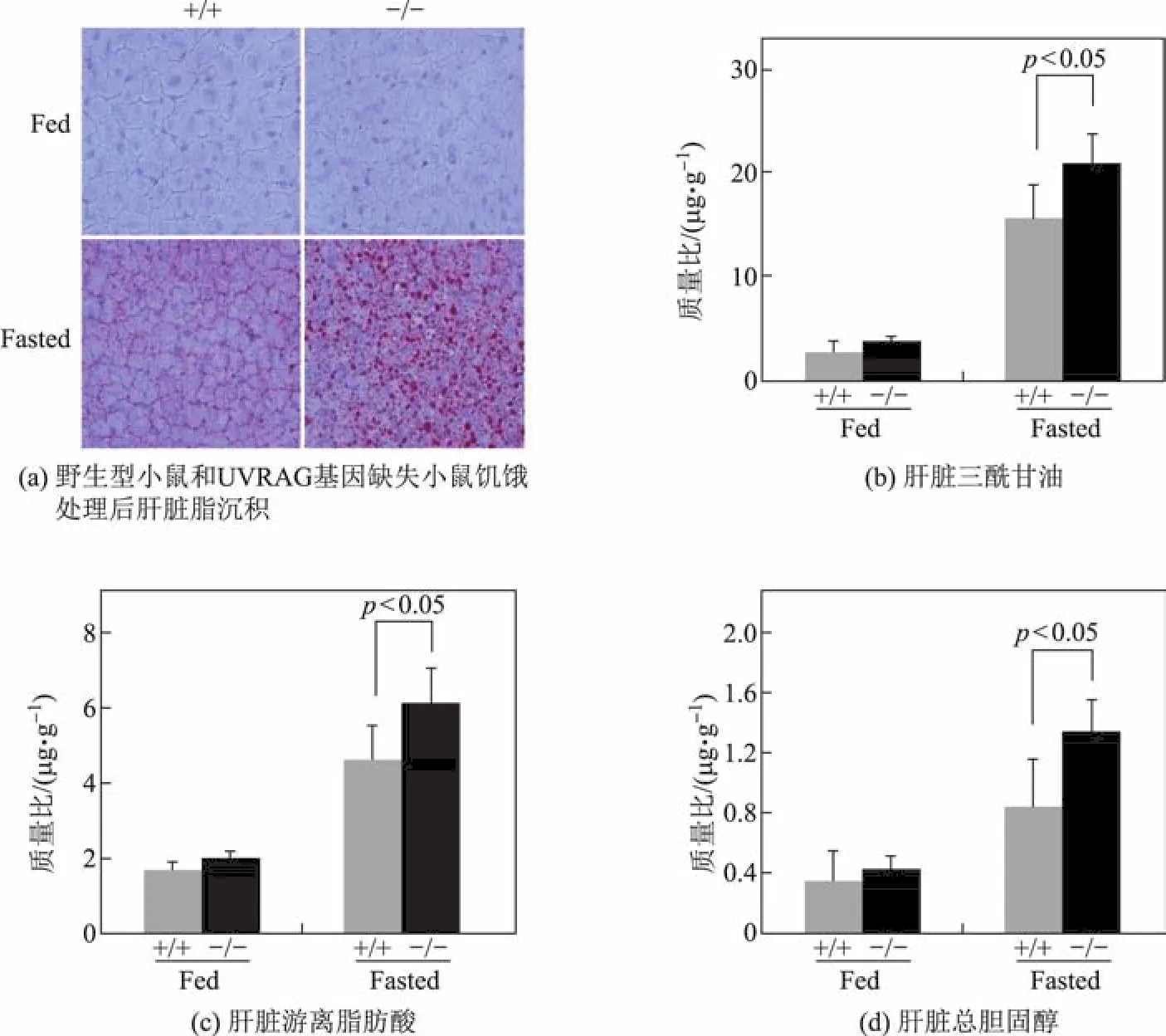
图1 UVRAG基因缺失促进饥饿诱导的肝脏脂肪变性Fig.1 UVRAG def i ciency exacerbates fasting-induced hepatic steatosis
2.2 UVRAG基因缺失对小鼠肝脏脂肪代谢相关基因表达的分析
肝脏脂质积聚由游离脂肪酸的摄取、合成和氧化平衡失调所致.因此用实时RT-PCR的方法检测脂代谢相关基因胆固醇调节元件结合蛋白-1(sterol regulatory element-binding protein 1,SREBP-1)CD 36,FAS,PPARα,CPT-1及FGF 21的表达.其中CD 36是长链脂肪酸摄取的主要载体,SREBP 1是一种重要的脂质生成基因的转录调控因子,FAS是脂肪酸生物合成中最重要的复合酶体,CPT-1是长链脂肪酸由胞浆转移到线粒体氧化的关键限速酶,PPARα是调控脂代谢的核受体,FGF 21主要是肝脏中合成的调控脂代谢的细胞因子[13].结果显示,在正常生理条件下UVRAG基因缺失小鼠和野生型小鼠肝脏组织CD 36,FAS,PPARα,CPT-1及FGF 21的表达无显著性差异.UVRAG基因缺失小鼠肝脏组织SREBP-1表达较野生型小鼠显著下调.在饥饿条件下,UVRAG基因缺失小鼠和野生型小鼠肝脏组织CD 36表达无显著变化.肝脏SREBP-1和FAS表达在饥饿条件下显著下调,与报道的结果一致[14],但UVRAG基因缺失小鼠和野生型小鼠无显著变化.在饥饿条件下,野生型小鼠肝脏PPARα,CPT-1和FGF 21表达显著上调,与已报道的结果一致[14],但是UVRAG基因缺失小鼠和野生型小鼠无显著变化(见图2).图2中,Fed为正常喂养组,Fasted为饥饿处理组;+/+为野生型雄鼠,−/−为UVRAG基因缺失纯合子雄鼠;n=3;p<0.05.以上结果表明,UVRAG基因缺失对肝脏脂质摄取转运、合成和氧化相关基因转录表达无影响.
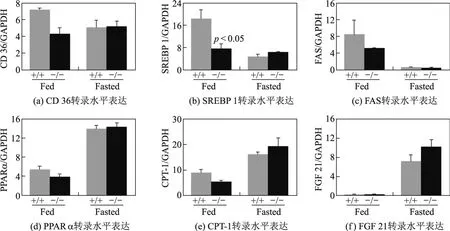
图2 UVRAG基因缺失对肝脏脂质代谢和糖异生相关基因转录表达的影响Fig.2 The inf l uence of UVRAG def i ciency to the expression levels of genes related to lipid metabolism and gluconeogenesis in the liver
2.3 UVRAG基因缺失对AMPK活性的作用
腺苷酸活化蛋白激酶(AMP-activatedproteinkinase,AMPK)是细胞能量感受器,对肝脏脂代谢和糖代谢起着重要的调控作用[15].免疫印迹结果显示,在饥饿条件下UVRAG基因缺失小鼠和野生型小鼠肝脏p-AMPK/AMPK无显著变化(见图3).图3中,Fed为正常喂养组,Fasted为饥饿处理组;n=3;+/+为野生型小鼠,−/−为Rubicon基因缺失小鼠
2.4 UVRAG基因缺失对血浆参数的影响
由于在饥饿条件下,肝脏游离脂肪酸主要来自于白色脂肪组织动员释放到血液中的脂肪酸,而UVRAG全身敲除可能会影响血液脂肪酸的浓度,从而对肝脏脂质积聚产生影响,因此本工作检测野生型小鼠和UVRAG基因缺失小鼠血浆中游离脂肪酸、甘油三脂和胆固醇浓度.结果显示,在饥饿条件下UVRAG基因缺失小鼠血浆中甘油三脂和游离脂肪酸浓度较对照组显著升高,而血浆胆固醇浓度无显著性差异(见图4(a)~(c)).饥饿后野生型小鼠血糖浓度较正常对照组显著下调,而UVRAG基因缺失纯合子小鼠血糖浓度较野生型小鼠显著降低(见图4(d)).图4中,Fed为正常喂养组,Fasted为饥饿处理组;+/+为野生型小鼠,−/−为UVRAG基因缺失小鼠;n=3,4,5;p<0.05.这些结果表明,全身UVRAG基因缺失对血浆甘油三脂、游离脂肪酸及血糖产生影响.

表1 实时RT-PCR引物序列Table 1 Primers in real time RT-PCR
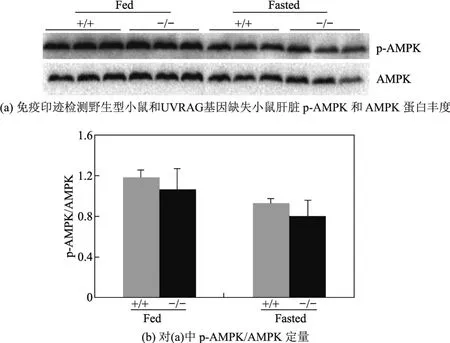
图3 UVRAG基因缺失对AMPK活性的影响Fig.3 The inf l uence of UVRAG def i ciency to AMPK activation

图4 UVARG基因缺失对血浆参数的影响Fig.4 The inf l uence of UVRAG def i ciency to blood prameters
3 讨论
在正常生理条件下,UVRAG基因缺失不影响肝脏脂滴质量比,这可能与脂滴形成较少及UVRAG基因缺失抑制但并没有完全阻断自噬有关.在饥饿条件下,油红染色及肝脏脂质检测分析显示,UVRAG基因缺失促进肝脏脂质变性,与预期结果一致.由于在饥饿条件下,肝脏摄取游离脂肪酸多于脂肪酸氧化,因此部分游离脂肪酸形成甘油三酯并以脂滴形式储存,自噬通过水解脂滴提供游离脂肪酸.自噬抑制可导致脂滴分解减少,促进肝脏脂质积聚.由于UVRAG基因缺失部分阻断自噬,因此UVRAG基因缺失促进饥饿导致的肝脏脂质积聚的部分原因是由于肝脏脂滴分解减少,从而加重肝脏脂质积聚.
由于UVRAG基因缺失促进脂质积聚,因此可能会影响肝脏脂代谢相关基因表达.本工作检测了调控游离脂肪酸摄取基因CD 36,游离脂肪酸合成调控基因SREBP-1及FAS,游离脂肪酸氧化调控基因CPT-1,PPARα及FGF 21.意外的是,在饥饿条件下UVRAG基因缺失对上述基因表达无显著影响.此外,在饥饿条件下UVRAG基因缺失小鼠肝脏脂代谢调控因子AMPK活性较野生型小鼠也没有显著变化.尽管目前原因不清楚,但本工作在检测血浆参数时发现,在饥饿条件下UVRAG基因缺失小鼠血浆游离脂肪酸较野生型小鼠显著上调.因此可推测,在饥饿条件下虽然UVRAG基因缺失可能会导致肝脏脂滴降解所提供的脂肪酸减少,但是肝脏可能从血浆中摄取游离脂肪酸增多,因此肝脏脂质氧化及脂肪酸合成相关基因表达没有发生显著变化.此外,本工作还检测了血糖浓度.在饥饿条件下,野生型小鼠血糖显著下降,与预期一致.UVRAG基因缺失小鼠血糖浓度较野生型小鼠进一步下调,这可能与UVRAG基因缺失导致自噬抑制有关.近期的报道显示,在饥饿条件下自噬在血糖浓度维持中起着重要作用[16].
目前,尚不清楚UVRAG基因缺失小鼠血浆游离脂肪酸上调的机制,但本工作的前期研究结果和其他报道表明,UVRAG基因缺失或下调抑制自噬体成熟从而导致自噬流阻断,伴有自噬体增多[7,11].最近有研究表明,将自噬相关蛋白LC3Ⅱ可与甘油三酯脂酶(adipose triacylglyceride lipase,ATGL)结合可促进脂滴降解[17].在饥饿条件下,血浆游离脂肪酸主要来自于白色脂肪动员,因此很有可能是UVRAG基因缺失导致白色脂肪中自噬体增多,LC3Ⅱ与脂滴表面结合增加,从而募集更多ATGL促进脂肪动员,这还有待进一步证实.
综上所述,在本工作中可发现UVRAG基因缺失促进饥饿诱导的肝脏脂肪变性,这可能由肝脏脂噬减少及肝脏对血浆游离脂肪酸摄取增多导致.进一步研究揭示UVRAG在病理性脂肪肝发生中的作用将有重要的实践意义,从而为病理性脂肪肝的预防和治疗提供新的靶点.
致谢 感谢复旦大学发育生物学研究所提供了UVRAG基因缺失小鼠.
[1]KAWANO Y,COHEN D E.Mechanisms of hepatic triglyceride accumulation in non-alcoholic fatty liver disease[J].Journal of Gastroenterology,2013,48(4):434-441.
[2]LIU K,CZAjA M J.Regulation of lipid stores and metabolism by lipophagy[J].Cell Death and Diあerentiation,2013,20(1):3-11.
[3]SINGH R,KAUSHIK S,WANG Y J,et al.Autophagy regulates lipid metabolism[J].Nature,2009,458:1131-1135.
[4]CARMONA-GUTIERREZ D,ZIMMERMANN A,MADEO F.A molecular mechanism for lipophagy regulation in the liver[J].Hepatology,2015,61(6):1781-1783.
[5]MARTINEZ-LOPEZ N,SINGH R.Autophagy and lipid droplets in the liver[J].Annual Review of Nutrition,2015,35:215-237.
[6]LIANG C,FENG P,KU B,et al.Autophagic and tumour suppressor activity of a novel Beclin1-binding protein UVRAG[J].Nature Cell Biology,2006,8(7):688-699.
[7]LIANG C,LEE J S,INN K S,et al.Beclin1-binding UVRAG targets the class C Vps complex to coordinate autophagosome maturation and endocytic traきcking[J].Nature Cell Biology,2008,10(7):776-787.
[8]YIN X C,CAO L Z,KANG R,et al.UV irradiation resistance-associated gene suppresses apoptosis by interfering with BAX activation[J].EMBO Reports,2011,12(7):727-734.
[9]ZHAO Z,OH S,LI D,et al.A dual role for UVRAG in maintaining chromosomal stability independent of autophagy[J].Developmental Cell,2012,22(5):1001-1016.
[10]MUNSON M J,ALLEN G F,TOTH R,et al.mTOR activates the VPS34-UVRAG complex to regulate autolysosomal tubulation and cell survival[J].The EMBO Journal,2015,34(17):2272-2290.
[11]SONG Z,AN L,YE Y,et al.Essential role for UVRAG in autophagy and maintenance of cardiac function[J].Cardiovascular Research,2014,101(1):48-56.
[12]DING S,WU X,LI G,et al.Eきcient transposition of the piggyBac(PB)transposon in mammalian cells and mice[J].Cell,2005,122(3):473-483.
[13]VACCA M,ALLISON M,GRIFFIN J L,et al.Fatty acid and glucose sensors in hepatic lipid metabolism:implications in NAFLD[J].Seminars in Liver Disease,2015,35(3):250-261.
[14]PALOU M,PRIEGO T,S´ACHEZ J,et al.Sequential changes in the expression of genes involved in lipid metabolism in adipose tissue and liver in response to fasting[J].Pf l ugers Arch,2008,456(5):825-836.
[15]VIOLLET B,GUIGAS B,LECLERC J,et al.AMP-activated protein kinase in the regulation of hepatic energy metabolism:from physiology to therapeutic perspectives[J].Acta Physiol(Oxf),2009,196(1):81-98.
[16]EZAKI J,MATSUMOTO N,TAKEDA-EZAKI M,et al.Liver autophagy contributes to the maintenance of blood glucose and amino acid levels[J].Autophagy,2011,7(7):727-736.
[17]MARTINEZ-LOPEZ N,GARCIA-MACIA M,SAHU S,et al.Autophagy in the CNS and periphery coordinate lipophagy and lipolysis in the brown adipose tissue and liver[J].Cell Metabolism,2016,23(1):113-127.
