Numb基因不同亚型对乳腺癌细胞MCF-7增殖和迁移能力的影响
2018-07-05王保垒李华顺2朱晨光
苏 杭, 王保垒, 李华顺2,, 朱晨光
(1.上海大学生命科学学院,上海200444;2.中国科学院上海高等研究院干细胞与纳米医学研究中心,上海201210;3.同济大学附属东方医院转化医学高等研究院,上海200085)
Numb作为细胞不对称性分裂的决定分子,最早被发现参与神经系统的不对称分裂,近年来被发现与肿瘤的恶性程度密切相关[1].Numb的缺陷会导致肿瘤的恶性程度增大,Numb在抑制上皮间质转化(epithelial-mesenchymal transitions,EMT)中的作用也较受关注[2].然而Numb表达缺陷导致肿瘤恶性程度增大的机制尚不清楚.研究表明,Numb能够阻滞抑癌蛋白p53被泛素化和降解的过程,并且与Notch,Hedgehog等重要信号通路密切相关;同时,Numb还是一种调节细胞内吞的因子[3-8].据报道Numb有6种剪切形式,但是最为广泛关注的剪切体有4种,分别为膜联形式(p66和p72)和胞质形式(p65和p71),其分子及细胞内定位的多样性使研究Numb的功能机制变得更为复杂[9-12].过去的一项研究对321例乳腺癌样本Numb进行免疫组化分析,发现Numb阳性率越低,乳腺癌的恶性程度就会越大[5].但是,很多研究仅仅通过Numb表达的总量来对肿瘤恶性程度进行分类,很少有研究涉及到Numb蛋白不同亚型在肿瘤细胞中的作用,而Numb的不同蛋白亚型之间,不论是在发育的时空表达方面,还是在功能方面,都有明显差异.研究Numb的不同亚型在肿瘤中的表达和功能,是一项亟待解决的问题.
区分Numb不同形式的拼接分子的不同功能,对进一步了解Numb的功能及其调控机制极为必要.基于前期的研究结果,本工作研究Numb在乳腺癌细胞发生过程中的作用,并着重探讨不同拼接形式的Numb亚型对乳腺癌细胞的作用及机制,尝试以Numb的不同亚型表达高低作为肿瘤恶性程度分型的标志,为癌症个性化治疗提供指导.
1 材料与方法
1.1 材料
DMEM(dulbeceo’s modif i ed eagle medium)培养液(高糖)、胎牛血清、磷酸盐缓冲盐溶液(phosphate buあer saline,PBS)(Hyclone公司);胰蛋白酶-乙二胺四乙醇(ethylendiaminetetraacetic acid)(Life Technologies公司);转染试剂Megatran1.0(Origene公司);细胞系筛选抗生素嘌呤霉素(Puromycin)(Sigma公司);放射免疫沉淀实验(radio immunoprecipitation assay,RIPA)裂解液(强)(碧云天公司);蛋白酶抑制剂coctail(Roche公司);质粒小量提取试剂(Omega公司);质粒中量提取试剂(MN公司);基因组提取试剂(天根生物公司);转录激活样效应因子核酸酶(transcription activator-like eあector nuclease,TALEN)试剂(斯丹赛公司);各种限制性内切酶BamHⅠ和PstⅠ(NEB公司);细胞增殖与活性检测试剂CCK-8(同仁化学公司);人乳腺细胞系MCF-7细胞和人胚肾上皮细胞系293T细胞(中国科学院上海生命科学院细胞库);兔抗人Numb多克隆抗体(Cell Signaling Technology公司);大鼠抗小鼠E-cadherin抗体(Takara公司);小鼠来源β-actin内参抗体(金斯瑞公司);山羊抗兔IgG(H&L)Antibody IRDye800CW抗体和山羊抗小鼠IgG(H&L)Antibody IRDye800CW抗体(Rockland Immunochemicals公司);Numb剪切体表达载体p65,p66,p71和p72(同济大学附属东方医院王保垒老师构建).
1.2 细胞培养
乳腺癌细胞MCF-7和人胚肾上皮细胞系293T细胞均采用含10%胎牛血清高糖DMEM培养液,置于37°C、CO2体积分数为5%的培养箱中培养.
1.3 TALEN打靶载体构建及验证
人体Numb基因有23个转录本,选取23个转录本中共同的编程序列(coding sequencce,CDS)区TCCAGAGGCCAGTCGTCCACATCAGTGGCAGACAGATGAAGAAGGCGTTCGC设计打靶位点组合.TALEN打靶载体的构建及验证参照斯丹赛公司提供的TALEN试剂盒使用说明书.
1.4 Numb敲除的MCF-7细胞系构建
在成功构建Numb基因TALEN打靶载体后,利用细胞转染试剂Megatran 1.0按标准方法将载体转入MCF-7细胞,Megatran 1.0与载体比例为3µL:1µg.24 h后换成含2µg/mL Puromycin的筛选培养基,筛选培养3 d,3 d后去上清,用PBS洗3次,消化细胞并计数,利用有限稀释法接种在96孔板中,待单克隆细胞团长起,消化细胞,提取基因组,聚合酶链式反应(polymerase chain reaction,PCR)扩增Numb基因片段,送测序.Numb基因PCR引物序列 (5’-3’):AGAGGTAGATGGGTAGGCAGA,CACTCCCTCAGCTTCACCAG.Numb 基因测序引物序列(5’-3’):GTTAGTATGGTAAT-CCAAAG.选取Numb基因发生突变的细胞系,经Western blot检测Numb蛋白表达情况,选取不表达蛋白的细胞系,作为Numb-KO稳定细胞系.
1.5 Western blot实验
Numb基因敲除和正常MCF-7细胞用胰酶消化,收集细胞,用冷的PBS洗3次,然后用蛋白裂解液RIPA(强)冰上裂解30 min,4°C 13 000 g离心15 min,取上清即为提取的总蛋白悬液;二喹啉甲酸(bicinchoninic acid,BCA)法测量蛋白质量百分比,加入SDS上样缓冲液100°C煮5 min,冰上放置5 min,即可进行SDS-聚丙烯酰氨凝胶电泳(polyacrylamide gel electroph-oresis,PAGE)电泳;完成电泳后转印到聚偏二氟乙烯(polyvinylidene f l uoride,PVDF)膜上,294 mA,1 h;用含5%脱脂奶粉的PBS封闭1 h;4°C一抗(1:1 000)过夜,然后用PBS洗3次,每次5 min;二抗(1:10 000)室温孵育1 h,然后用PBS洗3次,每次5 min,利用Odyssey双色红外荧光成像系统成像.
1.6 Numb各亚型瞬时表达细胞系构建
将p65,p66,p71,p72和EGPF这5种质粒表达载体转染进Numb-KO MCF-7细胞中,分别命名为p65组,p66组,p71组,p72组和增强绿色荧光蛋白(enhanced green f l uorescent protein,EGFP)组(阴性对照).使用的转染试剂为Megaran 1.0,于转染后24 h更换培养基,各瞬时表达细胞系用于以后的实验.
1.7 细胞增殖曲线测定
收集细胞,加细胞悬液100µL(5 000个细胞)到96孔板(边缘孔用无菌水或PBS填充).设置空白孔(有培养基,无细胞)和对照孔(正常MCF-7细胞),每组设定5个复孔.置37°C,5%CO2孵育过夜,倒置于显微镜下观察.每孔加入10µL CCK-8溶液,37°C孵育1 h.测定450 nm各孔的吸光值.将各测试孔的光密度值(optical density,OD)值减去空白孔OD值,即为相对吸光度.
1.8 细胞划痕实验测定迁移能力
将Numb-KO MCF-7组、MCF-7组细胞接种于6孔板中(5×104个细胞/孔),待细胞呈现单层紧密贴壁生长时用黄色移液器吸头划痕,用PBS洗去悬浮细胞,用含2%胎牛血清的高糖DMEM培养基继续培养细胞.分别于划痕后0,24,48 h在光学显微镜下观察并拍照,并应用Image-Pro Plus 6.0软件测量划痕间的距离,计算细胞迁移率.
1.9 PI染色检测细胞周期
计数细胞,在流式管中加入1×106个细胞,用PBS洗涤1次(300 g离心5 min).用多聚甲醛固定细胞:去上清,加入500µL冷PBS,轻柔混匀.加入500µL的4°C的2%多聚甲醛,再次混匀.4°C孵育1 h.乙醇破膜:300 g离心5 min,去上清,再次用3 mL冷PBS洗涤1次.逐滴加入1 mL 70%的乙醇(−20°C),边加边振荡混匀,4°C孵育过夜.PI染色:300 g离心5 min,去上清,加入RNAse工作液1 mL,室温放置30 min,300 g离心,去上清加入1 mL碘化丙啶(propidium iodide,PI)工作液,37°C避光孵育30 min,用40或70µm的滤网过滤掉团块.上机分析.
1.10 流式细胞术检测细胞表面蛋白
将单细胞悬液加入离心管中,离心,300 g,5 min,弃上清液.以冷PBS 1 mL离心洗涤,弃上清液.用PBS稀释的第一抗体200µL,对照管中加入对应于一抗的动物IgG,轻轻吹打混匀,4°C或置冰上孵育1.5~2.0 h.离心,弃上清.PBS 1 mL离心洗涤2次,以去除多余的未结合的特异性抗体.PBS适当稀释的荧光素标记的第二抗体200µL,吹打混匀,4°C或置冰上孵育30 min,避光.PBS 1 mL离心洗涤2次.将细胞重新悬浮于0.5 mL的PBS中,混匀,置流式管中,避光,4°C冰箱保存,4 h内上机检测.
1.11 统计学方法
本工作中的各项实验均重复3次.采用SPSS 18.0软件进行数据分析,用Student’s t-test分析2组间的差异,以p<0.05表示差异具有统计学意义.
2 结果
2.1 利用TALEN技术建立Numb基因敲除体外模型
构建的TALEN敲除载体转染MCF-7细胞后,经Puromycin抗性筛选,单克隆挑取,PCR扩增Numb靶点DNA序列,测序验证,选取Numb基因发生突变的单克隆细胞扩大培养.测序结果显示,Numb-KO MCF-7细胞Numb基因发生缺失7个碱基的突变(见图1).经Western blot检测,检测不到Numb蛋白的表达,故Numb敲除细胞模型成功建立(见图2).
2.2 Numb基因敲除促进MCF-7细胞增殖
CCK-8检测细胞增殖结果显示,从培养第3天起,Numb-KO MCF-7的细胞增殖速度明显高于对照组正常MCF-7细胞,说明Numb基因敲除能够明显促进MCF-7的增殖,提示Numb对乳腺癌发生发展具有抑制作用(见图3).PI染色检测细胞周期结果显示,在敲除Numb基因后,G0G1期细胞比例降低了9.28%,G2M期细胞比例增加了4.36%,S期细胞比例增加了4.92%,说明Numb可以抑制MCF7细胞由G0G1期往G2M期和S期转化,对MCF-7细胞的增殖起到抑制作用(见表1).
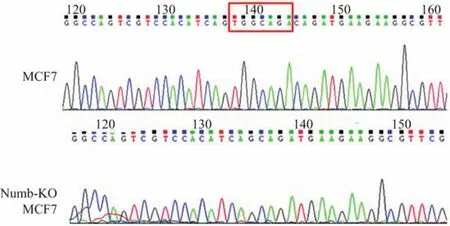
图1 Numb-KO MCF-7细胞Numb基因测序结果(红框内:缺失的碱基)Fig.1 DNA sequencing of Numb in Numb-KO MCF-7 cells(Red box:deleted bases)
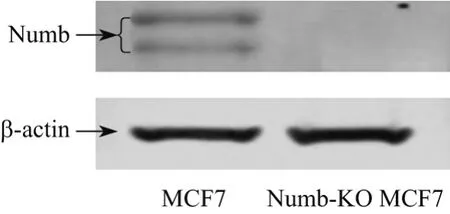
图2 MCF-7细胞和Numb-KO MCF-7细胞Numb表达Fig.2 Expression of Numb protein in MCF-7 and Numb-KO MCF-7 cells
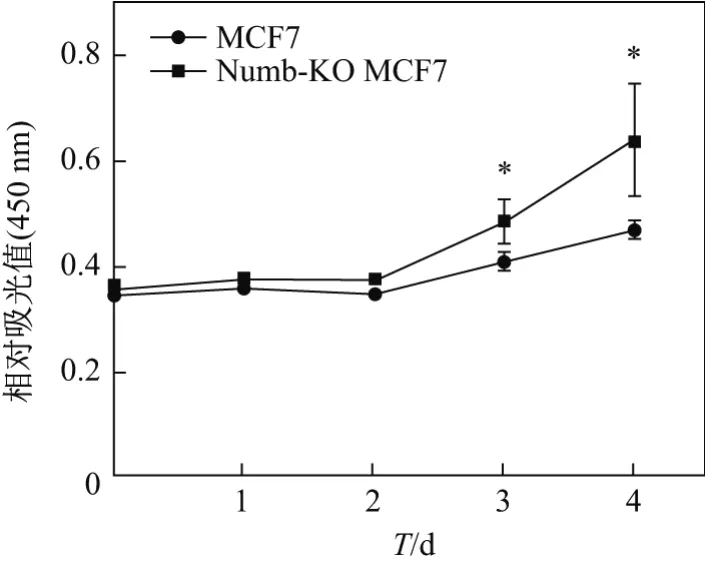
图3 CCK-8检测MCF-7细胞增殖Fig.3 MCF-7 cell proliferation assessed by CCK-8

表1 PI染色及流式细胞术检测MCF-7和Numb-KO MCF-7的细胞周期Table 1 Detection for cell cycle of MCF-7 and Numb-KO MCF-7 cells by staining with PI and f l ow cytometry %
2.3 Numb基因敲除促进MCF-7细胞迁移
采用细胞划痕实验检测正常MCF-7细胞和Numb敲除后MCF-7细胞迁移能力的结果显示,在细胞划痕48 h后,Numb-KO MCF-7细胞迁移率比阴性对照组正常MCF-7细胞迁移率高出22%,提示Numb对MCF-7细胞的迁移能力有抑制作用(见图4).流式细胞术检测上皮细胞表面钙粘蛋白(E-cadherin)结果显示,Numb敲除后的MCF-7细胞细胞表面E-cadherin的表达量(平均荧光强度(median f l uoresence intensity,MFI))降低了20.28%,说明Numb敲除后MCF-7细胞间黏附能力减弱,细胞迁移能力增强(见图5).
2.4 Numb基因各亚型转染效率观察
Numb基因各亚型转染Numb-KO MCF-7细胞24 h后,在荧光显微镜下观察可见载体质粒上的绿色荧光蛋白表达,细胞发出绿色荧光,转染效率大于90%,说明载体基因得到充分表达(见图6).图6中,第1行图为在相差显微镜明场下观察,第2行图为暗场观察绿色荧光.
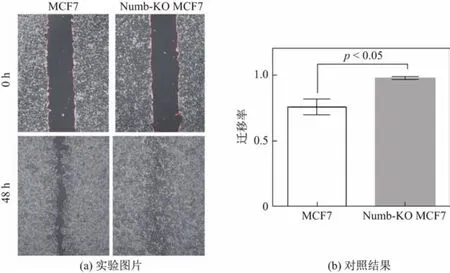
图4 划痕实验检测细胞迁移能力Fig.4 Detection for the abilities of migration of MCF-7 cells by wound scratch assay
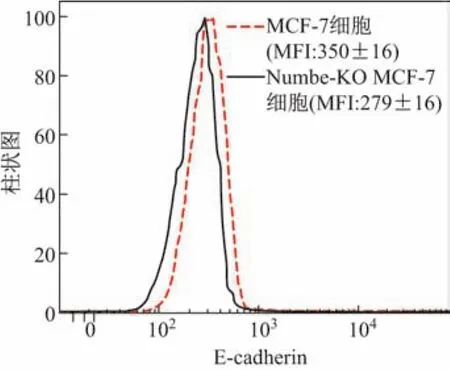
图5 流式细胞术检测E-cadherin表达水平Fig.5 E-cadherin expression level detected by f l ow cytometry
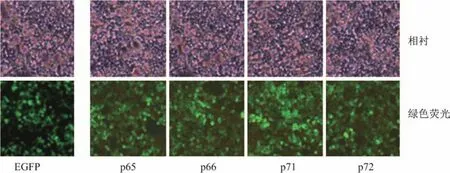
图6 Numb-KO MCF-7转染后荧光显微镜观察Fig.6 Fluorescent microscope observation of Numb-KO MCF-7 cells
2.5 Numb基因的4个亚型对MCF-7细胞增殖的影响
采用CCK-8细胞增殖实验结果绘制细胞增殖曲线(见图7(a)),发现在培养的第3天时,与阴性对照组(EGFP)相比,Numb基因的亚型P72转染组细胞增殖能力明显减弱.当培养第3天时各组细胞增殖情况可由图7(b)直观地看出.相对吸光值p72组比EGFP组降低16%,提示p72可以抑制Numb-KO MCF-7细胞的增殖.其他3种亚型p65,p66,p71对Numb-KO MCF-7细胞增殖无明显抑制作用(见图7).通过PI检测细胞周期实验结果发现,对Numb-KO MCF-7细胞增殖抑制最明显的仍为p72,p72转染后可将G0G1期细胞比例提高17.75%,S期细胞比例降低18.2%,对G2M期细胞比例没有影响,说明p72可以抑制细胞由G0G1往S期的转变,从而抑制细胞增殖(见表2).

图7 CCK-8检测个亚型转染后Numb-KO MCF-7细胞增殖能力Fig.7 Numb-KO MCF-7 cell proliferation assessed by CCK-8 after transfection with Numb isoforms
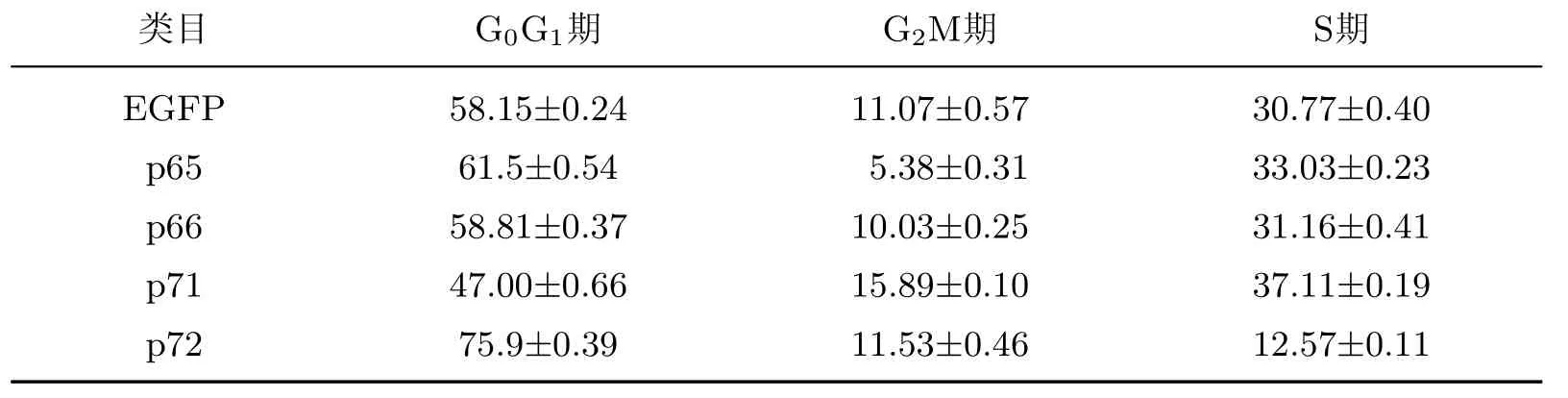
表2 PI染色及流式细胞术检测各亚型转染后Numb-KO MCF-7的细胞周期Table 2 Detection for cell cycle of Numb-KO MCF-7 cells after p65,p66,p71 and p72 expression vector transfecting by staining with PI and f l ow cytometry %
2.6 Numb基因的4个亚型对MCF-7细胞侵袭能力的影响
细胞划痕后于含2%FBS的高糖DMEM培养基中培养24 h,结果显示各亚型转染组迁移率与阴性对照EGFP组相比,迁移比率降低程度分别为p65组8.29%,p66组7.95%,p71组8.95%和p72组8.49%,这说明4种亚型均对Numb-KO MCF-7细胞迁移能力有抑制作用,但是抑制能力没有差异(见图8).用流式细胞术检测各亚型转染后Numb-KO MCF-7细胞表面E-cadherin的表达情况后发现,4种亚型转染组与EGFP(阴性对照)组相比,E-cadherin表达量(MFI)均有所提高,提高程度分别为p65组23.65%,p66组39.78%,p71组24.73%和p72组44.80%,说明4种亚型均对Numb-KO MCF7细胞的迁移能力起到抑制作用(见表3).
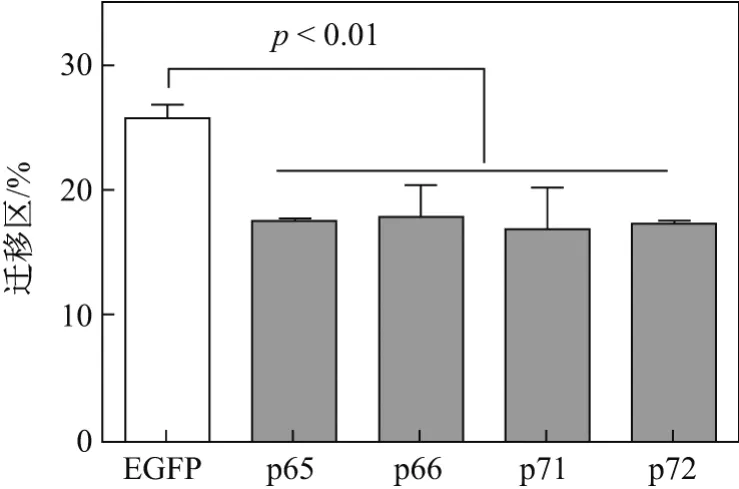
图8 划痕实验检测Numb各亚型对Numb-KO MCF-7细胞迁移能力的影响Fig.8 Dection for the abilities of migration of Numb-KO MCF-7 cells by wound scratch assay

表3 流式细胞术检测各亚型转染后Numb-KO MCF-7细胞表面E-cadherin表达水平Table 3 E-cadherin expression levels of Numb-KO MCF-7 cells after p65,p66,p71,p72 expression vector transfecting by f l ow cytometry
3 讨论
为探讨Numb不同亚型在乳腺癌发生中的作用,本工作利用TALEN技术构建了Numb敲除的MCF-7稳定细胞系Numb-KO MCF-7.首先,在Numb基因敲除后,MCF-7细胞增殖和迁移能力明显增强,进一步研究发现,Numb基因敲除后的MCF-7细胞S期和G2M期的比例增大,说明Numb可以阻滞MCF-7细胞由G0G1期往S期和G2M的转变,从而抑制MCF-7细胞的分裂.E-cadherin是一类介导同源细胞间粘附的钙离子依赖性跨膜糖蛋白,主要存在于人和动物上皮细胞中,对于维持上皮细胞形态和组织完整性发挥重要作用,同时抑制肿瘤的侵袭转移,影响原发肿瘤的早期生长和继发肿瘤的增殖生长.Numb敲除后的MCF-7细胞表面E-cadherin表达量降低,可能是肿瘤迁移能力增强的一个标志[13].Numb基因对MCF-7细胞的增殖和迁移的抑制,原因可能是由于Notch、Hedgehog等信号通路失去Numb蛋白的抑制从而被增强,p53稳定性和细胞内吞稳态平衡也可能受到影响,这与以往Numb基因在其他肿瘤细胞中的研究结果相吻合[14].
Numb基因的4种亚型的产生,是由于哺乳动物Numb基因存在转录后的选择性剪切,在磷酸酪氨酸结合(phosphotyrosine-binding,PTB)和富含脯氨酸域(proline-rich region,PRR)结构域分别插入11个氨基酸(ERKFFKGFFGK)或48个氨基酸(ANGTDSAFHVLAKPAHTALAPVA MPVRETNPWAHAPDAANKEIAATCS),由此产生PTBSPRRS(p65),PTBLPRRS(p66),PTBSPRRL(p71)和PTBLPRRL(p72)[9-10,15]4种蛋白亚型.本工作通过4种Numb表达质粒载体p65,p66,p71和p72分别转染Numb-KO MCF-7细胞,发现PTBLPRRL(p72)能够将Numb-KO MCF-7细胞的细胞周期阻滞在G0G1期,从而对细胞的增殖有明显的抑制作用,4种Numb基因亚型均对Numb-KO MCF-7细胞迁移能力有抑制作用,而且这4种亚型转染后,均能提高Numb-KO MCF-7细胞表面E-cadherin的表达量.
过去曾有学者在不同的系统中对Numb各亚型进行研究,发现在原代培养的小鼠神经前体细胞中,过表达PRRL将促进增殖,同时将不影响或抑制分化,而过表达PRRS则促进分化,同时抑制或不影响增殖[16];在P19细胞系中,PRRS能促进分化,而PRRL则不能;在视黄酸的诱导下,PRRL将促进P19细胞的增殖,而PRRS则不能[9];在果蝇外视原基中,h-PTBSPRRL(h表示来自人)能促进神经上皮细胞增殖,同时不影响分化,h-PTBSPRRS则能促进神经上皮分化而抑制其增殖[17].本研究结果与之前的一些报道有些不同,究其原因可能是研究系统有差异,因为在不同的组织细胞中,不同的Numb蛋白亚型具有不同功能,这是Numb的一个主要特点.Numb蛋白发挥作用主要是通过PTB和PRR 2个结构域,这2个结构域使得Numb能够介导其他蛋白的连接,从而发挥多种生理功能[18-20].Numb蛋白亚型p72与其他亚型相比,最主要的特点是在PTB和PRR 2个结构域中都有插入序列.Numb蛋白亚型p72对乳腺癌细胞增殖能力的抑制,可能是发挥维持Notch,Hedgehog和TP53等信号通路平衡的作用,而这一作用可能需要PTB和PRR结构域中的2个插入序列.而p65,p66,p71和p72这4种亚型均对MCF-7细胞迁移起到抑制作用,与Numb参与的细胞黏附、细胞迁移的功能有关[21],这一功能的发挥可能不需要PTB和PRR结构域中的2个插入序列.
Numb基因的不同蛋白亚型之间,不论是在发育时空的表达上,还是在功能方面,都有明显的差异,这使得Numb蛋白的亚型研究非常复杂.在过去10多年里得到了一些有价值的结果,但由于各种研究采用的系统不同,无法得出一个统一的结论[22].这是由Numb蛋白本身的特点决定的:Numb作为一个衔接蛋白,能够介导不同蛋白之间的连接,这使得Numb细胞选择命运的一个工具在不同的发育时空背景下被反复使用.因此,对Numb蛋白不同亚型的研究,要精确到特定的发育阶段和细胞类型.本工作对乳腺癌细胞系MCF-7中的Numb亚型作用进行了初步研究,但Numb亚型在肿瘤中的表达情况及生物学功能、各个亚型与Notch,Hedgehog等信号通路是如何作用的,都还值得在今后作进一步研究.
[1]PECE S,CONFALONIERI S,RR P,et al.Numb-ing down cancer by more than just a Notch[J].Biochimica et Biophysica Acta,2011,1815(1):26-43.
[2]WANG Z,LI S S C.Numb:a new player in EMT[J].Cell Adhesion and Migration,2010,4(2):176-179.
[3]DING X,MA M,TENG J,et al.Numb induces E-cadherin adhesion dissolution,cytoskeleton reorganization,and migration in tubular epithelial cells contributing to renal f i brosis[J].Current Molecular Medicine,2015,15(4):368-379.
[4]TOSONI D,ZECCHINI S,COAZZOLI M,et al.The Numb/p53 circuitry couples replicative selfrenewal and tumor suppression in mammary epithelial cells[J].Journal of Cell Biology,2015,211(4):845-862.
[5]PECE S,SERRESI M,SANTOLINI E,et al.Loss of negative regulation by Numb over Notch is relevant to human breast carcinogenesis[J].Journal of Cell Biology,2004,167(2):215-221.
[6]DI M L,FERRETTI E,GRECO A,et al.Numb is a suppressor of Hedgehog signalling and targets Gli1 for itch-dependent ubiquitination[J].Nature Cell Biology,2006,8(12):1415-1423.
[7]SHAO X,LIU Y,YU Q,et al.Numb regulates vesicular docking for homotypic fusion of early endosomes via membrane recruitment of Mon1b[J].Cell Research,2016,26(5):593-612.
[8]SUN M,ASGHAR S Z,ZHANG H.The polarity protein Par3 regulates APP traきcking and processing through the endocytic adaptor protein Numb[J].Neurobiology of disease,2016,93(9):1-11.
[9]DHO S E,FRENCH M B,WOODS S A,et al.Characterization of four mammalian Numb protein isoforms.Identif i cation of cytoplasmic and membrane-associated variants of the phosphotyrosine binding domain[J].Journal of Biological Chemistry,1999,274(46):33097-33104.
[10]钱文雨,李华顺.Numb与神经发育[J].中国细胞生物学学报,2010(1):1-16.
[11]BANI-YAGHOUB M,KUBU C J,COWLING R,et al.A switch in Numb isoforms is a critical step in cortical development[J].Developmental Dynamics,2007,236(3):696-705.
[12]VERDI J M,BASHIRULLAH A,GOLDHAWK D E,et al.Distinct human Numb isoforms regulate diあerentiation vs.proliferation in the neuronal lineage[J].Proceedings of the National Academy of Sciences of USA,1999,96(18):10472-10476.
[13]SLEEMAN J P,THIERY J P.SNAPSHOT:the epithelial-mesenchymal transition[J].Cell,2011,145(1):162-162.
[14]GULINO A,DI M L,SCREPANTI I.The multiple functions of Numb[J].Experimental Cell Research,2009,316(6):900-906.
[15]KARACZYN A,BANIYAGHOUB M,TREMBLAY R,et al.Two novel human Numb isoforms provide a potential link between development and cancer[J].Neural Development,2010,5(12):1040-1048.
[16]VERDI J M,BASHIRULLAH A,GOLDHAWK D E.Distinct human Numb isoforms regulate diあerentiation vs.proliferation in the neuronal lineage[J].Proceedings of the National Academy of Sciences,1999,96(18):10472-10476.
[17]TORIYA M,TOKUNAGA A,SAWAMOTO K,et al.Distinct functions of human Numb isoforms revealed by misexpression in the neural stem cell lineage in the Drosophila larval brain[J].Developmental Neuroscience,2005,28(1/2):142-155.
[18]GUO M,JAN L Y,JAN Y N.Control of daughter cell fates during asymmetric division:interaction of Numb and Notch[J].Neuron,1996,17(1):27-41.
[19]DHO S E,JACOB S,WOLTING C D,et al.The mammalian Numb phosphotyrosine-binding domain.Characterization of binding specif i city and identif i cation of a novel PDZ domain-containing Numb binding protein,LNX[J].Journal of Biological Chemistry,1998,273(15):9179-9187.
[20]WILLIAMSON M P.The structure and function of proline-rich regions in proteins[J].Biochemical Journal,1994,297(2):249-260.
[21]BERDNIK D,TOROK T G M,KNOBLICH J A.The endocytic protein alpha-adaptin is required for Numb-mediated asymmetric cell division in Drosophila[J].Developmental Cell,2002,3(2):221-231.
[22]RASIN M R,GAZULA V R,BREUNIG J J,et al.Numb and Numbl are required for maintenance of cadherin-based adhesion and polarity of neural progenitors[J].Nature Neuroscience,2007,10(7):819-827.
