饲料中添加复合益生菌对断奶仔猪生长性能、粪便微生物及血液生化指标的影响
2018-07-05欧阳富龙袁旭鹏赵玉蓉贺建华
杨 玲 ,欧阳富龙 ,袁旭鹏 ,李 佳 ,赵玉蓉 ,贺建华 *
(1.湖南农业大学动物科学技术学院,湖南长沙 410128;2.湖南鑫广安农牧股份有限公司,湖南长沙 410128;3.湖南畜禽安全生产协同创新中心,湖南长沙 410128;4.广东大泽农生物科技股份有限公司,广东珠海 519031)
在畜禽养殖中滥用抗生素会导致细菌耐药性增加,动物产品中抗生素残留以及环境、正常微生物群落的不平衡等诸多副作用(董晓丽等,2013)。益生菌制剂是目前使用最普遍的一种饲用抗生素替代品,益生菌是定植于动物肠道和生殖系统内,能够产生确切健康功效的活性有益微生物的总称,在动物体内发挥着极其重要的作用 (高侃,2013)。其中丁酸梭菌具有益生菌制剂所具有的特征及功能,但又有其特有的特征与功能,能够很好的抑制有害菌的生长,分泌淀粉酶、糖苷酶及降解饲料的果胶酶和葡聚糖酶,在消化道中帮助其成为消化道优势菌群,对机体产生各种益生作用,具有广阔的应用前景 (谢丽静等,2017;易中华等,2012)。曹广添等(2012)在体外将丁酸梭菌分别与大肠杆菌、沙门氏菌、产气荚膜梭菌、乳酸杆菌、双歧杆菌按不同的比例混合后进行培养,发现其对大肠杆菌、沙门氏菌、产气荚膜梭菌等致病菌有明显的抑制作用,对乳酸杆菌和双歧杆菌等有益菌的生长具有一定的促进作用。肖宏德等(2014)研究发现,用复合益生菌制剂部分或全部替代断奶仔猪饲粮中的抗生素,可以改善仔猪的生长性能,显著降低仔猪的腹泻率,但很少有关丁酸梭菌等复合而成的益生菌替代抗生素的效果研究。本试验选用分离鉴定的具有良好安全性能的丁酸梭菌等益生菌制成的复合益生菌制剂,研究其替代抗生素对断奶仔猪生长性能、粪便微生物和血清生化指标的影响,旨在为该类复合益生菌制剂作为抗生素替代品在断奶仔猪的应用提供科学依据。
1 材料与方法
1.1 试验设计 试验选取日龄基本一致、体重(8.5±0.5)kg、经过免疫的健康PIC断奶仔猪224头,随机分为4组,每组4个重复,每个重复14头猪,A组为对照组,饲喂无抗饲粮(不添加任何抗生素和具有抗菌功能的产品);B组为0%替代组(抗生素组),即在对照组的基础上添加抗生素(金霉素75 mg/kg+杆菌肽锌40 mg/kg+吉他霉素50 mg/kg);C组为50%替代组,即无抗饲粮+减半抗生素 (金霉素37.5 mg/kg+杆菌肽锌20 mg/kg+吉他霉素25 mg/kg)+复合益生菌0.75 kg;D组为100%替代组,即无抗饲粮+复合益生菌1 kg。试验预饲期4 d,正式期25 d。试验猪自由采食,充足饮水,按正常免疫程序进行免疫接种。试验饲粮按照NRC中10~20 kg生长猪的营养需要配制,基础试验饲粮组成及营养水平见表1。
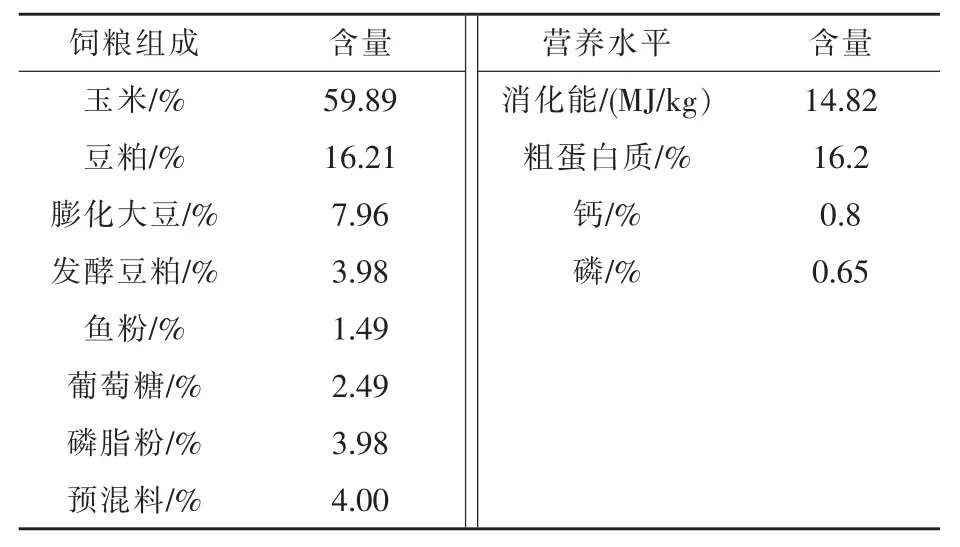
表1 基础饲粮组成及营养水平(风干基础)
1.2 试验材料 本试验所用复合益生菌制剂,包含丁酸梭菌(≥5×108cfu/g)、地衣芽孢杆菌(≥1.5×1010cfu/g)、枯草芽孢杆菌(≥1×1010cfu/g)、嗜酸乳杆菌(≥1×108cfu/g)。试验动物由鑫广安鹏扬原种猪场提供健康PIC断奶仔猪,饲养试验于湘潭鹏扬原种猪场进行。
1.3 检测指标
1.3.1 生长性能 每天记录仔猪采食量及腹泻率,试验前后对断奶仔进行称重并计算平均日增重、平均采食量、平均料肉比以及腹泻率。试验中出现死亡情况,按死淘猪处理方式处理。
腹泻率=总腹泻头次数/试验天数/试验猪数。
1.3.2 粪便微生物 试验第5、15、25天在每个重复中分别随机收取3头小猪的粪便进行微生物的检测,微生物检测主要检测大肠杆菌、沙门氏菌、产气荚膜梭菌,粪样采取方法:在规定的时间里分别从处理组的每个平行中的不同地点采取部分粪便,粪样放入装有冰块的保温盒里迅速带回实验室,然后将处理组所有平行中采取的粪样混合均匀成一个样品进行待检。所有样品在采样后48 h内进行微生物培养测定。大肠杆菌用麦康凯培养基,沙门氏菌用亚硫酸铋(BS)琼脂培养基,产气荚膜梭菌用胰胨-亚硫酸盐-环丝氨酸(TSC)琼脂培养基。
微生物分析在湖南省农业科学院土壤与肥力研究所完成,将对照组和试验组的冷藏保存粪样品取出,每份粪样取3 g加入27 mL无菌水,置于25℃、180 r/min的摇床中振荡30 min,作为10-1稀释液,然后在无菌条件下从10-1稀释液取1 mL加入9 mL无菌水,制得10-2稀释液,以此类推制成10-3、10-4、10-5稀释液。在超净工作台内酒精灯旁,取 10-4、10-5稀释液各1 mL,分别加到灭菌平皿内,平皿内倒入适量温热培养基混合均匀,每个稀释度作三个平行。先正置放15~20 min,然后倒置于37℃恒温箱培养,24 h后进行菌落计数。
每克猪粪的菌落数/g=同一稀释度3次重复的菌落平均数×稀释度;
以上操作均严格按试剂说明书严格执行。
1.3.3 血液生化指标 于试验结束当天,每个重复随机选取 1头试验猪前腔静脉采血 10 mL,静置2 h,采用台式自动平衡离心机KC-50X,转速为 3000 r/min,离心 10 min,分离血清,取上清液,-20℃保存备用。试验采用全自动生化分析仪 BS-400 测定血清总蛋白(TP)、白蛋白(ALB)、尿素氮(UREA)、碱性磷酸酶(ALP)活性和血清免疫球蛋白 G(IgG)、免疫球蛋白 M(IgM)、补体C3的含量。
1.4 数据统计分析 先用Excel处理数据,再用SPSS19.0单因素方差分析,并用Duncan氏进行多重比较,P<0.05为差异显著,P<0.01为差异极显著,P>0.05为差异不显著。
2 结果
2.1 复合益生菌对断奶仔猪生长性能的影响 由表2可知,各组断奶仔猪生产性能无显著差异(P>0.05)。4组淘汰率以A组最高,分别比B、C、D组高出2.99、1.5倍及 2.9倍,但均无显著差异 (P>0.05)。D组腹泻率与A组存在显著差异 (P<0.05),与B、C组存在差异趋势。4组随着复合益生菌的替代比例增加,腹泻率呈线性降低(P=0.04)。

表2 复合益生菌对断奶仔猪生长性能的影响
2.2 复合益生菌对断奶仔猪血液生化指标的影响 由表 3可知,A组ALP高于其他三组,D组TP低于其他三组,但两者组间差异均未达到显著水平 (P> 0.05)。 其他血清生化指标,ALB、C3、IgM、IgG不同组间差异不显著 (P>0.05),D组UREA与其他组存在显著差异(P<0.05),其比最低组C组高出61.09%。

表3 复合益生菌对断奶仔猪血液生化指标的影响
2.3 复合益生菌对断奶仔猪粪便微生物的影响由表4可知,在试验第5、15、25天,各组粪便中大肠杆菌数、沙门氏菌数和产气荚膜梭菌均存在极显著差异 (P<0.01)。在试验第15天左右时,B、C、D组的大肠杆菌分别比无抗组降低82.37%、87.48%、52.56%(P < 0.01);C 组沙门氏菌分别比无抗组降低 70.63%、53.15%(P<0.01);试验第25天,A组大肠杆菌数量仍与试验处理组有显著差异(P < 0.01),分别比 B、C、D组高出 23.68%、25.3%、11.4%;B、C、D 组沙门氏菌分别比A组降低42.53%、92.42%、79.11%(P<0.01),产气荚膜梭菌比无抗组降低66.10%、94.29%、77.64%(P < 0.01)。

表4 复合益生菌对断奶仔猪粪便微生物菌群的影响
同时,除A组的产气荚膜梭菌外无显著差异外(P>0.05),4处理组大肠杆菌数随着试验周期的推移而变动,差异极显著(P<0.01)且变化趋势不一。在第5、15天及25天时,A组的大肠杆菌数和沙门氏菌数、B组的大肠杆菌、沙门氏菌以及产气荚膜梭菌、C组的大肠杆菌均呈先上升后下降但总体下降的趋势;而C、D组的沙门氏菌、产期荚膜梭菌以及D组的大肠杆菌则均随时间的推移而持续下降,且差异极显著(P<0.01)。
3 讨论
3.1 复合益生菌对断奶仔猪生长性能及腹泻率的影响 近年来在畜禽生产上,复合益生菌在替代抗生素方面得到了广泛的实践与应用,特别是丁酸梭菌的应用效果显著(华均超等,2011),其提高生长性能的作用类似于抗生素所具有的抑制致病菌繁殖生长的作用。肖雪梅等(2013)发现,在断奶仔猪的日粮中添加丁酸梭菌可以提高仔猪的日增重,增加采食量,降低腹泻率。Hooper等(2012)和Tremaroli等(2012)研究表明,复合益生菌进入肠道后,各种益生菌与肠道微生物之间可以产生协同互补作用,调节猪的肠道菌群,促进猪的生长。Liao等(2015)分别用添加不同浓度的丁酸梭菌日粮饲喂肉鸡,可以改善肉鸡的生长性能,结果表明其促生长的机制是通过一个健康的微生态环境,增加消化酶活性和短链脂肪酸的浓度,可以有效替代抗生素。本研究以丁酸梭菌复合益生菌替代饲粮中的抗生素,生长性能结果显示,饲粮中抗生素被复合益生菌替代,均能达到与抗生素持平的促生长效果,且完全添加丁酸梭菌复合益生菌的促生长效果有超过抗生素的趋势。复合益生菌中的丁酸梭菌在代谢过程中可以产生淀粉酶、叶酸、B族维生素等多种维生素,这些益生物质能够维护动物肠道健康,提高动物生长性能。
丁酸梭菌在代谢过程中会产生丁酸梭菌素等抗菌物质,丁酸梭菌素能抑制和杀灭某些梭状芽孢杆菌,具有一定的杀菌作用,改善肠道菌群紊乱,增强肠道屏障功能,降低腹泻 (桂国弘,2016)。Hayakawa等(2016)研究表明,由 STa+ETEC 感染引起的断奶后腹泻可能由小肠中的IgA分泌诱导,通过添加一定量的益生菌制剂可以改善其在肠道上的拓扑异常,降低腹泻率。肖宏德等(2014)研究发现,用复合益生菌制剂代替饲粮中的抗生素,可以达到降低腹泻率、促生长的效果。凌欣华等(2016)研究报道,在断奶仔猪饲粮中添加低浓度的复合丁酸梭菌制剂与添加高浓度的复合丁酸梭菌制剂相比,其腹泻率下降幅度大,说明适宜的丁酸梭菌制剂添加量对预防仔猪腹泻有明显的效果。本试验结果表明,丁酸梭菌复合益生菌,能够显著降低腹泻率,防控仔猪腹泻的效果明显优于其他组,可以替代抗生素的使用。丁酸梭菌的代谢产物丁酸可以降低肠道pH,抑制有害菌的生长,对畜禽肠炎引起的腹泻有一定的抵御作用。复合益生菌可以促进仔猪肠道中有益菌群的繁殖,建立良性的微生态环境,可以减少腹泻次数,降低腹泻率。
3.2 复合益生菌对断奶仔猪粪便微生物的影响复合益生菌可改善肠道微生态环境,抑制有害微生物的增殖,利于有益微生物的定植。丁酸梭菌在代谢过程中所产生的丁酸、乙酸等短链脂肪酸可以修复肠道黏膜,降低肠道pH,较低的肠道pH适合益生菌的生长,抑制有害菌的附着(张晓阳,2012)。 Servin 等(2004)研究发现,复合益生菌可以降低肠道pH,抑制大肠杆菌、沙门氏菌等的生长。肠道微生物菌群组成一个动态微生态平衡系统。当该系统被破坏时,外界的致病菌就会侵入体内,与体内的有益菌竞争营养成分,有益菌则通过分泌抗菌物质,增加肠黏膜分泌,优化肠道环境(韩金凤等,2017)。 李玉鹏等(2017)研究发现,在饲粮中添加丁酸梭菌可以改善断奶仔猪的肠黏膜屏障功能,显著降低大肠杆菌的数量,使益生菌成为优势菌群。许多研究表明,畜禽粪便普遍存在抗生素耐药细菌(Yang等,2014)。一方面因为粪便中残留的抗生素对微生物群落进行筛选,多数的敏感菌株被杀灭,耐药菌株大量繁殖,使细菌对某种药物的耐药率不断升高,产生耐药性;另一方面,动物在饲喂抗生素的过程中,肠道微生物在抗生素的选择压力下突变产生了耐药性(Holger等,2011)。本试验结果表明,在整个试验期,试验处理对各组均有显著影响,但到了后期,添加了抗生素组微生物有上升的趋势,与上述结论一致。添加复合益生菌,其大肠杆菌、沙门氏菌和产气荚膜梭菌的数量显著减少,其抑制致病菌的生长增殖,维护肠道生态平衡的效果更加明显,避免细菌产生耐药性,可替代抗生素的使用。丁酸梭菌在生长后期能够产生芽孢,除了可以抵抗高温外,对人工胃、肠液也具有较好的耐受能力,对大多数抗生素具有很强的耐药性(李玉鹏等,2017)。范磊等(2014)发现,在肉鸡饲粮中添加1%丁酸梭菌,可以显著减少盲肠内大肠杆菌等有害菌的数量,促进肠道内有益菌的增殖。Hossain等(2016)用丁酸梭菌等制成的复合益生菌饲喂肉鸡,结果发现,与其他处理组相比,添加复合益生菌能够显著降低大肠杆菌和梭状芽孢杆菌的数量,饲喂益生菌对致病菌的抑制效果比饲喂抗生素好。
3.3 复合益生菌对断奶仔猪血液生化指标的影响复合益生菌在动物体内无污染或残留,其不会导致耐药性,可降低饲料中的抗营养因子,增强机体免疫力(Zhou等,2015)。动物机体血液中的许多生化参数受机体内外环境的影响,通过血清生化指标的变化可以体现出动物机体营养物质的变化或者机体病理变化(Wang等,2009)。丁酸梭菌的产物丁酸可以刺激肠道黏膜免疫活性、调节肠道微生态,促进细胞因子的免疫调节作用,促进机体的免疫(张晓阳等,2012)。 Yang 等(2012)研究表明,饲粮中添加2×107cfu/kg或3×107cfu/kg丁酸梭菌可提高肉仔鸡血清中的IgM、IgG、IgA,改善肉仔鸡血清生化指标。本试验结果表明,添加丁酸梭菌复合益生菌对机体的免疫指标并无显著影响,造成差异不显著的原因可能是丁酸梭菌的添加量还不足以表现出可以改善机体血液生化指标的作用;也有可能是因为丁酸梭菌没能在猪的肠道中定植,未能充分发挥其应有的作用,另外,其他原因如益生菌的菌株、制备技术、饮食结构、自身的健康状况和饲养管理条件等也可能造成试验结果不显著。尿素(UREA)是衡量动物体内蛋白质代谢和氨基酸平衡的一个重要指标,一般而言,血清UREA含量升高说明蛋白质的沉积率下降。贾聪慧等(2016)研究表明,在肉鸡饲粮中添加丁酸梭菌,可在结肠中形成化学屏障,减少肠道有害氨和胺的产生,血氨含量显著降低。郭军蕊等(2017)研究发现,蛋鸡饲粮中添加枯草芽孢杆菌提高了蛋白质的沉积,减少了UREA在肾脏的积累,显著降低了血清UREA含量。本试验研究结果表明,在断奶仔猪的饲粮中添加适宜的复合益生菌,可以提高动物体内蛋白质的吸收利用,促进生长。
4 结论
本试验结果表明,丁酸梭菌的复合益生菌替代50%的抗生素能有效降低料肉比,减少肠道有害菌数量,但可能增加肾负担,降低蛋白质转化。另外,利用丁酸梭菌的复合益生菌100%替代抗生素,仔猪生长性能与抗生素组效果相当,而且能降低腹泻率。
[1]曹广添,刘婷婷,周琳,等.丁酸梭菌对致病菌和有益菌的体外作用效果研究[J].中国饲料,2012,4:16 ~ 19.
[2]董晓丽,张乃锋,周盟,等.复合菌制剂对断奶仔猪生长性能、粪便微生物和血清指标的影响[J].动物营养学报,2013,6:1285~1292.
[3]范磊,许国,洋徐,等.丁酸梭菌制剂对肉鸡生长、抗氧化、肠道菌群和肠道粘膜的影响[A].中国畜牧兽医学会动物微生态学分会第十一次全国学术研讨会暨第五届会员代表大会[C].中国重庆荣昌,2014.
[4]高侃,汪海峰,章文明,等.益生菌调节肠道上皮屏障功能及作用机制[J].动物营养学报,2013,9:1936 ~ 1945.
[5]桂国弘,徐娥,杨华,等.丁酸梭菌调节肠道健康的作用机制[J].饲料研究,2016,22:42 ~ 46.
[6]郭军蕊,董晓芳,佟建明.枯草芽孢杆菌CGMCC 1.921对蛋鸡生产性能、血常规指标、血清生化指标及免疫球蛋白含量的影响[J].动物营养学报,2017,29(2):465 ~ 478.
[7]韩金凤,彭豫东,贺建华,等.丁酸梭菌对家禽肠道屏障功能的影响[J].广东饲料,2017,4:28 ~ 29.
[8]华均超,张邦辉.微生态制剂对仔猪肠道微生态调控的研究与应用进展[J].中国饲料,2011,3:19 ~ 22.
[9]李玉鹏,李海花,王柳懿,等.丁酸梭菌对断奶仔猪生长性能、肠道屏障功能和血清细胞因子含量的影响 [J].动物营养学报,2017,8:2961 ~ 2968.
[10]凌欣华,李鑫.复合丁酸梭菌对仔猪腹泻影响的效果试验报告[J].广东饲料,2016,6:22 ~ 24.
[11]美国国家科学院科学研究委员会.猪营养需要[M].科学出版社,2014.
[12]肖宏德,肖运才,何熙贞,等.用益生菌制剂代替断奶仔猪日粮中抗生素的研究[J].动物医学进展,2014,3:53~58.
[13]肖雪梅,黄晶.丁酸钠、丁酸梭菌在断奶仔猪生产中的应用[J].黑龙江畜牧兽医,2013,9:70 ~ 72.
[14]谢丽静,王伟华,王海宽,等.丁酸梭菌的应用及对食品安全的影响[J].中国食物与营养,2017,7:5 ~ 9.
[15]易中华.饲用微生态制剂丁酸梭菌的研究与应用进展[J].饲料研究,2012,2:14 ~ 17.
[16]张晓阳,卢忆,马艳莉,等.丁酸梭菌生理功能及应用研究进展[J].中国食物与营养,2012,12:31 ~ 35.
[17]Hayakawa T,Masuda T,Kurosawa D,et al.Dietary administration of probiotics to sows and/or their neonates improves the reproductive performanc e,incidence of post-weaning diarrhea and histopathological parameters in the intestine of weaned piglets[J].Ani-mal Science Journal,2016,87(12):1501 ~ 1510.
[18]Holger Heuer H S K S.Antibiotic resistance gene spread due to manure application on agricultural fields[J].Current Opinion in Microbiology,2011,3(14):236 ~ 243.
[19]Hooper L V,Littman D R,Macpherson A J.Interactions Between the Microbiota and the Immune System[J].Science,2012,336(6086):1268 ~ 1273.
[20]Hossain M M,Begum M,Kim I H.Effect of Bacillus subtilis,Clostridium butyricum and Lactobacillus acidophilus endospores on growth performance,nutrient digestibility,meat quality,relative organ weight,microbial shedding and excreta noxious gas emission in broilers[J].Veterinární Medicína,2016,60(No.2):77 ~ 86.
[21]Liao X D,Ma G,Cai J,et al.Effects of Clostridium butyricum on growth performance,antioxidation,and immunefunction of broilers[J].Poult Sci,2015,94(4):662 ~ 667.
[22]Servin A L.Antagonistic activities of lactobacilli and bifidobacteria against microbial pathogens[J].FEMS Microbiology Reviews,2004,405 ~ 440.
[23]TremaroliV,Ckhed F B.Functionalinteractions between the gut microbiota and host metabolism.[J].Nature,2012,489(13),242 ~ 249.
[24]Wang J P,Yoo J S,Kim H J,et al.Nutrient digestibility,blood profiles and fecal microbiota are influenced by chitooligosaccharide supplementation of growing pigs.[J].Livestock Science,2009,125:298~303.
[25]Yang C M,Cao G T,Ferket P R,et al.Effects of probiotic,Clostridium butyricum,on growth performance,immune function,and cecal microflora in broiler chickens[J].2012,91(9):2121 ~ 2129.
[26]Yang Q X R S W N.Distribution of antibiotic-resistant bacteria in chicken manure and manure-fertilized vegetables[J].Environmental Science and Pollution Research,2014,2(21):1231 ~ 1241.
[27]Zhou X,Jin E,Li S,et al.Effects of dietary supplementation of probiotics(Bacillus subtilis,Bacillus licheniformis,and Bacillus natto)on broiler muscle development and meat quality[J].Turkishjournal of Veterinary and Animalsciences,2015,39:203 ~ 210.
