腹腔镜全胃切除术与近端胃切除术治疗近端胃癌的临床研究
2018-07-04黄建朋何志军汪启斌董荣坤甘云辉
陈 亮,黄建朋,何志军,徐 夏,汪启斌,董荣坤,张 健,王 佩,甘云辉,汪 彪,张 征,梁 俊
(1.湖北医药学院附属人民医院,湖北 十堰,442000;2.中山大学附属第七医院)
胃癌在我国恶性肿瘤中居首位,胃癌发病有明显的地域性差别,好发年龄在50岁以上[1-3]。胃癌的治疗以手术为主,手术是胃癌获得根治的唯一希望。凡临床检查无明显转移征象,估计全身营养状态、免疫功能状态能耐受手术,各重要脏器无严重器质性病变的患者均应积极手术治疗[4-5]。近年,腹腔镜不论在手术器械或手术技术方面都有了很大突破,尤其完全腹腔镜全胃切除能取得较好的近期疗效,且能达到与开腹手术相同的根治效果[6-7]。也有学者认为全胃切除术后患者的生活质量较差,倾向于放宽近端胃次全切除术的指征[8-9]。目前研究认为,全胃切除术食管空肠Roux-en-Y吻合,对于胃癌患者病情康复、降低复发率等起了至关重要的作用[10-12]。本文旨在探讨近端胃切除食管胃吻合与全胃切除术食管空肠Roux-en-Y吻合治疗近端胃癌的临床效果。现将结果报道如下。
1 资料与方法
1.1 临床资料 2014年1月至2016年1月我院胃肠外科手术治疗近端胃癌患者57例,其中26例行腹腔镜近端胃癌根治性切除、残胃食管吻合(近端组),31例行腹腔镜全胃切除、食管空肠Roux-en-Y吻合(全胃组);男32例,女25例,病程5 d~1个月,病程平均(0.31±0.11)个月;合并症:糖尿病5例,高血压3例,慢性肾功能不全7例,慢性阻塞性肺疾病5例。两组患者在性别、年龄、病程、合并症等方面差异无统计学意义(P<0.05)。见表1。
1.2 手术方法 近端组行根治性近端胃癌切除、残胃食管吻合(图1)。全胃组行根治性全胃切除、食管空肠Roux-en-Y吻合(图2)。采用气管插管全身麻醉,患者取仰卧位,五孔法施术,置入30度腹腔镜,探查病灶情况,注意腹膜、肠系膜根部及腹腔、盆腔等部位有无淋巴结转移,准确定位肿瘤。遵循肿瘤整块切除原则,经上腹部辅助小切口行胃或空肠与食管吻合。


组别例数(n)性别(n)男女年龄(岁)BMI(kg/m2)合并症(n)高血压糖尿病慢性阻塞性肺疾病慢性肾功能不全病程(月)近端组26141256.7±2.322.5±5.611230.33±0.11全胃组31181357.1±2.923.1±4.824340.29±0.12t/χ2值0.330.020.020.010.890.130.180.09P值0.490.830.830.920.180.720.630.73

图1 腹腔镜食管与残胃吻合术(近端胃)图2 腹腔镜食管与空肠吻合术(全胃)
1.3 观察指标 (1)疼痛视觉模拟评分法(visual analogue scale/score,VAS)评分:VAS疼痛评分[4]是一种简易的评价疼痛程度的方法,给患者提供一条由数字“0”至“10”的活动标尺,“0”表示无痛感,“10”表示最剧烈疼痛。(2)焦虑自评量表(self-rating anxiety scale,SAS):总分100分。分界值为50分,其中50~59分为轻度焦虑,60~69分为中度焦虑,70分及以上为重度焦虑。(3)抑郁自评量表(self-rating depression scale,SDS)计分方式等同“焦虑自评量表”,50~59分为轻度抑郁,60~69分为中度抑郁,70分及以上为重度抑郁。(4)观察两组术后并发症发生情况,主要为吻合口瘘、反流、贫血、体重减轻等。(5)随访与记录两组患者肿瘤进展率及无复发生存时间。

2 结 果
2.1 VAS疼痛评分 术前两组患者VAS疼痛评分差异无统计学意义(P>0.05);近端组术后第1天、第2天、第3天、第6天、第9天VAS疼痛评分均低于全胃组,差异有统计学意义(P<0.05)。见表2。
2.2 焦虑抑郁评分 术前两组差异无统计学意义。随访3个月,近端组患者SAS、SDS评分高于全胃组,差异有统计学意义(P<0.05)。见表3。
2.3 并发症 近端组术后反流发生率高于全胃组,贫血、体重减轻等并发症发生率低于全胃组,差异有统计学意义(P<0.05)。见表4。
2.4 肿瘤进展率及无复发生存时间 两组无复发生存时间平均为(23.5±3.3)个月与(33.0±2.1)个月;两组相比差异有统计学意义(t=4.05,P<0.05),肿瘤进展率分别为30.8%(8/26)与6.5%(2/31),两组差异有统计学意义(χ2=5.36,P<0.05)。
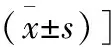

组别术前术后第1天第2天第3天第6天第9天 近端组8.5±0.53.6±0.62.5±0.31.5±0.21.5±0.21.5±0.6全胃组8.2±0.84.5±0.43.1±0.42.5±0.22.5±0.22.1±0.8t值0.122.822.562.451.992.85P值0.560.020.030.0340.040.02
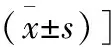
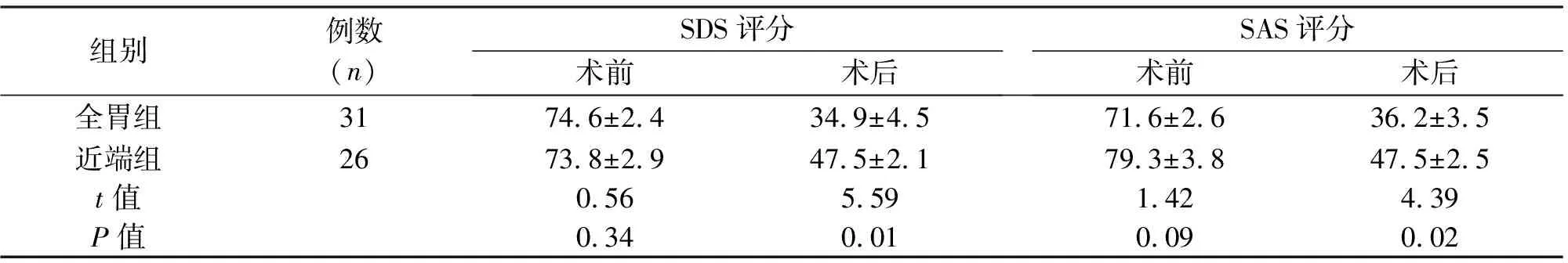
组别例数(n)SDS评分术前术后SAS评分术前术后全胃组3174.6±2.434.9±4.571.6±2.636.2±3.5近端组2673.8±2.947.5±2.179.3±3.847.5±2.5t值0.565.591.424.39P值0.340.010.090.02
表4 两组患者术后并发症发生率的比较[n(%)]

组别例数(n)吻合口瘘反流贫血体重减轻近端组263(11.5)6(23.1)1(3.8)1(3.8)全胃组314(12.9)1(3.2)6(19.4)7(22.6)χ2值0.048.016.867.42P值0.810.000.000.00
3 讨 论
胃癌是最常见的消化道恶性肿瘤,一般多见于老年男性[13]。早期胃癌多无症状或仅有轻微症状。临床症状明显时,病变已属中晚期。胃癌是人类常见的恶性肿瘤之一,其发生是一个多步骤、多因素进行性发展的过程。胃癌人群中约10%表现为家族聚集倾向[14-15]。有研究通过分析胃癌患者的家族成员状况得出,有家族史的胃癌患者发病率较普通散发胃癌患者高出4倍。家族性胃癌所表现出来的临床、病理特点与普通胃癌不同,它归类于低分化癌,多呈弥漫性分布;普通胃癌的分化程度多较高,其中以肠型胃癌更多见[16-17]。
由于胃癌病情进展迅速,保守治疗效果差,临床多采取手术治疗,而术后患者容易出现情绪不佳、消极心态,影响预后[18]。腹腔镜手术的微创优势及疗效是在保证根治的前提下实现的。全胃癌、胃窦癌侵及胃体、多发性胃癌、胃体癌、残胃癌及残胃复发癌均已成为全胃切除的绝对适应证;且近年随着医学水平的提高,胃癌术后病死率及并发症发生率已大幅下降;但家族性胃癌患者更早、更易发生淋巴转移,且容易进行多次转移。目前研究显示,与近端胃切除相比,全胃切除可有效减少术后反流性食管炎的发生,且不增加营养不良、肿瘤复发转移及死亡的发生率,是安全、有效的[16]。但在本地区的应用还不多见,尤其本地区患者以近端胃癌居多,采用全胃切除可能对患者的创伤过大,造成不可避免的损伤,导致并发症增加[19]。
传统胃癌手术方式主要包括食管与残胃直接吻合或行全胃切除、Roux-en-Y吻合术。前者操作简单,但会造成反流性食管炎,术后患者需长期半卧位睡眠及服用抗反流药物,严重影响了生活质量;后者因全胃切除术后可引起进食量减少、消化吸收不良,长期可引起营养状况下降、体重下降、贫血[20]。传统术式的各种弊端引发了临床医师对近端胃癌行有限手术切除的考虑,逐步探索采用理想的消化道重建方法,以提高患者术后生活质量。食管残胃空肠间置术是在食管残胃间增加了空肠段作连接,间置空肠能中和胆汁及胃酸,减少反流,促使残胃排空,从而减轻对食管的损害,同时保留的胃也避免了营养性并发症的发生[21]。本研究结果显示,近端胃切除组患者术后第1天、第2天、第3天、第6天、第9天VAS疼痛评分均低于全胃切除组(P<0.05);随访3个月,SAS、SDS量表结果显示,近端胃切除组患者焦虑抑郁水平显著高于全胃切除组(P<0.05);近端胃切除组贫血、体重减轻等并发症发生率显著低于全胃切除组(P<0.05);两组无复发生存时间、肿瘤进展率差异有统计学意义(P<0.05)。主要原因是全胃切除术食管空肠Roux-en-Y吻合要求系统、整块切除胃周围回流淋巴结,减少或避免了术中肿瘤播散。腹腔镜辅助也具有很好的微创性,可缓解患者的负面情绪,延长生存时间[22-27]。
综上所述,近端胃切除虽然贫血、体重减轻等并发症发生率明显低于全胃组,却较全切除具有更高的反流发生率,影响焦虑、抑郁情绪,临床工作中应根据患者情况与要求,个体化的选择手术方式。
参考文献:
[1] 张明党.护理干预对胃癌术后肺部并发症的影响[J].实用临床医药杂志,2012,16(16):17-18.
[2] Lee H,Choi Y,Jeong H,et al.Duodenal Loop Obstruction as an Unusual Cause of Acute Pancreatitis:A Case Series[J].Korean J Gastroenterol,2016,68(6):326-330.
[3] 张理宾,李彦平,涂婵.急性疼痛前列腺素与VAS疼痛评分的相关性研究[J].九江学院学报(自然科学版),2007,22(4):11-12.
[4] 叶瑞繁,耿庆山,陈剑,等.3种焦虑评定量表在综合医院门诊患者中的应用比较[J].中华行为医学与脑科学杂志,2013,22(3):271-273.
[5] Hosoda K,Yamashita K,Moriya H,et al.Laparoscopically Assisted Proximal Gastrectomy with Esophagogastrostomy Using a Novel "Open-Door" Technique:LAPG with Novel Reconstruction[J].J Gastrointest Surg,2017,21(7):1174-1180.
[6] Nanni O,Altini M,Morgagni P,et al.Process and outcome indicators for evaluation of surgical activity in a high-risk gastric cancer area[J].J Clin Oncol,2011,29(15 suppl):16537-16539.
[7] 欧阳杰,李洪,陈思远,等.两种不同手术方式在近端胃癌根治术中的应用[J].国际肿瘤学杂志,2015,42(6):422-425.
[8] 胡林,李昌荣,李红浪.不同入路的脾门区淋巴结清扫在腹腔镜胃癌根治术中的应用进展[J].中华外科杂志,2015,53(5):392-395.
[9] Ishigami H,Kaisaki S,Yamaguchi H,et al.S-1 plus intravenous and intraperitoneal paclitaxel for gastric cancer with peritoneal metastasis:A report of 100 cases[J].J Clin Oncol,2011,29(15 suppl):14670-14677.
[10] Bergeat D,Lechaux D,Ghaina A,et al.Postoperative Outcomes of Laparoscopic Bariatric Surgery in Older Obese Patients:a Matched Case-Control Study[J].Obes Surg,2017,27(6):1414-1422..
[11] 蒋志强,韩广森,张健,等.根治性全胃切除与远端次全胃切除治疗M区胃癌的预后比较[J].中国实用医刊,2016,43(1):61-63.
[12] Evangelista W,Satolli M,Napoletano R,et al.Characteristics of patients with gastric cancer who had undergone curative surgery:A 15-year monoistitutional experience[J].J Clin Oncol,2011,29(15 suppl):526-533.
[13] Kanda M,Shimizu D,Tanaka H,et al.Significance of SYT8 For the Detection, Prediction, and Treatment of Peritoneal Metastasis From Gastric Cancer[J].Ann Surg,2018,267(3):495-503.
[14] 林琳,许庆文,徐飞鹏,等.腹腔镜与开腹根治性全胃切除术并D2淋巴清扫治疗中上部进展期胃癌安全性的研究[J].中华实验外科杂志,2016,33(11):2566-2568.
[15] Endo S,Furuichi K,Morimoto K,et al.Case of Central Venous Catheter Laceration of the Pectoralis Minor Muscle[J].Gan To Kagaku Ryoho,2016,43(13):2553-2555.
[16] 唐波,曾冬竹,赵永亮,等.达芬奇机器人胃癌及结直肠癌手术647例临床研究[J].中华外科杂志,2016,54(3):177-181
[17] 姚宏伟,陈宁,连玉贵.3D 完全腹腔镜根治性全胃切除术消化道重建方式的选择[J/CD].中华普外科手术学杂志(电子版),2016,13(1):10-13.
[18] Ishigami H,Yamaguchi H,Yamashita H,et al.Surgery after intraperitoneal and systemic chemotherapy for gastric cancer with peritoneal metastasis or positive peritoneal cytology findings[J].Gastric Cancer,2017,20(Suppl 1):128-134.
[19] Zaharie F,Ciorogar G,Zaharie R,et al.Malignant familial adenomatous polyposis treated by laparoscopic colectomy and ileal pouch anal anastomosis:a case report[J].J Gastrointestin Liver Dis,2014,23(4):445-448.
[20] Booth H,Khan O,Prevost T,et al.Incidence of type 2 diabetes after bariatric surgery:population-based matched cohort study[J].Lancet Diabetes Endocrinol,2014,2(12):963-968.
[21] 林文霖,李志雄,许燕常,等.腹腔镜全胃D2根治术与开腹手术治疗胃上部癌的比较研究[J].肿瘤研究与临床,2014,26(5):332-335.
[22] 朱才秀,张锐利,姚永庭.全胃切除、改良Double Tract代胃术治疗老年胃癌的临床研究[J].浙江创伤外科,2014,8(2):284-285.
[23] Cummings KC 3rd,Patel M,Htoo PT,et al.A comparison of the effects of epidural analgesia versus traditional pain management on outcomes after gastric cancer resection:a population-based study[J].Reg Anesth Pain Med,2014,39(3):200-207.
[24] Dzenkeviciūte V,Petrulioniene Z,Sapoka V,et al.The effect of weight loss on the cardiac structure and function after laparoscopic adjustable gastric banding surgery in morbidly obese individuals[J].Obes Surg,2014,24(11):1961-1968.
[25] 罗利民,胡明.腹腔镜与开腹胃癌切除手术前后凝血和纤溶分子标志物变化的对比研究[J].中国现代医生,2014,52(13):127-129.
[26] 高建新,孟化路,夷平.腹腔镜下不同胃肠道重建方式对胃癌合并糖尿病患者术后血糖的影响[J].腹腔镜外科杂志,2017,22(8):592-595.
[27] 吴世鹏,李松岩,张红亮,等.腹腔镜辅助胃癌D2根治术后并发症及其危险因素分析[J].腹腔镜外科杂志,2017,22(5):334-339.
