同位素标记原儿茶酸-(13COOH)的合成研究
2018-07-04徐建飞刘占峰卢伟京杜晓宁
徐建飞,刘占峰,卢伟京,雷 雯,侯 捷,杜晓宁
(上海化工研究院有限公司 国家同位素工程技术研究中心 上海稳定性同位素工程技术研究中心,上海 200062)
原儿茶酸是白色至微棕色针状结晶,熔点约200 ℃(分解),溶于热水、乙醇和乙醚,微溶于冷水,不溶于苯[1]。在沸水中分解,并放出二氧化碳。水溶液遇三氯化铁呈绿色,遇碳酸氢钠呈暗红色[2]。原儿茶酸具有抗菌作用,体外试验时对绿脓杆菌、大肠杆菌、伤寒杆菌、痢疾杆菌、产碱杆菌及枯草杆菌和金黄色葡萄球菌均有不同程度的抑菌作用,亦有祛痰、平喘作用,临床用于治疗慢性气管炎[3-4]。原儿茶酸广泛地应用于医药、化工等行业,是重要的医药化工中间体,近年来国内外的化工需求量逐渐增加[5-6]。
同位素标记原儿茶酸是医药和化工领域重要示踪剂。同位素示踪技术是从体外加入与生物体内的元素或物质完全共同运行的示踪物,用以追踪生物体内某元素或某物质的运行或变化的一种方法[7]。利用稳定同位素标记技术,对药物进行同位素标记,通过同位素药物和代谢物检测,对其药理学、毒理学、药代学和临床研究提供精准示踪,为新药研发提供可靠数据,同时提高我国药物研发实力,促进人类疾病治疗和健康发展[8-9]。“精准医疗”为未来医药学指明了方向,不仅是一种定制医疗模式,还将对当代医药产业产生全方位的影响,例如个性化用药、精准药物设计、健康数据获取等。目前,稳定性同位素标记示踪剂已广泛应用于人类健康的精准医疗领域[10-11],在医学领域的临床研究、多种疾病的诊断与鉴别、病情判断、治疗效果评价、脏器功能研究和新药开发等方面取得了成功,具有很好的应用价值。
文献报道的原儿茶酸合成方法有:(1) 香兰素经碱熔溶氧化脱甲基,再经酸化制备,该工艺需要240 ℃以上高温,反应大部分时间为固相反应,难以控制,必须使用特殊的反应设备,投资大、设备利用率低,特别是难以进行同位素标记产品的制备[12];(2) 采用胡椒醛作原料,先用高锰酸钾氧化制成胡椒酸,再经三氯化铝水解制备原儿茶酸[13],此法收率较高,但同样难以引入同位素标记。参考以上路线,设计了合成路线,可为医药和化工领域研究提供重要的示踪剂。
1 实验部分
1.1 主要仪器与装置
7890B-7000C气质联用仪:美国安捷伦公司,配有EI离子源及Qualitative Analysis B.06.00色谱工作站;LC-MS 2020液质联用仪:日本岛津公司产品,配有电喷雾离子源(ESI)及LabSolutions系统工作站;Magna-IR-550型红外光谱仪:美国Nicolet产品,KBr压片制样;Bruker AV 400 MHz核磁共振:德国Bruker产品,配有超屏蔽超导磁体系统。
1.2 主要材料与试剂
13C标记13CO2:99.0%13C,美国CIL公司产品;3,4-二甲氧基溴苯:分析纯,美国Sigma-Aldrich公司产品;原儿茶酸:标准品,美国AccuStandard公司产品;其余均为市售的国产分析纯试剂,溶剂做无水处理。
1.3 合成方法
原儿茶酸-(13COOH)合成路线示于图1。称取3.1 g镁条和30 mL 2-甲基四氢呋喃混合,在N2保护下,同时滴加14.1 g的3,4-二甲氧基溴苯的2-甲基四氢呋喃溶液和12.1 g 1,2-二溴乙烷溶液,80 ℃下加热回流。升温时引发反应,30 min后反应液开始剧烈反应,回流4 h后,反应液呈微浑浊状,镁条反应完全。
将反应液冷却至-10 ℃,通入5 L13C标记13CO2气体,低温下搅拌反应2 h。反应结束后用1 mol/L H2SO4水解。用100 mL无水乙醚萃取,饱和NaCl洗,无水Na2SO4干燥过夜。旋去溶剂,得7.70 g淡黄色中间体3,4-二甲氧基苯甲酸-(13COOH),收率65.1%。ESI-MSm/z:181[M-H]-;1H NMR (CD3OD,400 MHz),δ:3.83(d,6 H,J= 7.8 Hz ,CH3),6.82 (d,1 H,J= 8.4 Hz,H-5),7.44 (dd,1 H,J= 8.4,1.6 Hz,H-6),7.45(d,1 H,J= 1.6 Hz,H-2);13C NMR(CD3OD),δ:56.83,115.3,0,116.61,121.74,122.24,144.81,150.01。
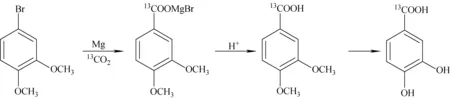
图1 原儿茶酸-(13COOH)合成路线Fig.1 Synthesis of protocatechuic acid-(13COOH)
将100 mL BBr3的二氯甲烷溶液冷却至-20 ℃,加入7.70 g 3,4-二甲氧基苯甲酸-(13COOH),保持低温,搅拌过夜。反应加入少量水进行淬灭,过滤,滤液用无水乙醚萃取3次,饱和NaCl洗,无水Na2SO4干燥过夜。旋去溶剂,得褐色粗品6.15 g。
将粗品直接用热水溶解(70~80 ℃),活性炭脱色1 h,过滤后旋去大部分水,冷却后放置于冰箱过夜析出无色固体,真空干燥后得到4.60 g原儿茶酸-(13COOH),收率70.1%。熔点200~200.8 ℃[14]。
2 结果与讨论
2.1 引发剂对3,4-二甲氧基苯甲酸收率的影响
格利雅反应常用的引发剂可以是碘甲烷、单质碘和1,2-二溴乙烷。在N2保护下,使用四氢呋喃(THF)作溶剂,考察不同引发剂对中间体3,4-二甲氧基苯甲酸收率的影响,结果列于表1。

表1 不同引发剂对3,4-二甲氧基苯甲酸收率的影响Table 1 Effect of different initiators on the yield of 3,4- dimethoxy benzoic acid
由表1 可以看出,单质碘未引发反应,造成反应失败;碘甲烷引发反应较为困难,造成3,4-二甲氧基苯甲酸的收率偏低;1,2-二溴乙烷作为引发剂时可以有较好收率。原因在于1,2-二溴乙烷和金属镁表面的氧化物反应生成溴化镁和乙烯,镁表面的氧化膜消耗完以后,新鲜的镁暴露出来,和原料3,4-二甲氧基溴苯反应生成格式试剂。所以在合成中间体3,4-二甲氧基苯甲酸中选择1,2-二溴乙烷为引发剂。
2.2 溶剂对3,4-二甲氧基苯甲酸收率的影响
不同溶剂对3,4-二甲氧基苯甲酸收率的影响列于表2。在格式反应中,一般使用绝对乙醚、无水四氢呋喃和无水甲基四氢呋喃三种溶剂,三种溶剂均使用钠丝回流至二苯甲酮显紫色。以3,4-二甲氧基溴苯为原料制备目标产物3,4-二甲氧基苯甲酸为研究对象,讨论不同溶剂对反应收率的影响。

表2 不同溶剂对3,4-二甲氧基苯甲酸收率的影响Table 2 Effect of different solvents on the yield of 3,4-dimethoxy benzoic acid
注:反应时均以回流温度反应。
格利雅反应通常选用绝对乙醚作溶剂。这是由于乙醚分子中的氧原子具有孤对电子,可以和格氏试剂形成可溶于溶剂的配合物。但是在此反应中,反应生成物因在溶剂中溶解度差而覆盖在金属镁表面,从而使格利雅反应终止。除了绝对乙醚外,四氢呋喃也是进行格利雅反应的良好溶剂,可以顺利地发生反应。当使用2-甲基四氢呋喃做溶剂时,也可以顺利发生反应,并且反应收率最高。原因在于2-甲基四氢呋喃的沸点(80 ℃)比四氢呋喃的沸点(66 ℃)高,提高反应温度可以更容易引发反应,因此提高了反应速度;另外格氏试剂在甲基四氢呋喃中的溶解度也较大,而2-甲基四氢呋喃在水中的溶解度比四氢呋喃低,因此可以更容易地将反应产物独立地包含在其中。经三种常用溶剂比较,2-甲基四氢呋喃优于另外两种溶剂。
2.3 脱甲基反应
3,4-二甲氧基苯甲酸脱甲基方法较多,尝试了如下三种方法。
(1) AlCl3法。二氯甲烷作溶剂,室温反应后能脱除甲基,但是不完全,收率偏低。
(2) HBr法。加入5~10倍量市售48%HBr进行回流反应,但是原儿茶酸在高温中会分解,造成收率偏低。
(3) BBr3法[15]。二氯甲烷作溶剂,-20 ℃下搅拌过夜,完全脱除甲基,并且避免了因为温度高而使产品分解,操作简单,收率高,其反应机理示于图2。经比较,BBr3法是3,4-二甲氧基苯甲酸脱甲氧基较优方法。
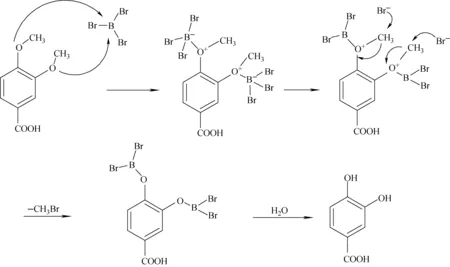
图2 BBr3脱甲基反应机理Fig.2 Mechanism of demethylation using BBr3
2.4 产物结构表征
2.4.1HPLC 以市售原儿茶酸标样为外标试剂,通过HPLC的测试分析,证明本实验合成产物原儿茶酸-(13COOH)与标样保留时间一致,外标法[16]定量分析其纯度为99.1%,结果示于图3。
2.4.2MS 取配制好的原儿茶酸-(13COOH)甲醇溶液进行LC-MS联用负离子模式分析,电喷雾离子源测定结果示于图4。
由图4可知,m/z154为[M-H]-峰。天然丰度产物分子离子峰为m/z154,经13C标记后分子离子峰为m/z155,在ESI负离子模式下减氢离子的分子离子峰为m/z154,可以确认样品相对分子质量为m/z155,同理论值。m/z154与m/z153峰强度比较,经质量簇计算方法[17]计算13C同位素丰度98.9%。
2.4.31H NMR 原儿茶酸-(13COOH):1H NMR (CDCl3,400 MHz),δ:7.08(d,1 H,J=8.4 Hz,H-5),7.35(dd,1 H,J=8.4, 1.6 Hz,H-6),7.48(d,1 H,J=1.6 Hz,H-2)。δH7.08处峰为苯环上5位的氢,峰面积为1,δH7.35处峰为苯环上1位的氢,峰面积为1,δH7.48处峰为苯环上的6位的氢,峰面积为1。羧基和羟基由于在氘代溶剂中易被氘代,故无特征峰,结果示于图5。各峰归属均符合理论值。

a——原儿茶酸;b——原儿茶酸-(13COOH)图3 原儿茶酸的HPLC图a——ST of protocatechuic acid; b——Protocatechuic acid-(13COOH)Fig.3 HPLC of protocatechuic acid
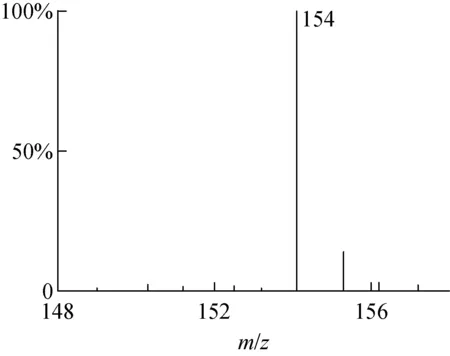
图4 原儿茶酸-(13COOH)ESI质谱图Fig.4 ESI MS of protocatechuic acid-(13COOH)

图5 原儿茶酸-(13COOH)1H NMRFig.5 1H NMR of protocatechuic acid-(13COOH)
3 结论
以3,4-二甲氧基溴苯为原料经三步反应合成原儿茶酸-(13COOH),并用HPLC、MS、1H NMR 和13C NMR对最终产物进行表征,确定了其结构、纯度和同位素丰度。该方法制备原儿茶酸-(13COOH)路线简洁、高效,得到的化合物作为重要示踪剂为医药和化工领域研究提供了基础。
参考文献:
[1] Vitaglione P, Donnarumma G, Napolitano A, et al. Protocatechuic acid is the major human metabolite of cyanidin-glucosides[J]. Journal of Nutrition, 2007, 137(9): 2 043-2 048.
[2] Xie Lianwu, Guo Junfang, Zhang Yuping. Novel molecular imprinted polymers over magnetic mesoporous silica microspheres for selective and efficient determination of protocatechuic acid in Syzygiumaromaticum[J]. Food Chemistry, 2015, 178: 18-25.
[3] 李取胜,王伟,韩秋俊,等. 原儿茶酸衍生物的合成及活性研究[J]. 中国医药杂志,2013,38(2):208-211.
Li Qusheng, Wang Wei, Han Qiujun, et al. Synthesis and characterization of protocatechuic acid derivants[J]. China Journal of Chinese Materia Medica, 2013, 38(2): 208-211(in Chinese).
[4] Dacre J C, Williams R T. The role of the tissues and gut micro-organisms in the metabolism of [14C]protocatechuic acid in the rat. Aromatic dehydroxylation[J].Journal of Pharmacy and Pharmacology, 1968, 20(8): 610-618.
[5] Liu K S, Tsao S M, Yin M C. In vitro antibacterial activity of roselle calyx and protocatechuic acid[J]. Phytotherapy Research, 2005, 19(11): 942-945.
[6] Menezes V G, Santos J M S, Macedo T J S, et al. Use of protocatechuic acid as the sole antioxidant in the base medium for in vitro culture of ovine isolated secondary follicles[J]. Reproduction in Domestic Animals, 2017, 52(5): 890-898.
[7] Wiederhold J G. Metal stable isotope signatures as tracers in environmental geochemistry[J]. Environmental Science & Technology, 2015, 49(5): 2 606-2 624.
[8] Li Chunhui, Zang Tuo, Wrobel K, et al. Quantitative urinary proteomics using stable isotope labelling by peptide dimethylation in patients with prostate cancer[J]. Analytical and Bioanalytical Chemistry, 2015, 407(12): 3 393-3 404.
[9] Khera P K, Smith E P, Lindsell C J. Use of an oral stable isotope label to confirm variation in red blood cell mean age that influences HbA1c interpretation[J]. American Journal of Hematology, 2015, 90(1): 50-55.
[10] 展鹏,王学顺,刘新泳.“精准医疗”背景下的分子靶向药物研究——精准药物设计策略浅析[J]. 化学进展,2016,28(9):1 363-1 386.
Zhan Peng, Wang Xueshun, Liu Xinyong. Contemporary molecular targeted drug in the context of “precision medicine”: an attempting discussion of “precision drug design”[J]. Progress in Chemistry, 2016, 28(9): 1 363-1 386(in Chinese).
[11] Di M G, Tremoli E. Tailoring of medical treatment: hemostasis and thrombosis towards precision medicine[J]. Haematologica, 2017, 102(3): 411-418.
[12] Wei Jinrui, Liu Kun, Du Chuanrong. A novel mannichderivative of protocatechuic acid: synthesis, crystal structure and antioxidant activity[J]. Proceedings of The National Academy of Sciences India Section A-Physical Sciences, 2017, 87(2): 181-188.
[13] 赵仁宁,计榆,张乔. 原儿茶酸的合成[J]. 辽宁化工,2001,30(11):467-471,508.
Zhao Renning, Ji Yu, Zhang Qiao. Synthesis of protocatechuic[J]. Liaoning Chemical Industry, 2001, 30(11): 467-471, 508(in Chinese).
[14] Bianco A, Bonadies F, Melchioni C. Synthesis of regioselectively protected protocatechuic acid derivatives by biomimetic transformation of quinic acid[J]. Molecules, 2000, 5(10): 1 094-1 100.
[15] Brenner E, Baldwin R M, Tamagnan G. Synthesis of a new precursor to the nicotinic receptor tracer 5-IA-85380 precursor using trimethylsilyl iodide as deblocking agent[J]. Tetrahedron Letters, 2004, 45(8): 3 607-3 610.
[16] 张琳,汪轩,邢婧,等. HPLC-DAD同时测定左归丸药液中没食子酸、原儿茶酸、绿原酸、马钱苷、阿魏酸含量[J]. 药物分析杂志,2016,36(8):1 364-1 369.
Zhang Lin, Wang Xuan, Xing Jing, et al. Simultaneous determination of gallic acid, protocatechuic acid, chlorogenic acid, loganin and ferulic acid of herb liquor of Zuogui pills by HPLC[J]. Chinese Journal of Pharmaceutical Analysis, 2016, 36(8): 1 364-1 369(in Chinese).
[17] 雷雯,杜晓宁,张维冰. 气相色谱-质谱法研究13C标记脂肪酸的同位素丰度和化学纯度[J]. 质谱学报, 2015,36(5):434-441.
Lei Wen, Du Xiaoning, Zhang Weibing. Isotope abundance and chemical purity determination of [13C]-fatty acid by GC/MS[J]. Journal of Chinese Mass Spectrometry Society, 2015, 36(5): 434-441(in Chinese).
