原儿茶酸对脂多糖诱导的人牙周膜成纤维细胞炎症反应的保护作用及机制▲
2022-04-08沈鹏鹏
马 涛 时 婧 张 蕾 沈鹏鹏
(1 新疆乌鲁木齐市口腔医院药剂科,乌鲁木齐市 830002,电子邮箱:kraa9673@163.com; 2 新疆医科大学第五附属医院老年病科,乌鲁木齐市 830011; 3 新疆医科大学基础医学院,乌鲁木齐市 830011)
牙周炎是一种由菌斑微生物感染引起的慢性炎症性疾病,随着疾病的进展,最终可导致牙周结缔组织和牙槽骨的破坏[1]。研究表明,牙周炎可能是糖尿病、动脉粥样硬化性心血管疾病、婴儿出生低体重、代谢综合征、慢性肾功能衰竭、类风湿性关节炎和神经退行性疾病的危险因素[2]。因此,探讨更有效的牙周炎治疗策略对于改善人类疾病现状具有重要意义。最近的研究表明,脂多糖可诱导人牙周膜成纤维细胞(human periodontal ligament fibroblast,HPDLF)中NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体活化,促进白细胞介素(interleukin,IL)-1β的分泌[3]。此外,NLRP3炎症小体受多种上游信号的调控,包括沉默信息调节因子1(sirtuin 1,SIRT1)的负调控和硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein,TXNIP)的正调控[4-5]。原儿茶酸是一种酚类化合物,是花青素的主要代谢物,存在于多种水果、蔬菜和易腐烂的植物,如橄榄、白葡萄和玫瑰茄。它具有多种有益的生物学效应,包括抗炎、抗氧化和抗凋亡作用[6]。已有研究表明,原儿茶酸可通过调控SIRT1/核因子κB (nuclear factor κB,NF-κB)途径抑制脂多糖诱导的小胶质细胞炎症介质的释放[7]。但原儿茶酸是否可以改善牙周炎,其相关机制如何,目前尚未清楚。本研究采用脂多糖诱导建立HPDLF炎症模型,探究原儿茶酸对炎症性HPDLF的保护作用及其机制,以期为开发治疗牙周炎的新药物提供科学依据。
1 材料与方法
1.1 试剂与材料 HPDLF购自武汉普诺赛公司;脂多糖(美国Sigma公司,批号:L2880);原儿茶酸(质量标准:高效液相色谱纯度≥98%;大连美仑生物技术有限公司,货号:MB7050);活性氧簇检测试剂盒(北京索莱宝科技有限公司,批号:100T);IL-1β和IL-18检测试剂盒(上海纪宁实业,批号:20200318);细胞计数检测(cell counting kit-8, CCK-8)试剂盒(日本同仁,批号:202);Lipofectamine 2000转染试剂(美国赛默飞世尔,批号:11668);NLRP3(武汉三鹰,批号:22006)、TXNIP(武汉三鹰,批号:66005)、激活型天冬氨酸特异性半胱氨酸蛋白酶1(cysteinyl aspartate specific proteinase 1,Caspase1;英国Abcam公司,批号:P42574)、SIRT1(武汉三鹰,批号:33002)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH;武汉三鹰,批号:33004)抗体;SYBR® Premix Ex TaqTMⅡ 试剂盒(日本TaKaRa公司,批号:DRR041A)。
1.2 实验方法
1.2.1 细胞培养:HPDLF用含10%胎牛血清的杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM;赛默飞世尔公司,批号:A4192101),于37℃、5% CO2细胞培养箱中培养。待细胞密度达到80%~90%时,用0.25%胰酶液消化细胞,进行后续实验。
1.2.2 原儿茶酸给药浓度的筛选:将对数生长期的HPDLF接种于96孔板,接种密度为5×103个/孔,于37℃、5% CO2细胞培养箱中培养12 h后,添加相应浓度原儿茶酸(0 μmol/L、1.25 μmol/L、2.50 μmol/L、5.00 μmol/L、10.00 μmol/L、20.00 μmol/L、40.00 μmol/L、80.00 μmol/L和160.00 μmol/L),继续培养24 h后,向各组细胞中加入CCK-8试剂,10 μL/孔,37℃条件下孵育3 h。采用酶标仪测定各孔在450 nm波长处的光密度(optical density,OD)值。细胞活力=给药组OD450 nm/0 μmol/L原儿茶酸组OD450 nm×100%。
1.2.3 细胞分组与干预:(1)原儿茶酸对脂多糖诱导的HPDLF炎症反应的影响。取对数生长期的HPDLF接种于96孔板,接种密度为5×103个/孔,于37℃、5% CO2培养箱中继续培养12 h后,将细胞分为空白对照组、脂多糖组、脂多糖+5.00 μmol/L原儿茶酸组和脂多糖+10.00 μmol/L原儿茶酸组。除空白对照组外,其他3组均加入脂多糖(10 μg/mL)[8]及不同浓度的原儿茶酸(0 μmol/L、5.00 μmol/L、10.00 μmol/L),在37℃、5% CO2培养箱中继续培养24 h。空白对照组加磷酸缓冲盐溶液,每组设置3个复孔。(2)敲低SIRT1后原儿茶酸对脂多糖诱导的HPDLF的影响。①取对数生长期的HPDLF按4×105个/孔接种于6孔板,于37℃、5% CO2培养箱中培养12 h后,将细胞分为空白对照组、si-NC组、si- SIRT1组,按Lipofectamine 2000转染试剂的说明书将si-NC和si- SIRT1转染至HPDLF,空白对照组只加入Lipofectamine 2000转染试剂,37℃、5%CO2条件下培养48 h后,观察转染效果,转染率达到80%后对各组细胞进行药物干预。②取对数生长期的HPDLF按4×105个/孔接种于6孔板,于37℃、5% CO2培养箱中培养12 h后,将细胞分为si-NC组、脂多糖+si-NC组、脂多糖+原儿茶酸+si-NC组、脂多糖+原儿茶酸+si-SIRT1组。按上述方法转染细胞后,除si-NC组外,其他3组均加入脂多糖(10 μg/mL),在此基础上,脂多糖+原儿茶酸+si-NC组、脂多糖+原儿茶酸+si- SIRT1组同时加入原儿茶酸(10 μmol/L)。药物处理细胞24 h后检测指标,实验重复3次。
1.2.4 CCK-8法检测细胞增殖:按1.2.3方法处理细胞24 h后,向各组细胞中加入CCK-8试剂,10 μL/孔,37℃条件下孵育3 h。采用酶标仪测定各孔在450 nm波长处的OD值。细胞活力=实验组OD450 nm/空白对照组OD450 nm×100%。
1.2.5 流式细胞术检测细胞活性氧簇水平:按1.2.3方法处理细胞后,按照活性氧簇检测试剂盒说明书,分别向各组HPDLF中加入10 μmol/L的活性氧簇荧光探针并使其完全覆盖细胞,37℃条件下孵育30 min,磷酸缓冲盐溶液洗涤细胞3次,3~5 min/次。0.25%胰酶液消化细胞,磷酸缓冲盐溶液洗涤细胞2~3次,3~5 min/次,重悬细胞,使用流式细胞仪检测细胞活性氧簇水平。
1.2.6 蛋白质印迹法检测细胞NLRP3、TXNIP、激活型Caspase1和SIRT1蛋白表达:按1.2.3方法处理细胞后,收集各组HPDLF,RIPA裂解液裂解细胞,4℃下12 000 r/min离心5 min后取上清,二喹啉甲酸法测定蛋白浓度。取30 μg蛋白上样进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白并将其转至聚偏氟乙烯膜上。10%脱脂奶粉于室温摇床上封闭2 h,加入NLRP3(1 ∶3 000)、TXNIP(1 ∶5 000)、激活型Caspase1(1 ∶1 000)、SIRT1(1 ∶3 000)和GAPDH(1 ∶5 000)抗体,4℃条件下孵育过夜,加入二抗(1 ∶5 000)室温孵育1 h后,滴加BeyoECL Star工作液到膜上,采用化学发光成像仪(厂家:美国Alpha公司;型号:FluorChem FC3)检测蛋白表达水平。以目的蛋白条带灰度值与内参蛋白条带灰度值比值为目的蛋白相对表达水平。
1.2.7 酶联免疫吸附测定法检测细胞IL-1β和IL-18含量:按1.2.3方法处理细胞后,收集各组HPDLF,1 000 r/min离心5 min,取上清液。根据酶联免疫吸附测定试剂盒说明书,检测上清液中IL-1β和IL-18的水平。
1.2.8 实时荧光定量PCR检测SIRT1 mRNA相对表达水平:按1.2.3方法处理细胞后,收集各组HPDLF,采用TRIzol法提取细胞总RNA,测定RNA浓度,按照SYBR®Premix Ex TaqTMⅡ试剂盒说明书将RNA反转录合成cDNA。以cDNA为模板,以GAPDH为内参,采用实时荧光定量PCR对cDNA进行扩增,反应条件为95℃、30 s;95℃、5 s,60℃、34 s,40个循环。SIRT1上游引物为5′-TGCTGGCCTAATAGAGTGGCA-3′, 下游引物为5′-CTCAGCGCCATGGAAAATGT-3′; GAPDH上游引物为5′-GCACCGTCAAGGCTGAGAAC-3′, 下游引物为5′-TGGTGAAGACGCCAGTGGA-3′。采用2-ΔΔCt法计算SIRT1 mRNA相对表达水平。
1.3 统计学分析 采用SPSS 21.0软件进行统计分析,计量资料以(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,以P<0.05表示差异具有统计学意义。
2 结 果
2.1 原儿茶酸对脂多糖诱导的HPDLF活力的影响 与0 μmol/L组相比,20.00 μmol/L组、40.00 μmol/L组、80.00 μmol/L组和160.00 μmol/L组细胞活力显著降低(均P<0.05),见表1。这提示剂量≥20.00 μmol/L时原儿茶酸已对细胞产生毒性,0 μmol/L、1.25 μmol/L和2.50 μmol/L组可能由于剂量过小未对细胞活力产生影响,因此,本研究选择5.00 μmol/L和10.00 μmol/L浓度原儿茶酸进行后续实验。与空白对照组相比,脂多糖+5.00μmol/L原儿茶酸组和脂多糖+10.00 μmol/L原儿茶酸组细胞活力降低(均P<0.05),但脂多糖组的细胞活力与空白对照组差异无统计学意义(P>0.05),见表2。

表1 不同原儿茶酸给药浓度下HPDLF的活力(x±s,%)

表2 原儿茶酸对脂多糖诱导的HPDLF活力的影响(x±s,%)
2.2 原儿茶酸对脂多糖诱导的HPDLF活性氧簇水平的影响 与空白对照组相比,其他3组细胞活性氧簇水平升高(均P<0.05);与脂多糖组相比,脂多糖+5.00 μmol/L原儿茶酸组和脂多糖+10.00 μmol/L原儿茶酸组细胞活性氧簇水平降低(均P<0.05)。见图1及表3。

图1 原儿茶酸对脂多糖诱导的HPDLF活性氧簇水平的影响

表3 原儿茶酸对脂多糖诱导的HPDLF活性氧簇水平的影响(x±s)
2.3 原儿茶酸对脂多糖诱导的HPDLF的TXNIP-NLRP3轴的影响 与空白对照组相比,脂多糖组细胞TXNIP、NLRP3和激活型Caspase1蛋白表达水平升高(均P<0.05);与脂多糖组相比,脂多糖+5.00 μmol/L原儿茶酸组和脂多糖+10 μmol/L原儿茶酸组细胞TXNIP和激活型Caspase1蛋白表达水平降低,且脂多糖+10 μmol/L原儿茶酸组细胞NLRP3蛋白表达水平低于脂多糖组(均P<0.05)。见图2和表4。
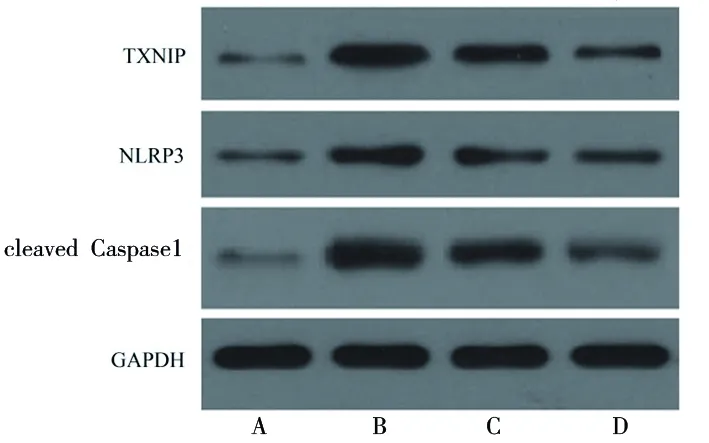
图2 各组细胞TXNIP、NLRP3和激活型Caspase1蛋白的表达情况

表4 原儿茶酸对脂多糖诱导的HPDLF中TXNIP、NLRP3和激活型Caspase1蛋白表达的影响(x±s)
2.4 原儿茶酸对脂多糖诱导的HPDLF的IL-1β和IL-18水平的影响 与空白对照组相比,脂多糖组细胞IL-1β和IL-18水平升高(均P<0.05);与脂多糖组相比,脂多糖+5.00 μmol/L原儿茶酸组和脂多糖+10.00 μmol/L原儿茶酸组细胞IL-1β和IL-18水平降低(均P<0.05)。见表5。

表5 原儿茶酸对脂多糖诱导的HPDLF的IL-1β和IL-18水平的影响(x±s,pg/mL)
2.5 原儿茶酸对脂多糖诱导的HPDLF的SIRT1表达水平的影响 与空白对照组相比,脂多糖组细胞SIRT1 mRNA和蛋白表达水平降低(均P<0.05);与脂多糖组相比,脂多糖+5.00 μmol/L原儿茶酸组和脂多糖+10.00 μmol/L原儿茶酸组细胞SIRT1 mRNA和蛋白表达水平升高(均P<0.05)。见图3和表6。
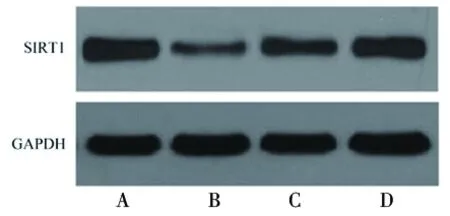
图3 各组HPDLF细胞SIRT1蛋白表达的情况

表6 原儿茶酸对脂多糖诱导的HPDLF的SIRT1表达水平的影响(x±s)
2.6 敲低SIRT1逆转原儿茶酸对脂多糖诱导的HPDLF的TXNIP-NLRP3轴的抑制作用 si-SIRT1干扰效率检测结果显示,与si-NC组相比,si-SIRT1组细胞SIRT1 mRNA和蛋白表达水平降低(均P<0.05),见图4和表7,提示采用 si-SIRT1干扰细胞成功。与si-NC组相比,脂多糖+si-NC组细胞SIRT1蛋白表达水平降低,TXNIP和NLRP3蛋白表达水平升高(均P<0.05);与脂多糖+si-NC组相比,脂多糖+原儿茶酸+si-NC组细胞SIRT1蛋白表达升高,TXNIP和NLRP3蛋白表达水平降低(均P<0.05);与脂多糖+原儿茶酸+si-NC组相比,脂多糖+原儿茶酸+si-SIRT1组细胞SIRT1蛋白表达水平降低,TXNIP和NLRP3蛋白表达水平升高(均P<0.05)。见图5和表8。

图4 si-SIRT1干扰效率检测结果

表7 si-SIRT1干扰效率检测结果(x±s)

图5 敲低SIRT1后各组细胞SIRT1、TXNIP、NLRP3蛋白表达的情况

表8 敲低SIRT1逆转原儿茶酸对TXNIP-NLRP3轴的抑制作用(x±s)
2.7 敲低SIRT1后原儿茶酸对脂多糖诱导的HPDLF活性氧簇、IL-1β和IL-18水平的影响 与si-NC组相比,脂多糖+si-NC组细胞活性氧簇、IL-1β和IL-18水平升高(均P<0.05);与脂多糖+si-NC组相比,脂多糖+原儿茶酸+si-NC组细胞活性氧簇、IL-1β和IL-18水平降低(均P<0.05);与脂多糖+原儿茶酸+si-NC组相比,脂多糖+原儿茶酸+si-SIRT1组细胞活性氧簇、IL-1β和IL-18水平升高(均P<0.05)。见图6和表9。

图6 敲低SIRT1后原儿茶酸对脂多糖诱导的HPDLF活性氧簇水平的影响

表9 敲低SIRT1后原儿茶酸对脂多糖诱导的HPDLF 活性氧簇、IL-1β和IL-18水平的影响(x±s)
3 讨 论
牙周炎是一种牙周组织(包括牙龈、牙周膜、牙槽骨和牙骨质)的炎症性疾病,最终可导致牙齿脱落[9]。牙周膜是位于下颌骨牙骨质和牙槽骨之间的一种结缔组织,其在维持牙周组织的完整性和促进组织再生中起着关键作用[10]。牙周膜成纤维细胞(periodontal ligament fibroblast,PDLF)是牙周膜中最常见的细胞,在维持组织完整性方面具有明显的功能活性。此外, PDLF还参与牙周病的免疫和炎症反应[11]。原儿茶酸因具有潜在的神经保护作用,并作为治疗神经退行性疾病的药物而受到广泛关注。研究表明,原儿茶酸可减少阿尔茨海默病、帕金森病、脑缺血和创伤性脑损伤等神经退行性疾病动物模型中的神经毒性和神经元细胞死亡[12]。而关于原儿茶酸在牙周炎中的作用还尚未可知,本研究旨在探究原儿茶酸在牙周炎中的作用及其机制。
牙龈卟啉单胞菌是最常见的牙周病原菌。牙龈卟啉单胞菌脂多糖通过激活NF-κB途径,促进炎症介质的释放,引起牙周膜炎症反应[13]。众所周知,炎性小体作为细胞内的传感器,对各种病原体相关和损伤相关的分子模式起着重要的作用[14]。已有研究表明,NLRP3炎性小体及其下游因子IL-1β和IL-18在牙周病进展中发挥重要作用[15]。本研究结果显示,与空白对照组相比,脂多糖组细胞NLRP3蛋白表达水平IL-1β和IL-18水平升高(均P<0.05),提示脂多糖可诱导HPDLF中NLRP3炎性小体活化,并促进IL-1β和IL-18的释放;与脂多糖组相比,脂多糖+5.00 μmol/L原儿茶酸组和脂多糖+10.00 μmol/L原儿茶酸组细胞IL-1β和IL-18水平降低(均P<0.05),脂多糖+10.00 μmol/L原儿茶酸组细胞NLRP3蛋白表达水平低于脂多糖组(均P<0.05),提示采用原儿茶酸处理可抑制脂多糖诱导的HPDLF的NLRP3炎性小体活化,抑制IL-1β和IL-18的产生。
研究表明,活性氧簇作用于NLRP3炎症小体上游相关因子,引起炎性小体的活化,高浓度葡萄糖和脂多糖以活性氧簇敏感的方式促进肾小球系膜细胞中TXNIP和NLRP3的表达,从而促进炎症的发生[16]。另有研究表明,抑制活性氧簇/TXNIP/NLRP3炎症信号,可逆转高血糖对视网膜Müller细胞增殖和促血管生成因子生成的促进作用[17]。由此可见,活性氧簇/TXNIP/NLRP3炎症信号在不同疾病中均发挥着重要的作用。本研究结果显示,与空白对照组相比,脂多糖组细胞活性氧簇水平、TXNIP蛋白表达水平升高(均P<0.05),提示脂多糖可促进HPDLF中活性氧簇的产生和TXNIP的表达,而与脂多糖组相比,脂多糖+5.00 μmol/L原儿茶酸组和脂多糖+10.00 μmol/L原儿茶酸组细胞活性氧簇水平、TXNIP蛋白表达水平降低(均P<0.05),提示原儿茶酸可抑制脂多糖诱导的HPDLF活性氧簇的产生和TXNIP的表达,其可能通过抑制活性氧簇的产生,从而抑制TXNIP-NLRP3轴介导的炎症反应。
SIRT1在抑制细胞炎症中起重要作用。研究表明,SIRT1过表达可抑制脂多糖和腺嘌呤核苷三磷酸联合诱导人脐静脉血管内皮细胞中NLRP3炎性小体的活化以及激活型Caspase1的表达和IL-1β的分泌,而敲除SIRT1则促进NLRP3的活化[18]。另有研究表明,敲低SIRT1可逆转粉防己碱抑制NLRP3炎性小体活化,以及IL-1β和IL-18表达的作用,减弱粉防己碱对脑缺血再灌注小鼠的保护作用[19]。此外,姜黄素可通过上调SIRT1的表达,抑制活性氧簇和肿瘤坏死因子α的产生,以剂量依赖的方式减轻失血性休克和输血复苏所致的肺屏障功能损害[20]。以上研究表明,SIRT1通过抑制活性氧簇的产生和NLRP3炎性小体的活化,在不同疾病中发挥保护作用。本研究结果显示,与空白对照组相比,脂多糖组细胞SIRT1 mRNA和蛋白表达水平降低(均P<0.05);与脂多糖组相比,脂多糖+5.00 μmol/L原儿茶酸组和脂多糖+10.00 μmol/L原儿茶酸组细胞SIRT1 mRNA和蛋白表达水平升高(均P<0.05)。这提示脂多糖可抑制HPDLF中SIRT1的表达,而原儿茶酸可逆转该作用。此外,本研究还发现,与脂多糖+原儿茶酸+si-NC组相比,脂多糖+原儿茶酸+si-SIRT1组细胞活性氧簇IL-1β和IL-18水平升高(均P<0.05),提示敲低SIRT1后,原儿茶酸逆转脂多糖诱导HPDLF炎症反应的作用减弱,提示SIRT1可能参与原儿茶酸对HPDLF炎症反应的保护作用。
综上所述,原儿茶酸可能通过上调SIRT1的表达,抑制脂多糖诱导的HPDLF中TXNIP-NLRP3轴的活化,减轻细胞炎症反应。这为明确原儿茶酸在牙周炎中的作用机制及开发治疗牙周炎的新药物提供新的依据。
