脂氧素A4抑制5-LOX合成对脑缺血再灌注损伤具有神经保护作用
2018-07-04刘晓敏
陈 良, 余 锋, 刘晓敏
脑血管病包括缺血性和出血性脑血管病,其中缺血性脑血管病占80%~85%,缺血性脑血管病以血栓或栓塞引起血管闭塞为特征,大脑中动脉是最常见的梗死发生部位[1]。脑卒中后,炎症损伤已被公认是主要的损伤机制,闭塞后的再灌注通过增加氧自由基的产生,进一步加剧了神经元的损伤[2]。
白三烯(LTs)是5-脂氧合酶(5-LOX)作用于花生四烯酸(AA)的代谢物,是公认的强效促炎物质[3]。脂氧素(LXs)是内源性“炎症制动信号”家族中的一员,在炎症中与白三烯作用相反。脂氧素A4(LXA4)作为最重要的脂氧素之一,与其耦联的G蛋白称为脂氧素A4受体(ALXR)。Boc2是ALXR的特异性拮抗剂。侧脑室注射LXA4后通过局部过氧化物酶体增殖物激活受体γ(PPARγ)介导的脑缺血损伤调节作用机制,目前仍不是很清楚[4]。
已证明抑制星形胶质细胞的炎症反应可减小脑梗死体积[5],但很少有研究探讨LXA4在神经保护作用中的机制,因此我们模拟了脑缺血/再灌注的大鼠模型(MCAO/R)来阐明LXA4对神经的保护机制。
1 材料与方法
1.1 动物与模型 SPF级10~12 w龄雄性Wistar,体重250~300 g,由北京维通利华实验动物技术有限公司提供。MCAO建模:水合氯醛(350 mg/kg)腹腔注射麻醉后,解剖右侧颈总动脉、颈内动脉和颈外动脉,颈总动脉近心端血管夹夹闭短暂阻断血流,将0.28 mm的MCAO专用线栓通过颈外动脉远端插至颈内外动脉分叉处,线栓到达大脑中动脉起始段为止,丝线打结固定线栓,2 h后抽回线栓以恢复灌注。假手术组以相同的手术方式操作但不阻断血流。所有手术操作均在无菌条件下完成,操作前肌注青霉素8万单位预防感染。整个过程中体温维持仪监测和保持体温在37 ℃,激光多普勒血流仪(Periflux System 5000)在造模前后监测局部脑血流量。排除标准:局部脑血流量减少未达70%以上,在实验过程中死亡和在脑组织提取过程中发现有蛛网膜下腔出血的动物。
随机法将动物分为4组,每组10只,其中5只用于TTC染色,5只用于WB和ELISA检测。(1)对照组:假手术大鼠侧脑室注射5 μl生理盐水;(2)MCAO/R组:建模后侧脑室注射5 μl生理盐水;(3)LXA4组:建模后侧脑室注射5 μl LXA4(0.2 mmol/L);(4)LXA4+Boc2组:建模后侧脑室注射4 μl LXA4(0.25 mmol/L)和1 μl Boc2(10 mmol/L)。
1.2 方 法
1.2.1 神经功能评估 MCAO/R 24 h后,神经功能评分。0分:没有神经缺陷;1分:未能充分张开对侧前爪;2分:拖尾时对侧前肢抓地力下降;3分:自动盘旋或向健侧行走;4分:没有自发的运动活动;5分:对刺激没有任何反应。
1.2.2 脑含水量测定 使用湿/干方法测定同侧(假手术组)或缺血半球的含水量。新鲜大脑半球称重后置于100 ℃烘箱中烘烤24 h,称得干重。脑含水量=(湿重-干重)/湿重×100%。
1.2.3 脑梗死体积百分比 制备2 mm脑片,脑片于2%的TTC染液中37 ℃避光30 min。染色后拍照,应用Photoshop CS 5.0软件进行分析。所有脑片的梗死面积之和即为总梗死面积,乘以脑片的厚度即是梗死体积。为了排除脑水肿的影响,计算如下:校正的梗死体积=健侧半球体积-(患侧半球体积-患侧半球梗死体积),水肿校正后梗死体积百分比(%)=(校正的梗死体积/健侧半球体积)×100%。
1.2.4 Western blot RIPA法提取脑总蛋白,BCA法测定蛋白浓度:40 μg蛋白样品在12%SDS聚丙烯酰胺凝胶(PAGE)电泳分离,转膜,5%脱脂奶粉封闭,杂交一抗5-LOX (1∶200);ERK和磷酸化ERK1/2(1∶500);p38和磷酸化p38(1∶500);JNK和磷酸化JNK (1∶500),4 ℃孵育过夜,过夜的纤维素膜彻底漂洗后,加入辣根过氧化物酶标记的二抗(1∶5000)在37 ℃孵育1 h。洗膜后电化学发光液(ECL)曝光显影,Image J软件分析目标条带的光密度值。
1.2.5 ELISA 额顶叶大脑皮质组织,按照组织(mg):PBS(μl)=1∶10的比例充分匀浆组织至无肉眼可见的组织块,4 ℃,3000 rpm离心20 min,取上清作为待测样品。根据大鼠ELISA试剂盒说明书检测大脑皮质中花生四烯酸代谢产物白三烯LTB4和LTC4的浓度。
2 结 果
2.1 LXA4对神经功能、脑含水量、梗死体积百分比的影响 神经功能评分:假手术组没有任何缺损,实验组评分为(2.83±0.41)。LXA4组的评分显著降低,Boc2拮抗了LXA4的抑制作用(P<0.05)(见图1A)。与假手术组相比,MCAO/R组缺血半球脑含水量显著增加(P<0.05)。LXA4显著降低了脑含水量(P<0.05),且可被Boc2阻断(P<0.05)(见图1B)。MCAO/R组脑缺血明显,梗死体积百分比高达(76.4±2.84),LXA4明显降低了梗死体积百分比(P<0.05)。LXA4 +Boc2组中梗死体积百分比相对于LXA4组显著升高(P<0.05),但仍低于MCAO/R组(P<0.05)(见图1C、D)。
2.2 LXA4对5-LOX的影响 MCAO/R模型中5-LOX表达水平显著增加(P<0.05),其表达可被LXA4抑制(P<0.05)。而且Boc2部分拮抗了LXA4的抑制作用(P<0.05)(见图2A、B)。同时,我们还检测了LTB4和LTC4的表达水平(P<0.05)(见图2C、D)。
2.3 ERK信号通路 ERK激活体ERK1/2的磷酸化水平在MCAO/R模型显著增加。LXA4明显抑制了ERK1/2的磷酸化水平(P<0.05),Boc2拮抗了LXA4的抑制作用(P<0.05)(见图3A)。然而JNK和p38的磷酸化水平改变,无统计学意义(图3B、C)。

与假手术组相比*P<0.05;与MCAO组相比#P<0.05;与LXA4组&P<0.05
图1 LXA4对神经功能、脑含水量、脑梗死体积百分比的影响

与假手术组相比*P<0.05;与MCAO组相比#P<0.05;与LXA4组相比&P<0.05
图2 LXA4对5-LOX及其产物LTB4、LTC4的影响
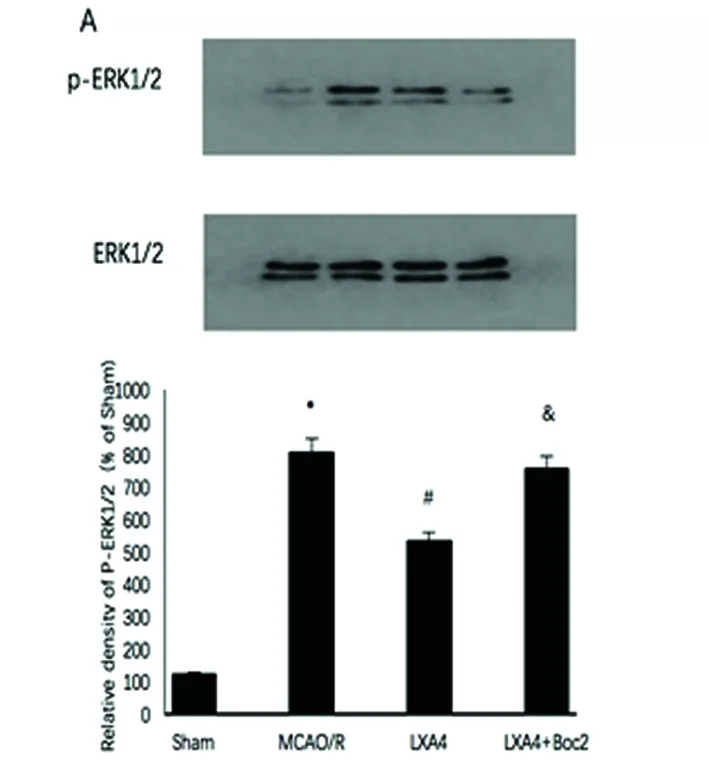


与假手术组相比*P<0.05;与MCAO组相比#P<0.05;与LXA4组相比&P<0.05
图3 LXA4对ERK 信号途径的影响
3 讨 论
急性脑缺血和随后的再灌注引起炎症级联反应是脑缺血后损伤的关键因素,机制包括细胞内钙超载、ROS、蛋白水解酶系统的过度活化和促炎细胞因子的释放[6]。因此,炎症成为卒中治疗的潜在靶点。5-LOX受各种刺激后,易位至核膜,与蛋白FLAP结合成为复合物,该复合物再将AA转换为LTs[7]。动物和临床研究均显示5-LOX和LT参与了脑缺血再灌注损伤,抑制5-LOX后表现出显著的神经保护作用[8,9]。Ciceri等[10]的研究显示MK-886(LTs生物合成抑制剂)降低了LTs的表达并减小了大鼠脑梗死体积。但是,Kitagawa等[11]的研究显示5-LOX基因缺陷小鼠在局灶性脑缺血期间并没有起到保护作用。该研究中,MCA闭塞后第一天做神经功能评分,但却在MCA闭塞后的第7天测量梗死体积,两参数不在同一时间点,所以该实验的设计存在缺陷。因为在MCA闭塞后几天内,由于梗死引发的炎症反应导致了梗死体积的扩大[12],可能掩盖了5-LOX的保护作用。5-LOX的保护作用可能只有在病理条件下才变得明显,而且生理活动要求酶具有基础的活性,酶的完全失活是有害的,因此采用基因敲除动物进行实验,结果可能不够具有代表性[13]。
最近,LXs这一来源于5-LOX的脂质介质也引起了关注。与LXs相关的疾病包括哮喘、内毒素诱导的葡萄膜炎、肾炎、囊性纤维化和各种感染[14]。LXA4的性质包括减少ROS的产生、对钙通道的影响和减轻急性肺损伤等。Sobrado等[15]首次观察到外源性LXA4介导PPARγ来保护脑组织免受缺血再灌注损伤,同时作者还发现PPARγ激动剂可以调节5-LOX和LTs的产生,这可能至少部分地解释了LXA4的神经保护作用。
我们进一步研究LXA4在卒中治疗中的潜在作用以及5-LOX/LTs在这种情况下的作用。尽管先前报道LXA4的神经保护作用是由PPARγ介导的,但LXA4的生物学效应主要是通过ALXR介导的。我们将Boc2与LXA4同时给药,发现LXA4对脑梗死、脑水肿和神经功能缺损的保护作用只是部分通过ALXR介导的,表明LXA4可能是炎症模型中LTs的负反馈调节因子[16]。因为它的作用并未被Boc2完全阻断,显然还有其他受体参与,例如PPARγ[15]。
我们的研究结果显示脑缺血再灌注诱导ERK磷酸化、5-LOX激活和LTs合成,表明ERK 1/2在缺血再灌注后的脑损伤中发挥着重要作用。但是p38和JNK的磷酸化水平无统计学意义,可能与动物种类、实验模型、取材位置和研究时间点有关。
综上所述,我们的研究表明,LXA4可以阻止5-LOX的激活,减少脑缺血再灌注模型诱导的LTs的产生,并且该通路是LXA4在脑缺血再灌注损伤中的神经保护作用的基础;LXA4能抑制强效促炎介质LTs的产生,LXA4的神经保护作用可能是通过调节炎症反应实现的,近期曹翔等人[17]的研究表明,LX007可以调节LPS诱导的小胶质细胞内ROS水平,再次证明抗炎应成为脑卒中的治疗靶点。
[参考文献]
[1] Jordan J,Segura T,Brea D,et al.Inflammation as therapeutic objective in stroke [J].Current Pharmaceutical Design,2008,14(33):3549-3564.
[2]Danton GH,Dietrich WD.Inflammatory mechanisms after ischemia and stroke [J].Journal of Neuropathology and Experimental Neurology,2003,62(2):127-136.
[3]刘 云,高晓莹,戚思华.缺血后处理脑保护作用的研究进展[J].中国脑血管病杂志,2015,12(3):160-164.
[4]Jeong S,Kim S J,Jeong C,et al.Neuroprotective effects of remifentanil against transient focal cerebral ischemia in rats[J].Journal of Neurosurgical Anesthesiology,2012,24(1):51-57.
[5]Tomimoto H,Shibata M,Ihara M,et al.A comparative study on the expression of cyclooxygenase and 5-lipoxygenase during cerebral ischemia in humans[J].Acta Neuropathologica,2002,104(6):601-607.
[6]戚 游,王 玉.血浆HGF、TNF-α、IL-10的差异与青年脑梗死患者预后的相关性的研究[J].中风与神经疾病杂志,2017,34(12):1100-1103.
[7]Zhou Y,Wei EQ,Fang SH,et al.Spatio-temporal properties of 5-lipoxygenase expression and activation in the brain after focal cerebral ischemia in rats[J].Life Sciences,2006,79(17):1645-1656.
[8]Serhan CN.Lipoxins and aspirin-triggered 15-epi-lipoxin biosynthesis: an update and role in anti-inflammation and pro-resolution[J].Prostaglandins & Other Lipid Mediators,2002,68(9):433-455.
[9]Serhan CN.Resolution phase of inflammation:Novel endogenous anti-inflammatory and proresolving lipid mediators and pathways[M].Annual Review of Immunology,2007.101-137.
[10]Ciceri P,Rabuffetti M,Monopoli A,et al.Production of leukotrienes in a model of focal cerebral ischaemia in the rat [J].British Journal of Pharmacology,2001,133(8):1323-1329.
[11]Kitagawa K,Matsumoto M,Hori M.Cerebral ischemia in 5-lipoxygenase knockout mice[J].Brain Research,2004,1004(1/2):198-202.
[12]金 凤,张哲峰,谢永红.缺血性脑卒中危险因素的研究进展[J].中风与神经疾病杂志,2017,9:764-765.
[13]Shohami E,Ginis I,Hallenbeck JM.Dual role of tumor necrosis factor alpha in brain injury[J].Cytokine & Growth Factor Reviews,1999,10(2):119-130.
[14]Feuerstein GZ,Wang XK,Barone FC.The role of cytokines in the neuropathology of stroke and neurotrauma[J].Neuroimmunomodulation,1998,5(3/4):143-159.
[15]Sobrado M,Pereira MP,Ballesteros I,et al.Synthesis of lipoxin A(4) by 5-lipoxygenase mediates PPAR gamma-dependent,neuroprotective effects of rosiglitazone in experimental stroke[J].Journal of Neuroscience,2009,29(12):3875-3584.
[16]Matsui T,Mori T,Tateishi N,et al.Astrocytic activation and delayed infarct expansion after permanent focal ischemia in rats.Part I:Enhanced astrocytic synthesis of S-100 beta in the periinfarct area precedes delayed infarct expansion[J].Journal of Cerebral Blood Flow and Metabolism,2002,22(6):711-722.
[17]曹 翔,金岳心子,李 飞,等.LX007减少脂多糖介导的小胶质细胞内活性氧生成的机制研究[J].中风与神经疾病杂志,2018,35(1):10-13.
