人参皂苷Re对防龋疫苗rPAc免疫效应的影响
2018-07-04李午丽
金 洁,孙 成,李午丽
龋病是人类最常见的细菌感染性疾病之一。变异链球菌(S.mutans)是龋病的主要致病菌,其表面蛋白抗原PAc是主要的毒力因子,参与介导细菌对牙面的粘附,抗PAc特异性抗体能有效抑制S.mutans的致龋能力。研究[1]显示,用PAc分子中特定核酸序列制备的防龋亚单位疫苗rPAc经黏膜途径免疫机体可以诱导机体产生特异性抗PAc抗体,从而达到防龋效果,但是rPAc的免疫效能还有待于提高,需要与佐剂联合应用以增强免疫效果。目前常用的佐剂如霍乱毒素B亚单位[2]、脂质体或AddaVax[3-4]。由于这些佐剂存在具有一定的毒副作用、制备过程繁琐或黏膜佐剂活性低等缺点,阻碍rPAc安全方便的应用。人参皂苷Re,是人参中含量较多的活性成分之一。近年来研究[5]显示Re具有免疫调节功能,能够有效地提高抗原的免疫原性,从而增强机体的细胞和体液免疫应答,具有佐剂功能,已被用于多种疫苗研究。目前,尚未见Re应用于防龋疫苗研究的报道。该实验研究拟在鼻腔滴注免疫途径下,rPAc与Re联合免疫实验动物,检测免疫后动物血清和唾液中特异性抗体水平及细胞因子表达的变化,观察其对龋齿发生发展的影响,探讨Re作为rPAc佐剂的可行性。
1 材料与方法
1.1主要试剂和仪器Ni-NTA金属鳌合亲和层析柱(德国Qiagen公司);白细胞介素4(interluekin-4,IL-4)和γ干扰素(interferon-γ,IFN-γ)检测试剂盒(美国BD公司);辣根过氧化物酶标记的羊抗小鼠IgG/IgG2a/IgG1、辣根过氧化物酶标记的羊抗小鼠IgA、未标记羊抗小鼠IgG、未标记羊抗小鼠IgA、小鼠标准血清(美国Bethyl公司);人参皂苷Re(纯度>98%,上海士锋生物科技有限公司);Detoxi-GelTM 内毒素去除胶[赛默飞世尔科技(上海有限公司)];LAL内毒素定量检测试剂盒(金斯瑞生物科技有限公司);酶标仪(美国Biotek公司)等。
1.2实验动物SPF级8周龄雌性BALB/c小鼠40只,13~20 g;24只出生后19 d断乳的Wistar雌鼠,均购自上海斯莱克实验动物有限责任公司。实验遵循国际通用的实验用动物饲养管理和使用指南。
1.3rPAc疫苗和Re的制备rPAc疫苗制备和提取纯化具体实验步骤参考前期文献[6-7]报道。用Detoxi-GelTM内毒素去除胶从纯化蛋白中去除残留内毒素,生理盐水稀释蛋白浓度为1 g/L,备用。人参皂苷Re用无菌生理盐水配制成1 g/ L溶液,经0.22 μm滤膜过滤除菌备用。用LAL内毒素定量检测试剂盒检测以上溶液内毒素残留量,用于免疫的rPAc和Re内毒素水平<0.01 EU/μg。
1.4实验分组及免疫方案8周龄BALB/c雌鼠40只随机分为4组,每组10只。从每组动物中随机选出5只,用于0~16周抗体动力学试验。对每组动物中另外5只,在第10周,即末次免疫后8周处死,取脾,进行脾细胞刺激试验。分组、免疫物及剂量如下:rPAc组(rPAc,50 μg/只),rPAc+Re组(rPAc和Re,10 μg rPAc+40 μg Re/只),Re组(Re,50 μg/只),NS(生理盐水,50 μg/只)。在未麻醉情况下经鼻腔滴注,使小鼠以自由吸入方式摄取免疫物。2周后同样剂量加强免疫1次。
1.5样本收集和抗体检测初次免疫前(0周)、初次免疫后2、4、6、8、10、12、16周收集血清和唾液样本,处理后-70 ℃保存待测。10 μg/ml的纯化抗原PAc标准品包被96孔酶标板,每孔100 μl,4 ℃过夜。洗涤,3%牛血清白蛋白封闭。将待测血清和唾液样本分别按1 ∶100和1 ∶4稀释,每孔加样100 μl。另设标准曲线,5 μg/ml纯化抗小鼠IgG或IgA包被,正常小鼠参考血清倍比稀释,每孔加样100 μl。待测血清中分别加入100 μl辣根酶标记的羊抗小鼠IgG、IgG1和IgG2a(稀释比例1 ∶4 000),唾液样本中加入羊抗小鼠IgA(稀释比例1 ∶1 000),37 ℃温育2 h,加入OPD-枸橼酸磷酸盐缓冲液显色,自动酶联检测仪测定 (490 nm)血清孔和唾液孔的吸光度值。根据四参数法通过标准曲线计算得出血清样本中特异性抗体的含量,唾液样本则计算抗PAc IgA抗体占唾液中总IgA的比值,以使得样本中Ig的含量变化标准化[8]。
1.6脾淋巴细胞上清液细胞因子IFN-γ、IL-4检测在小鼠末次免疫8周后处死,分离脾淋巴细胞。脾淋巴细胞分离后,制成单细胞悬液。调整脾细胞悬液浓度为2×106细胞/ml,每份标本设3孔,加至12孔板(1 ml/孔),然后加入重组rPAc蛋白(2.5 μg/ml),在37 ℃、5% CO2的培养箱培养48 h后,2 000 r/min离心20 min,收集上清液。以ELISA定量试剂盒分别检测上清液中的IFN -γ和IL-4的水平,测定方法按试剂盒使用说明进行。
1.7大鼠龋齿保护效能实验24只出生后19 d龄断乳的Wistar雌鼠随机分为4组,每组6只。断乳后即给予致龋饲料2000#。20 d龄给予含氯霉素、氨苄青霉素和羧苄青霉素(用量为1 g/kg饲料)的致龋饲料,连续喂养3 d。24~26 d龄于牙面连续接种细菌浓度为1×109cfu/ml的变形链球菌Ingbritt。接种细菌前后以棉拭子采集口腔及磨牙牙合面的细菌标本,检测口腔致龋菌感染的情况。第28天龄开始分组免疫,分组、免疫方案及免疫途径同1.4 BALB/c雌鼠分组和免疫方案。鼠龄70 d时,处死大鼠,断颅,分离上下颌骨,紫脲酸胺染色后,金刚砂片沿上、下颌磨牙牙合面近远中向矢状片切。根据 Keyes经典龋齿评分标准[9]在体式显微镜下分别记录每只鼠釉质龋 (enamel caries,E)、牙本质浅龋 (dentin superficial caries,Ds)和牙本质中龋 (dental middle caries,Dm)的情况并进行评分。

2 结果
2.1小鼠唾液特异性IgA和血清特异性IgG抗体水平Re+rPAc组在免疫后第2周唾液特异性抗PAc IgA和血清特异性抗PAc IgG均开始升高,在第8周达到最高水平(0.91±0.04vs11.41±1.16),第8周以后唾液特异性抗PAc IgA和IgG抗体水平都开始下降,但仍维持较高的抗体水平持续到第16周(0.79±0.043vs9.81±1.13)。同时Re+rPAc组在第4、6、8、10、12、16周的唾液特异性抗PAc IgA和血清特异性抗PAcIgG水平均显著高于rPAc组(P<0.01)。rPAc组在第2周唾液特异性抗PAc IgA和血清特异性抗PAcIgG开始升高,第8周达到最高水平(0.52±0.05vs5.8±0.89),第8周以后特异性IgA和IgG抗体水平都迅速下降。rPAc组免疫后第6、8、10、12周的唾液抗PAc IgA和IgG水平显著高于Re组(P<0.05)及NS组(P<0.05)。Re组和NS组在各时间点均未检测出特异性抗体。在其余检测时间点上,各组间差异均无统计学意义。见图1。
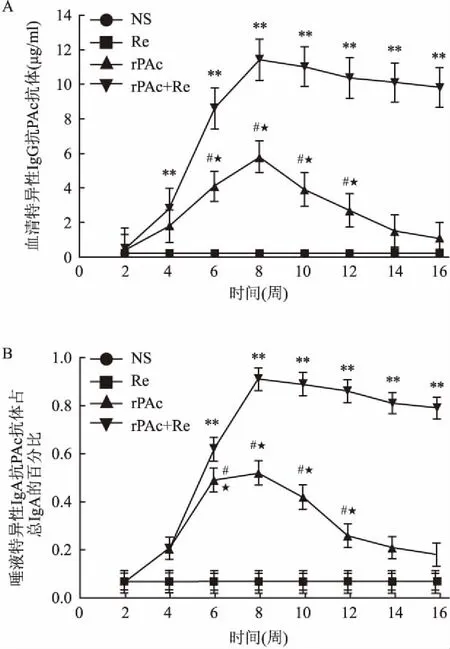
图1 免疫小鼠体内特异性抗体水平
A:血清特异性抗PAc抗体水平;B:唾液特异性抗PAc IgA;与rPAc组比较:**P<0.01;与Re组比较:#P<0.05;与NS组比较:★P<0.05
2.2小鼠血清特异性IgG抗体亚型分析与Re组或NS组相比,rPAc组的IgG1明显增高(P<0.05),但IgG2a并无显著变化(P>0.05)。与rPAc组、Re组和NS组相比,Re+rPAc组IgG1和IgG2a均明显增高(F=8.95、6.15,P<0.05)。
rPAc组和Re+rPAc组免疫前(第0周)血清特异性IgG1/IgG2a比值较低,Re+rPAc组的血清特异性IgG1/IgG2a比值自免疫后第2周即迅速升高,在第4周时即达2.1,并一直维持在较高水平。Re+rPAc组在第2、4、6、8、10、12周的血清特异性IgG1/IgG2a比值(分别为1.9、2.1、3.7、4.2、4.6、3.9)均显著高于rPAc组(分别为0.9、1.05、1.6、1.7、0.9、0.8)(P<0.05)。rPAc组血清特异性IgG1/IgG2a比值自第2周起逐渐升高,第8周后开始下降。rPAc组在第4、6、8周的血清特异性IgG1/IgG2a比值显著高于Re组(P<0.05)和NS组(P<0.05)。Re促进机体Th2型免疫反应。见图2。
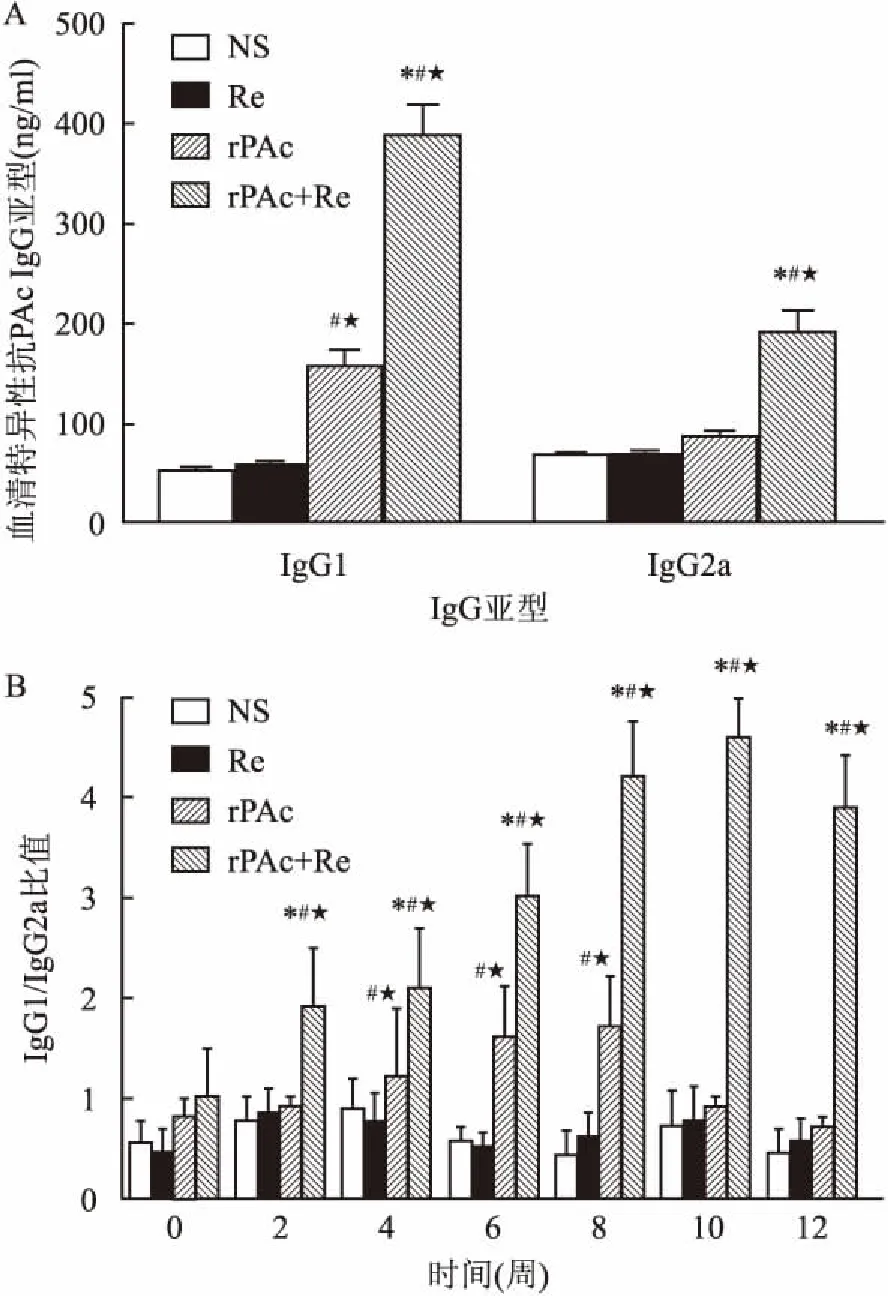
图2 免疫小鼠血清特异性抗PAc IgG亚型水平
A:血清特异性抗PAc IgG1和IgG2a抗体水平;B:免疫小鼠血清中IgG1/IgG2a的浓度比值;与rPAc组比较:*P<0.05;与Re组比较:#P<0.05;与NS组比较:★P<0.05
2.3小鼠脾细胞上清液中细胞因子的分泌水平经PAc蛋白刺激48 h后,相对于Re组或NS组,Re+rPAc组提高了脾淋巴细胞上清液中IL-4和IFN-γ的浓度(P<0.05),rPAc组仅提高了脾淋巴细胞上清液中IL-4的浓度(P<0.05)。Re+rPAc组的脾淋巴细胞上清液中细胞因子IFN-γ和IL-4的水平均显著高于rPAc组(P<0.05)。以IL-4/IFN-γ比值进一步分析, Re+rPAc组为3.0,显示Th2型细胞因子优势表达,而rPAc蛋白免疫组为1.2,Th2型优势效应不如Re+rPAc组。这与IgG亚型的分析结果一致。见图3。
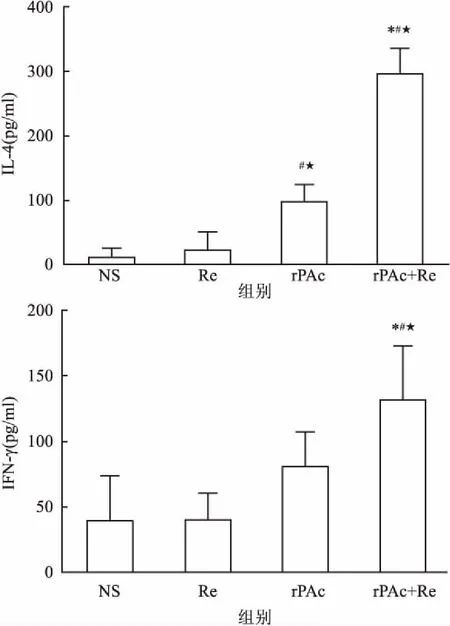
图3 各组小鼠脾淋巴细胞分泌细胞因子IL-4和IFN-γ水平
A:IL-4;B:IFN-γ;与rPAc组比较:*P<0.05;与Re组比较:#P<0.05;与NS组比较:★P<0.05
2.4定菌鼠模型的检测大鼠口腔广谱抗生素灭菌后,BHI培养基上均可见大量乳白色圆形菌落,表面光滑,有浓厚的酵母气味,为典型的酵母菌菌落(致龋饲料中含酵母粉)。MSB培养基上均无微生物生长。口腔接种变形链球菌Ingbritt后,MSB培养基上均可见大量灰蓝色菌落,表面粗糙,边缘不整齐,高凸、嵌于琼脂内,为典型的变形链球菌菌落。
2.5龋齿记分Re+rPAc组的E、Ds、Dm记分均显著低于Re组(均P<0.05)和NS组(均P<0.05),rPAc组的E、Ds、Dm记分均显著低于Re组(P<0.05)和NS组(P<0.05),进一步比较显示Re+rPAc组的E、Ds和Ds记分最低,与rPAc比较差异有统计学意义(P<0.05)。同时Re+rPAc组的总龋齿记分均数(E+Ds+Dm)为11.4±1.9,显著低于rPAc组(30.4±4.8,P<0.05)、Re组(44.67±6.09,P<0.05)和NS组(45.8±3.8,P<0.05)。见图4。
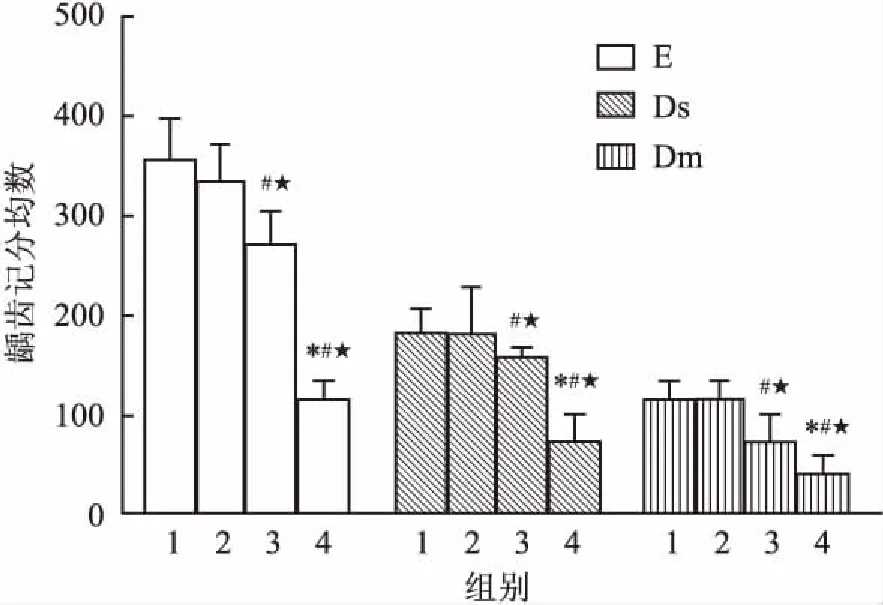
图4 各组大鼠龋齿记分结果
1:NS组;2:Re组;3:rPAc组;4:Re+rPAc组;与rPAc组比较:*P<0.05;与Re组比较:#P<0.05;与NS组比较:★P<0.05
3 讨论
来源于唾液的分泌型IgA(SIgA)和血清的IgG在维护口腔健康、抑制致龋性牙菌斑形成中均有重要作用[10]。SIgA广泛分布于黏膜表面,占黏膜相关组织产生的所有抗体的80%,被认为是防龋的主要屏障。IgG是血清中免疫球蛋白的重要成分,通过龈沟上皮进入龈沟液成为唾液抗体的一部分,发挥抑菌作用。rPAc抑制龋病的主要机制在于诱导机体产生唾液特异性SIgA抗体。抗PAc的SIgA抗体能够与S.mutans结合,阻止其与牙面的非蔗糖依赖性黏附,并导致S.mutans最终被清除。本研究结果显示,用Re作为rPAc佐剂可显著提高小鼠血清特异性抗PAc IgG和唾液特异性抗PAc SIgA抗体水平,并且抗体水平持续至免疫后第16周抗体仍保持较高水平,诱导持久的免疫应答(图1)。以往的研究[1,8]报道较大剂量的蛋白抗原(≥50 μg)才能激发机体产生较高水平的特异性抗体达到防龋保护效果。在本研究中,仅用10 μg rPAc和Re佐剂联合免疫就可诱导机体产生高水平的特异性抗体,这说明Re可以提高防龋疫苗rPAc的免疫效能。
rPAc和Re联合免疫不仅有效地诱导了小鼠的黏膜和系统体液免疫反应,更为重要的是,对啮齿类动物的龋齿的发生发展起到一定的预防作用。本研究显示在定植了变异链球菌的大鼠中,rPAc和Re联合免疫对变形链球菌的感染起到了明显的抑制作用,rPAc+Re免疫组釉质龋、牙本质浅龋和牙本质中龋均较rPAc免疫组、Re组或NS组显著降低(图4)。
为了明确rPAc和Re联合免疫对免疫反应类型的影响,本实验进一步检测了血清特异性抗体亚型IgG1和IgG2a以及脾细胞上清液中细胞因子的浓度。IgG可以分为不同的亚类,如IgG1、IgG2a、IgG2b和IgG3。当一个依赖T细胞的免疫发生的时候,针对某种抗原的特异性抗体的亚类组成就开始形成。而这些亚类的分布组成是诱导细胞和它分泌的细胞因子调节的。在小鼠体内,IL-4主要活化B细胞分泌IgG1分子(Th2型);IFN-γ促进IgG2a和IgG3反应(Th1型)。研究[5]表明Re具有很强的佐剂活性,能增强抗原特异性诱导Th1和Th2型免疫应答,提高特异性抗体水平和细胞因子的表达水平。Sun et al[11]发现Rg1和Re能显著提高小鼠抗OVA特异性IgG、IgG1、IgG2a的水平。Song et al[12]也发现Re与流感疫苗H3N2共同免疫小鼠能显著提高小鼠的抗原特异性IgG、IgG1、IgG2a和IgG2b水平,IFN-γ和IL-5的表达水平。本研究也证实Re和rPAc联合免疫明显促进抗体亚类IgG1,IgG2a的产生以及脾淋巴细胞IL-4、IFN-γ表达(图2、3)。同时IgG1/IgG2和IL-4/IFN-γ比值表明即使Re作为rPAc疫苗佐剂增强了Th1和Th2型免疫应答,但Re+rPAc组仍以Th2型免疫反应为主,这将有利于增强防龋效能,从而导致Re+rPAc组患龋率明显下降(图4)。原因在于细胞外病原的清除依赖机体产生的体液免疫反应,其主要体现在IgG1、IL-4的参与[13]。因此佐剂Re对调节机体产生有利于保护效能的免疫反应类型是一个有效的途径。决定原始细胞向Th1或Th2方向分化在很大程度上受到转录因子T-bet/GATA-3基因的调控[14]。本研究中Re显著增强了抗体亚类IgG1、IgG2a的产生,推测其机制或许和T-bet/GATA-3基因的表达上调有关,从而导致脾淋巴细胞IL-4和IFN-γ表达上升。其具体机制尚待进一步研究。
[1] 曹茜茜,樊 牮,孙晶晶,等.重组亚单位和合成肽防龋疫苗的免疫效能[J].口腔医学研究,2014,30(3):193-9.
[2] Smith D J.Prospects in caries vaccine development[J].J Dent Res,2012,91(3):225-6.
[3] Li Y, Jin J, Yang Y,et al.Enhanced immunogenicity of an anti-caries vaccine encoding a cell-surface protein antigen of Streptococcus mutans by intranasal DNA prime-protein boost immunization[J].J Gene Med,2009, 11(11):1039-47.
[4] 叶惟虎,刘忠芳,李宇红,等.AddaVax经不同免疫途径对防龋疫苗的佐剂效应[J].口腔医学研究,2014,30(4):289-94.
[5] Song X M, Chen J, Sakwiwatkul K,et al.Enhancement of immune responses to influenza vaccine (H3N2) by ginsenoside Re[J].Int Immunopharmacol,2010,10(3):351-6.
[6] 金 洁,樊明文,李宇红. 重组变异链球菌表面蛋白的可溶性表达及抗体制备[J]. 华西口腔医学杂志,2012,30(3):251-8.
[7] 卢冠凡,杜 霞,金 洁,等.变形链球菌表面蛋白PAc的原核表达及纯化[J]. 口腔医学研究,2010,26(1):60-3.
[8] Zhang P, Jespersgaard C, Lamberty-Mallory L,et al.Enhanced immunogenicity of a genetic chimeric protein consisting of two virulence antigens ofStreptococcusmutansand protection against infection[J].Infect Immun,2002,70(12): 6779-87.
[9] Keyes P H. Dental caries in the molar teeth of rats.II.A method for diagnosing and scoring several types of lesions simultaneously[J].J Dent Res,1958,37(6):1088-99.
[10] Chen L, Zhu J, Li Y, et al.Enhanced nasal mucosal delivery and immunogenicity of anti-caries DNA vaccine through incorporation of anionic liposomes in chitosan/DNA complexes[J].PLoS One,2013,8(8):e71953.
[11] Sun J H, Hu S, Song X.Adjuvant effects of protopanaxadiol and protopanaxatriol saponins from ginseng roots on the immune responses to ovalbumin in mice[J].Vaccine,2007,25(6):1114-20.
[12] Song X M, Chen J, Sakwiwatkul K,et al.Enhancement of immune responses to influenza vaccine (H3N2) by ginsenoside Re[J].Int Immunopharmacol,2010,10(3):351-6.
[13] Constant S L, Bottomly K.Induction of Th1 and Th2 CD4+ T cell responses: the alternative approaches[J].Annu Rev Immunol,1997,15:297-322.
[14] Chakir H, Wang H, Lefebvre D E,et al.T-bet/GATA-3 ratio as a measure of the Th1/Th2 cytokine profile in mixed cell populations:predominant role of GATA-3[J].J Immunol Methods,2003,278(1-2):157-69.
