染料木黄酮通过PI3K/AKT途径抑制雄激素非依赖性LNCaP细胞
2018-07-04曹玉霖张薇薇朱彦锋
曹玉霖,李 飞,赵 欢,欧 愚,张薇薇,朱彦锋
前列腺癌是男性生殖系常见的恶性肿瘤之一,在西方国家发病率仅次于肺癌,是第二位的男性癌症致死病因[1]。前列腺癌的发生、进展依赖于雄激素,目前雄激素剥夺治疗是前列腺癌患者的一线治疗方法,雄激素剥夺治疗在前列腺癌早期有效,但大多数患者在治疗14~30个月后便进入“去势抵抗”阶段,发展为去势抵抗性前列腺癌(castration-resistant prostate cancer, CRPC)[2],传统的化学治疗对CRPC疗效欠佳,其平均生存期仅为2~3年。前列腺癌向去势抵抗性前列腺癌转变的机制目前尚不清楚。
染料木黄酮(Genistein, GEN)是一种天然的黄酮类化合物,广泛存在于豆荚类植物中,是一种天然植物雌激素,有确切预防癌症的作用[3]。研究[4-5]显示,通过膳食摄入的GEN可以预防和治疗相关疾病,特别是对乳腺癌、前列腺癌有积极的预防和治疗作用。大量研究证实,GEN有抗前列腺癌活性,主要表现在抑制肿瘤细胞增殖[6-7]、诱导细胞凋亡[8]、抑制肿瘤血管形成[9],以及对抗癌药物的协同增敏作用。GEN还能降低早期前列腺癌患者血清前列腺特异性抗原(prostate-specific antigen,PSA)水平[10]。目前,关于GEN治疗前列腺癌后期的CRPC的发生和发展的作用及机制研究较少。该研究旨在探讨GEN对雄激素非依赖性LNCaP细胞的抑制作用。通过建立雄激素非依赖性LNCaP细胞的模型,在体外模拟雄激素依赖性前列腺癌进展为雄激素非依赖性前列腺癌的过程。
1 材料与方法
1.1细胞与试剂LNCaP细胞(成都哈里生物公司);无酚红RPMI-1640培养液(以色列Biological Industries公司);胎牛血清(美国Gibco公司);GEN、DMSO(美国Sigma公司);CCK-8(南京凯基公司);BCA蛋白浓度测定试剂盒(中国碧云天公司);兔抗人PSA、兔抗人P53、兔抗人增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、兔抗人细胞周期蛋白(CyclinD1)、磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)、p-PI3K蛋白、丝苏氨酸蛋白激酶(AKT)、p-AKT蛋白抗体(美国Abcam公司);山羊抗兔IgG、鼠抗人β-actin及山羊抗鼠IgG单克隆抗体均购自北京中杉金桥生物技术有限公司。
1.2方法
1.2.1雄激素非依赖性前列腺癌LNCaP细胞株的建立 雄激素依赖性LNCaP细胞用常规含10%胎牛血清的无酚红RPMI 1640培养基培养,经3周传代3次后,血清改用经活性碳/葡聚糖处理的胎牛血清,平均每3 d换液1次,每6 d传代1次,连续传代40次共8个月。培养环境为37 ℃、5% CO2常规培养箱。
1.2.2CCK-8检测雄激素非依赖性LNCaP细胞生长情况 在96孔板中接种处于对数生长期的雄激素非依赖性LNCaP细胞,每孔培养5 000个细胞。5% CO2、37 ℃孵育,孵育24 h后,去掉旧培养液,每孔加入不同浓度的GEN工作液100 μl (7个浓度组: 0、6.25、12.5、25、50、100、200 μmol/L),每个浓度组设5个复孔。GEN 0 μmol/L组为对照组。孵育24、48、72 h 后,每孔再加入100 μl含10% CCK-8的培养液,孵育4 h。用酶标仪检测450 nm处的吸光度(optical density,OD)。根据公式: 抑制率(%)= (1-加药组OD/对照组OD)×100%,计算不同浓度组GEN对雄激素非依赖性LNCaP细胞的抑制率。
1.2.3Western blot法检测蛋白的表达 6个浓度组的GEN处理LNCaP细胞72 h后,加入蛋白酶抑制剂和裂解液的混合物,在冰上裂解30 min,4 ℃、10 000 r/min离心20 min,用BCA法对上清液进行蛋白定量并分装保存于-70 ℃。制备SDS-聚丙烯酰胺凝胶,利用80 V(浓缩胶) /120 V(分离胶) 电压对蛋白质进行分离,在100 V 恒压条件下转移1.5 h。PVDF膜用TBST冲洗并浸入5%脱脂牛奶中封闭,振荡1 h。TBST洗膜3次,每次5 min,分别加入兔抗人PSA、兔抗人PCNA、兔抗人Cyclin D1、兔抗人P53、PI3K、p-PI3K、AKT、p-AKT单克隆抗体(1 ∶1 000),摇床4 ℃孵育过夜。TBST洗膜3次,每次5 min。加入HRP标记的羊抗兔IgG (1 ∶5 000),室温下孵育1.5 h。TBST洗膜3次,每次10 min。通过凝胶成像仪对PVDF膜进行曝光成像,以目的蛋白与内参β-actin的光密度比值评价其表达。重复实验3次。

2 结果
2.1雄激素非依赖性LNCaP细胞模型的建立正常LNCaP细胞用常规培养基培养,传代3次后,改用无激素无酚红培养基培养,连续传代40次。在活性碳/葡聚糖处理的胎牛血清的RPMI 1640培养液中,雄激素非依赖性LNCaP细胞呈梭形贴壁生长,培养3 d后,细胞开始向外伸出许多突触,培养7 d后,细胞长至80%。正常LNCaP细胞和雄激素非依赖性LNCaP细胞在40倍显微镜下的形态见图1。

图1 雄激素依赖性和雄激素非依赖性LNCaP细胞在显微镜下形态 ×40
A:雄激素依赖性LNCaP细胞;B:雄激素非依赖性LNCaP细胞培养40代后
2.2雄激素非依赖性LNCaP细胞模型的验证正常LNCaP细胞、LNCaP细胞去激素培养20代、40代后,利用Western blot法检测PSA蛋白的表达,用凝胶成像仪分析电泳结果,图2显示LNCaP细胞内PSA的表达水平随着去激素培养代数的增加而逐渐降低。

图2 正常LNCaP细胞、LNCaP细胞去激素培养20代、40代的PSA表达水平
2.3GEN对雄激素依赖性LNCaP和雄激素非依赖性LNCaP细胞增殖的影响CCK-8法检测不同浓度的GEN(0、6.25、12.5、25、50、100、200 μmol/L) 分别作用于雄激素依赖性LNCaP细胞和雄激素非依赖性LNCaP细胞24、48、72 h后的增殖影响。结果显示:GEN作用于雄激素依赖性LNCaP细胞和雄激素非依赖性LNCaP细胞后,对其增殖具有明显的抑制作用,且具有剂量、时间依赖关系(P<0.05)。见表1、2。
表1 不同浓度GEN对雄激素依赖性LNCaP细胞体外增殖的影响
与对照组比较:*P<0.05
表2 不同浓度GEN(μmol/L)对雄激素非依赖性LNCaP细胞体外增殖的影响
与对照组比较:*P<0.05
2.4不同浓度GEN对雄激素非依赖性LNCaP细胞周期蛋白的影响GEN 处理雄激素非依赖性LNCaP细胞72 h后,Western blot法检测结果显示,GEN能上调LNCaP细胞中P53的表达,下调了增殖抗原PCNA及周期蛋白CyclinD1的表达。见图3。
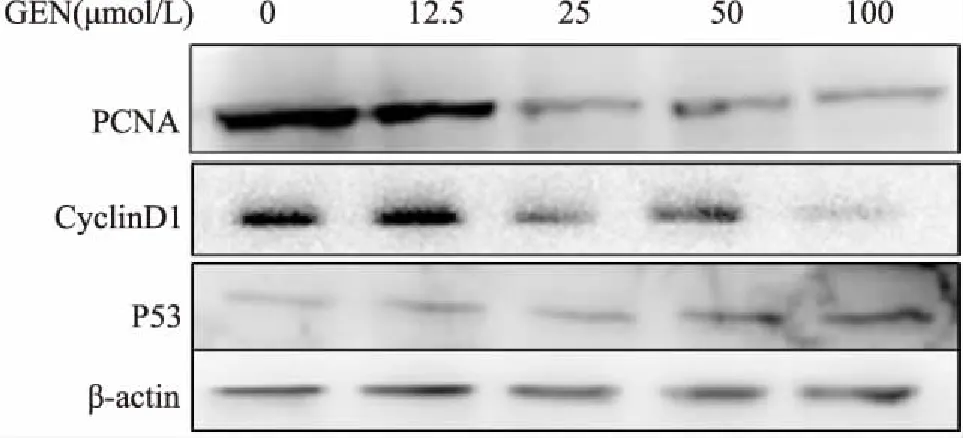
图3 不同浓度GEN处理72 h对PCNA、CyclinD1、P53表达的影响
2.5对PI3K/AKT信号通路的抑制作用为了进一步探讨GEN抑制LNCaP生长的分子机制,检测了PI3K/AKT信号通路的表达,结果显示,100 μmol/L的GEN和阴性对照组(0 μmol/L GEN)处理雄激素非依赖性LNCaP细胞48 h后,PI3K和AKT的磷酸化明显受到抑制,见图4。
3 讨论
CRPC是前列腺癌终末期的表现,大多数患者最终会对现有的常规抗肿瘤化疗药物产生抗性而失效,因此,如何延缓CRPC的产生是当前治疗前列腺癌的重点之一。大量研究[11-12]表明,大豆异黄酮能够抑制前列腺癌细胞增殖、诱导肿瘤细胞凋亡、抑制癌细胞侵袭转移等抗肿瘤效应,对预防和治疗前列腺癌具有重要意义。但大豆异黄酮对前列腺癌治疗后期的CRPC的发生和发展的作用及机制研究较少。

图4 100 μmol/L的GEN处理48 h对PI3K、AKT、p-PI3K、p-AKT表达的影响A:阴性对照组;B:100 μmol/L GEN
本研究中采用了CRPC代表细胞株LNCaP作为实验株,在体外建立了雄激素非依赖性生长的细胞模型。研究GEN对雄激素非依赖性LNCaP细胞增殖与凋亡的影响并探讨其作用机制。
CCK-8法提示,随着GEN浓度的增高,LNCaP细胞和雄激素非依赖性LNCaP细胞的生长有明显的抑制作用,且呈现出时间、剂量依赖关系。
Cyclin D1的过度表达会改变细胞周期进程。研究[13]显示GEN抑制22RV1细胞增殖可能是通过下调CyclinD1的表达来实现。Cyclin D1 基因过表达和基因扩增在多种肿瘤细胞中被发现。本研究显示GEN浓度大于25 μmol/L时可显著抑制LNCaP细胞中CyclinD1蛋白的表达。
肿瘤细胞的增殖活性旺盛,PCNA可作为评价肿瘤细胞增殖状态的指标,随着细胞增殖周期的不同,其含量发生相应的变化。p53是一种肿瘤抑制基因,50%以上的恶性肿瘤会出现该基因的突变。本研究通过Western blot实验检测发现GEN能抑制CRPC细胞中PCNA表达,而上调P53蛋白的表达,这提示GEN能够抑制CRPC细胞的增殖。Zhao et al[14]研究发现GEN在10 μmol/L时能上调P53的表达,阻滞LNCaP细胞在G2/M 期,与本研究作用浓度(12.5 μmol/L) 相符。
PI3K/AKT信号通路参与增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节[15],目前以PI3K-AKT信号通路关键分子为靶点的肿瘤治疗策略正在发展中。Western blot结果显示,100 μmol/L的GEN处理雄激素非依赖性LNCaP细胞48 h后,PI3K和AKT的磷酸化明显受到抑制,而PI3K和AKT的总蛋白水平没有明显变化。说明GEN处理雄激素非依赖性LNCaP细胞后,抑制细胞增殖,可能与其下调PI3K和AKT磷酸化水平,抑制PI3K/AKT信号通路有关,但仍需进一步实验证实。
本研究建立了雄激素非依赖性LNCaP细胞的体外生长模型,结果显示GEN可以显著抑制雄激素非依赖性LNCaP细胞的生长,并能下调Cyclin D1、PCNA的表达。GEN抑制雄激素非依赖性LNCaP细胞的增殖,其作用机制与下调PI3K/AKT信号通路有关。本研究证实了染料木黄酮对CRPC的“化学预防”作用。
[1] Siegel R L, Miller K D, Jemal A. Cancer statistics, 2016[J]. Ca Cancer J Clin, 2016,66(1): 7-30.
[2] Berlin A, Fernandez M I. Advances in the treatment of castration-resistant prostate cancer: emphasis in new hormonal therapies[J]. Rev Med Chil, 2015,143(2):223-36.
[3] Karsli-Ceppioglu S, Ngollo M, Judes G, et al. The role of soy phytoestrogens on genetic and epigenetic mechanisms of prostate cancer[J]. Enzymes,2015,37:193-221.
[4] D'Adamo C R, Sahin A. Soy foods and supplementation: a review of commonly perceived health benefits and risks[J]. Altern Ther Health Med, 2014,20 Suppl 1:39-51.
[5] Varinska L, Gal P, Mojzisova G, et al. Soy and breast cancer: focus on angiogenesis[J]. Int J Mol Sci,2015,16(5):11728-49.
[6] Mahmoud A M, Yang W, Bosland M C. Soy isoflavones and prostate cancer: a review of molecular mechanisms[J]. J Steroid Biochem Mol Biol, 2014,140:116-32.
[7] Mahmoud A M, Zhu T, Parray A, et al. Differential effects of genistein on prostate cancer cells depend on mutational status of the androgen receptor[J]. PLoS One, 2013,8(10):e78479.
[8] Dong X, Xu W, Sikes R A, et al. Apoptotic effects of cooked and in vitro digested soy on human prostate cancer cells[J]. Food Chem, 2012,135(3): 1643-52.
[9] Handayani R, Rice L, Cui Y, et al. Soy isoflavones alter expression of genes associated with cancer progression, including interleukin-8, in androgen-independent PC-3 human prostate cancer cells[J]. J Nutr, 2006,136(1):75-82.
[10] Lazarevic B, Boezelijn G, Diep L M, et al. Efficacy and safety of short-term genistein intervention in patients with localized prostate cancer prior to radical prostatectomy: a randomized, placebo-controlled, double-blind Phase 2 clinical trial[J]. Nutr Cancer, 2011, 63(6):889-98.
[11] Bosland M C, Kato I, Zeleniuch-Jacquotte A, et al. Effect of soy protein isolate supplementation on biochemical recurrence of prostate cancer after radical prostatectomy: a randomized trial[J]. JAMA, 2013,310(2):170-8.
[12] Ren J, Huang Q, Xu Y, et al. Isoflavone lupiwighteone induces cytotoxic, apoptotic, and antiangiogenic activities in DU-145 prostate cancer cells[J]. Anticancer Drugs, 2015,26(6):599-611.
[13] 李 飞, 朱彦锋, 陈静瑶, 等.染料木黄酮对去势抵抗前列腺癌22RV1细胞增殖的影响[J].郑州大学学报(医学版), 2017, 52(4):393-8.
[14] Zhao R, Xiang N, Domann F E, et al. Effects of selenite and genistein on G2/M cell cycle arrest and apoptosis in human prostate cancer cells[J].Nutr Cancer, 2009, 61(3):397-407.
[15] Seiler T, Hutter G, Dreyling M. The emerging role of PI3K inhibitors in the treatment of hematological malignancies: preclinical data and clinical progress to date[J]. Drugs, 2016, 76(6):639-46.
