环巴胺对佐剂性关节炎大鼠关节软骨细胞增殖和凋亡的影响
2018-07-04黄焱平汪陶荣张俊强殷瞳昕宋先兵陈晓宇
黄焱平,曹 威,汪陶荣,张俊强,殷瞳昕,宋先兵,陈晓宇,
类风湿性关节炎(rheumatic arthritis,RA)表现为滑膜细胞过度增生,浸润并破坏滑膜下软骨组织或骨组织,病程迁延可导致患者关节畸形和致残。因此,RA治疗的关键是降低关节软骨和骨组织的破坏[1]。动物体内普遍存在进化保守的Hedgehog(Hh)信号通路,在胚胎期组织分化、肿瘤形成等方面作用广泛[2]。研究[3-4]证实,Hh信号通路参与软骨与骨发育和生长,骨关节炎患者的关节软骨细胞中发现明显的Hh信号通路的激活,基因沉默Hh信号通路后关节损伤症状得到缓解,有望成为新的骨关节炎治疗手段。环巴胺(cyclopamine)为Hh通路抑制剂,目前对RA患者病变进程中关节软骨细胞的影响研究报道较少。该研究拟建立大鼠佐剂性关节炎(adjuvant arthritis,AA)模型,观察环巴胺在体外能否通过抑制Hh信号通路,影响AA大鼠关节软骨细胞增殖,旨在发现新的RA药物作用靶点。
1 材料与方法
1.1实验动物20只雄性Sprague-Dawley (SD)大鼠,清洁级,体质量(160±10)g,购自安徽省实验动物中心。环境温度(24.5±1.0)℃、相对湿度(59.0±2.0)%,适应性喂养1周进行实验,依据安徽医科大学实验动物处理程序。
1.2主要试剂与仪器弗氏完全佐剂(Freund's complete adjuvant,FCA)、环巴胺、羊抗鼠Shh多克隆抗体、羊抗鼠Ptch1多克隆抗体和羊抗鼠Gli1多克隆抗体(美国Sigma公司);兔抗羊生物素二抗(北京中杉金桥有限公司);总蛋白抽提试剂盒(北京索莱宝科技有限公司);硝酸纤维素膜(美国Whatman公司);显影液、定影液、胶片(美国柯达公司);Dulbecco 改良 Eagle 培养基(DMEM)(美国Gibco公司);乙二胺四乙酸(EDTA)、羧甲基纤维素钠为国产分析纯溶液;Multikan FC型全自动酶标仪(美国Thermo Fisher公司);PV-200_足趾容积测量仪(成都泰盟软件有限公司)。
1.3动物分组和模型制备雄性SD大鼠20只,随机分为正常组和模型组,每组10只,模型制备参照文献[5]报道,采取0.1 ml FCA左侧足趾皮下注射制备AA模型,正常组注射等量生理盐水。
1.4模型评定AA大鼠模型评价参照文献[5]报道,主要利用足爪肿胀度和关节HE染色形态学检查。足爪肿胀度测量应用足容积测量仪,测量SD大鼠致炎前右侧(非致炎侧)踝关节下容积,从致炎后第12~28天,每4 d测量继发侧足爪容积,足爪肿胀度(Δml)=继发侧注射后足爪容积-注射前足爪容积。HE染色观察踝关节形态学改变,第28天处死大鼠后,取两组大鼠踝关节浸入10%的甲醛溶液中固定24 h后,浸入含10% EDTA 的脱钙溶液中脱钙8周处理,大鼠踝关节常规脱水、透明、石蜡包埋、4 μm厚切片,HE染色,观察两组大鼠踝关节形态学改变。
1.5关节软骨细胞分离培养和鉴定参照文献[6],采用胰酶联合Ⅱ型胶原酶分离AA大鼠软骨细胞,操作步骤如下,将大鼠踝关节浸泡75%乙醇中30 min后,在无菌操作台中,去皮,小心剥离关节表面白色膜状透明软骨层,在无菌培养皿中先用37 ℃胰酶消化30 min,然后再用0.2% Ⅱ型胶原酶消化3 h,200目滤网过滤,1 500 r/min离心10 min,PBS洗3次,每次5 min。收集洗涤后的细胞,加入含10%胎牛血清的DMEM培养基,37 ℃饱和湿度的5% CO2培养箱中培养48 h,去除悬浮细胞,待贴壁细胞连接呈片状时可应用胰酶传代培养。软骨细胞的鉴定应用甲苯胺蓝染色、免疫细胞化学染色Ⅱ型胶原显色,实验所用的细胞为传代培养3~5代的AA大鼠软骨细胞。
1.6CCK-8法测定环巴胺处理后大鼠软骨细胞增殖情况处于对数生长期的AA大鼠踝关节分离培养的透明软骨细胞,含10% FBS的DMEM培养基5×104/L接种于96孔板中,每孔100 μl,37 ℃、5% CO2培养箱中培养24 h;细胞增殖实验包括5组:每组环巴胺终浓度分别为0、0.03、0.3、3、10 μmol/L。37 ℃、5% CO2继续培养44 h,然后每孔加入CCK-8溶液20 μl再培养4 h。取出培养板,应用全自动酶标仪,在波长为450 nm处测吸光度(absorbance,A)值A450,测定AA大鼠软骨细胞的增殖情况,每组设5个复孔,实验重复3次,以试验测得的均值为实验结果。
1.7Hoechst33258染色检测环巴胺处理后软骨细胞凋亡情况取对数生长期的软骨细胞,按照1×106/孔接种于6孔细胞培养板中,贴壁培养24 h后,软骨细胞分4组:AA模型组(AA大鼠培养软骨细胞未予药物刺激)、环巴胺给药组(环巴胺作用软骨细胞,终浓度为 0.3、3、10 μmol/L)处理48 h,吸弃培养液,4%多聚甲醛溶液固定30 min;PBS清洗3次,每次5 min。弃去清洗液并吸干,每孔50 μl Hoechst 33258染色液,避光染色10 min,PBS清洗2次,每次10 min,荧光显微镜下观察并拍照。
1.8Westernblot法检测环巴胺处理软骨细胞对Shh、Gli1、Ptch1蛋白的影响25 ml培养瓶中按照3.0×106/瓶接种处于对数生长期的软骨细胞,每瓶加入含10%胎牛血清的DMEM培养液5 ml,培养24 h 后,以加入完全培养基为对照组,给药组按照加入不同浓度的环巴胺分为3组(环巴胺终浓度0.3、3、10 μmol/L),37 ℃、饱和湿度、5% CO2培养箱培养24 h后,分离提取蛋白样本,BCA法测定蛋白浓度,计算后取30 μg蛋白样品作为上样量检测,SDS-PAGE胶电泳蛋白分离,湿转到PVDF膜上。TBST洗膜3次,每次10 min,5%的脱脂奶粉抗原封闭1 h后,再转入杂交袋中,一抗(羊抗鼠Shh蛋白1 ∶1 000、羊抗鼠Gli1蛋白1 ∶1 500、羊抗鼠Ptch1蛋白1 ∶1 500,羊抗鼠β-actin蛋白 1 ∶1 500)多克隆抗体,4 ℃孵育过夜;次日室温下,TBST洗膜3次,每次10 min;辣根过氧化物酶标记二抗室温孵育1 h,TBST洗膜3次,每次10 min;蛋白条带半干电转, ECL增强化学发光,暗室中显影、定影、曝光压片。凝胶分析成像系统软件Band Scan 5.0对目的条带和内参条带β-actin进行灰度值检测。蛋白检测实验重复3次。

2 结果
2.1大鼠继发性关节炎评价应用足趾容量仪排水法检测足爪肿胀度,HE染色观察两组大鼠继发侧关节结构的改变来评价继发性关节炎。足爪肿胀度观察结果表明,与正常对照组比较, AA大鼠于第12天出现继发侧足肿胀,肿胀程度在20 d时最为明显,在整个实验期间,对照组大鼠继发侧的足爪容积基本无改变,见图1。大鼠继发侧踝关节HE染色表明,注射生理盐水的对照组关节透明软骨表面有薄层滑膜组织,软骨细胞生活在软骨陷窝中,由边缘向中央软骨细胞逐渐长大,可见同源细胞群,见图2A;模型组大鼠踝关节见关节滑膜组织增生,关节腔减小或消失,增生的滑膜组织向滑膜下的软骨和骨组织中侵袭,软骨细胞在基质中排列连续性破坏,呈排列紊乱状态,见图2B。
2.2AA大鼠透明软骨细胞培养和鉴定经过分离培养的原代AA大鼠踝关节软骨细胞呈类圆形,12 h后细胞呈扁平多角形,细胞贴壁生长,72 h左右细胞完全贴壁,呈梭形或多边形;生长1周左右时细胞连接呈片状,可用胰酶消化传代培养。软骨细胞鉴定采用细胞化学和免疫组化技术,甲苯胺蓝染色显示:AA大鼠踝关节的透明软骨细胞胞质为浅蓝色,核着色较胞质深,呈蓝色,胞质中可见少许异染颗粒,见图3A;进一步鉴定采用免疫组化染色技术检测Ⅱ型胶原表达情况,可见SD大鼠踝关节软骨细胞胞质为黄色的Ⅱ型胶原阳性表达,见图3B,以上鉴定结果证实本研究培养的细胞是关节透明软骨细胞。

图1 不同时间点AA大鼠继发性足爪肿胀度(Δml)

图2 大鼠踝关节腔形态学改变 HE×100

图3 关节透明软骨细胞鉴定
A: 甲苯胺蓝染色呈阳性 ×200;B:免疫组化染色Ⅱ型胶原呈阳性表达 ×400
2.3不同浓度环巴胺对AA大鼠软骨细胞增殖的影响96孔培养板中,加入100 μl浓度为5×104/L的AA大鼠软骨细胞悬液培养24 h后,加入环巴胺处理(终浓度为0、0.03、0.3、3、10、30 μmol/L)软骨细胞48 h后,CCK-8检测细胞增殖,结果表明,环巴胺可促进AA模型组软骨细胞增殖,且随着环巴胺处理浓度(0.3、3、10、30 μmol/L)的上升,其促进增殖作用较AA模型组的软骨细胞的增殖差异有显著性(F=10.351,P<0.05,P<0.01),见图4。考虑低浓度(0.03 μmol/L)环巴胺对AA大鼠软骨细胞增殖作用不明显,后续实验中选择环巴胺处理终浓度分别为0.3、3、10 μmol/L。
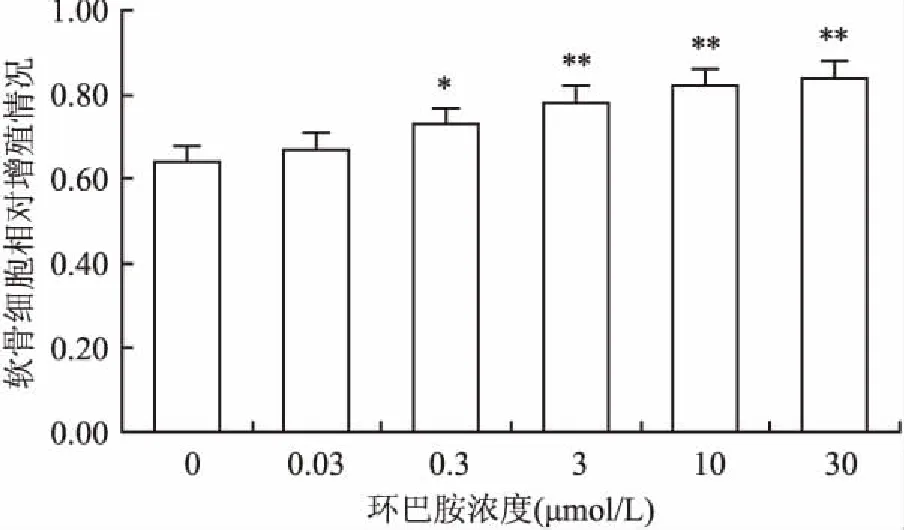
图4 不同浓度环巴胺对AA大鼠软骨细胞增殖的影响
2.4环巴胺对AA大鼠关节软骨细胞凋亡的影响培养的大鼠关节软骨细胞在荧光显微镜下,通过Hoechst 33258染色后,可见AA模型组软骨细胞有较多的细胞核出现碎裂和染色质的固缩,呈现凋亡细胞形态学改变,见图5A,环巴胺给药组的AA大鼠软骨细胞的凋亡较模型组减少,见图5B~D,表明环巴胺有减少AA大鼠关节软骨细胞凋亡的作用。

图5 环巴胺对AA大鼠软骨细胞凋亡的影响 ×200
A:模型组;B:环巴胺(0.3 μmol/L);C:环巴胺(3 μmol/L);D:环巴胺(10 μmol/L)
2.5环巴胺体外影响软骨细胞中Hh通路相关蛋白的表达环巴胺(终浓度0、0.3、3、10 μmol/L)处理AA大鼠软骨细胞24 h后,Western blot法检测显示,与AA模型大鼠软骨细胞中Hh通路中相关蛋白比较,环巴胺处理组的Shh、Gli1、Ptch1蛋白表达水平呈一定程度的下降趋势,见图6A;与AA模型组比较差异有统计学意义(P<0.05,P<0.01),见图6B。
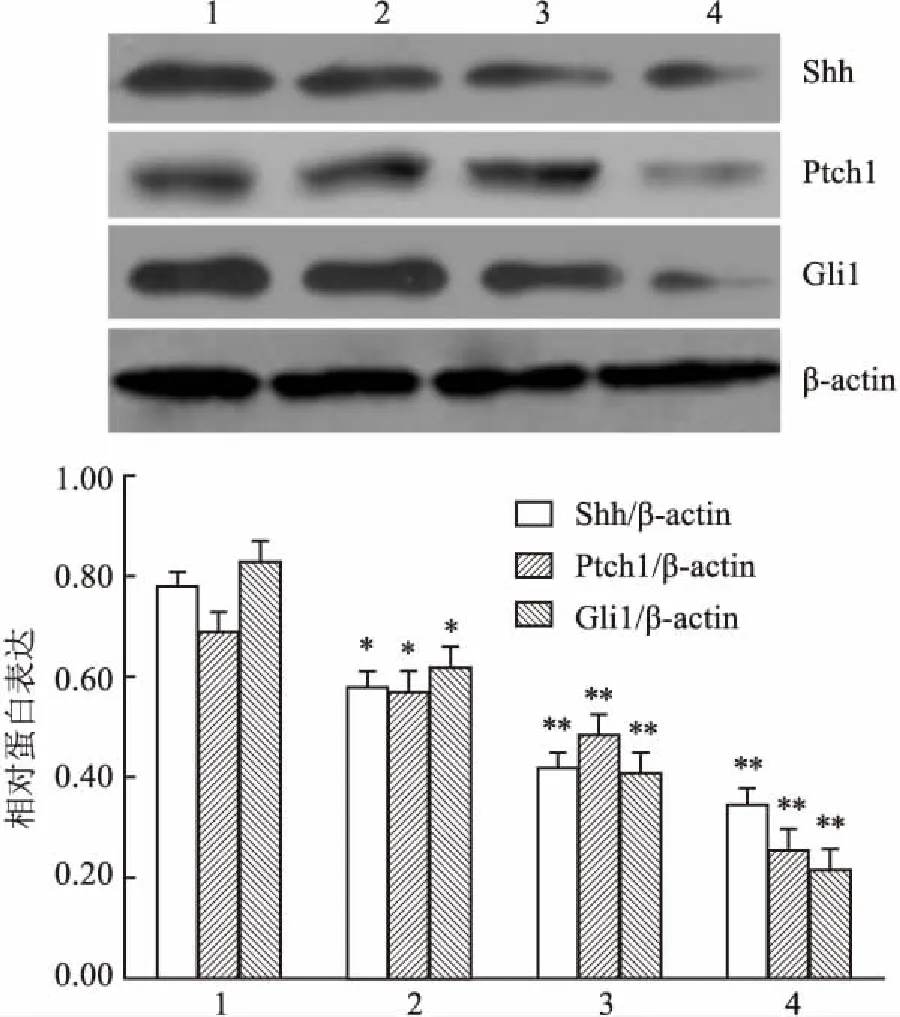
图6 Western blot法检测环巴胺影响软骨细胞中Hh通路中相关蛋白
1:模型组;2:环巴胺(0.3 μmol/L);3:环巴胺(3 μmol/L);4:环巴胺(10 μmol/L);与模型组比较:*P<0.05,**P<0.01
3 讨论
RA属于自身免疫性疾病,主要原因为滑膜组织增生,导致软骨和骨进行性破坏,病程迁延至患者关节功能障碍,甚至残疾[1]。由FCA诱导的AA模型是经典的探讨RA机制的动物模型[5],本研究中成功采用FCA大鼠足底皮下注射诱导SD大鼠,通常注射侧足爪(原发侧)肿胀外,继发侧足爪于原发侧10 d后有炎性反应,本研究通过关节肿胀度评估继发侧足爪关节炎改变,研究结果表明,注射FCA 12 d后,SD大鼠继发侧关节肿胀明显。HE染色表明注射FCA后,模型组大鼠较正常组踝关节滑膜组织增生,并侵袭关节软骨中,导致软骨细胞形态改变,表明AA大鼠模型造模成功。软骨组织主要由软骨细胞和细胞外基质组成,覆盖在关节表面,软骨细胞在软骨囊内活跃增生和分裂,形成同源细胞群,是软骨更新和修复中最重要的细胞[6]。在RA形成过程中,软骨细胞正常的增殖和代谢发生改变,其异常的凋亡降低了软骨密度,软骨细胞产生的软骨基质平衡紊乱,导致关节软骨受损,严重影响关节的功能[7]。本研究免疫组化结果表明,软骨细胞中产生基质的重要组成成分II型胶原表达阳性;甲苯胺蓝染色,软骨细胞的胞质浅蓝色,证实培养的细胞为AA大鼠的软骨细胞。
在临床上,RA的治疗主要是对症和抗炎处理,特异性治疗药物尚缺乏,异甾体类生物碱环巴胺是从藜芦属植物中分离提取,具有抑制肿瘤生长功能[4],而RA发病中,滑膜细胞异常增殖呈类肿瘤样生长的特性,导致软骨细胞增殖出现异常[5]。本研究中先采用CCK-8法检测了软骨细胞增殖情况,然后通过环巴胺体外给药观察AA大鼠软骨细胞增殖情况,研究表明,随着环巴胺浓度的升高,AA模型大鼠软骨细胞增殖随之增加。为探讨该现象,该实验观察了环巴胺对软骨细胞的凋亡作用,Hoechst 33258能穿透细胞膜,为蓝色非嵌入型的荧光染料,可与细胞中DNA聚AT序列结合,在荧光显微镜紫外光激发时呈亮蓝色荧光,细胞凋亡时,DNA断裂,呈核碎裂和染色质固缩,故可通过Hoechst 33258染料进行细胞凋亡检测[8]。该研究中通过Hoechst 33258染色后,AA模型组软骨细胞有较多的核碎裂和染色质固缩的凋亡细胞形态学改变,环巴胺给药组细胞凋亡减少。故环巴胺提高软骨细胞增殖可能与其抑制AA大鼠关节软骨细胞凋亡作用有关。
骨关节炎中,存在活化的Hedgehog(Hh)信号通路参与骨和关节破坏[9]。Hh信号通路包含以下几个过程[10]:首先是Hh信号分子Dhh、Shh、Ihh等通过跨膜受体Smo、Ptch,激活转录因子Glis家族,活化的转录因子Glis家族进入细胞核内,最后通过下游靶基因发挥功能。RA时,Hh蛋白结合Ptch蛋白,降低了Ptch蛋白对Smo的抑制作用,导致下游核转录因子Glis家族激活,靶基因表达增加,加剧RA病情。Hh信号通路的异常激活在骨关节病中的研究广受关注,可调节骨与软骨生长与发育[11]。本研究Western blot结果表明,未给予环巴胺的AA模型大鼠关节软骨细胞中Hh蛋白表达水平较高,存在Hh信号通路蛋白异常激活现象;在环巴胺作用AA大鼠软骨细胞24 h后,Hh信号通路蛋白Shh蛋白、Ptch1蛋白、Gli1蛋白水平表达明显下降,表明环巴胺体外给药可显著下降AA大鼠软骨细胞中Hh信号通路蛋白的表达,抑制其过度活化,这可能进一步说明环巴胺处理后,AA大鼠关节软骨细胞增殖修复,较骨细胞凋亡减少。
综上,本研究表明,Hh通路抑制剂环巴胺可纠正紊乱的AA大鼠关节软骨细胞增殖,抑制关节软骨细胞凋亡,提示干预AA大鼠软骨细胞Hh信号通路,有可能保护RA关节潜在的应用价值。
(致谢:感谢安徽医科大学药学院李荣博士在实验中给予的帮助。)
[1] Zhang J, Song X,Cao W,et al. Autophagy and mitochondrial dysfunction in adjuvant-arthritis rats treatment with resveratrol[J]. Sci Rep, 2016,6:32928.
[2] Armas-López L, Zúiga J, Arrieta O, et al.The Hedgehog-GLI pathway in embryonic development and cancer: implications for pulmonary oncology therapy[J].Oncotarget, 2017,8(36): 60684-703.
[3] Thompson C L, Chapple J P, Knight M M. Primary cilia disassembly down-regulates mechanosensitive Hedgehog signalling: a feedback mechanism controlling ADAMTS-5 expression in chondrocytes[J].Osteoarthritis Cartilage, 2014, 22(3):490-8.
[4] Li R, Cai L, Ding J, et al. Inhibition of hedgehog signal pathway by cyclopamine attenuates inflammation and articular cartilage damage in rats with adjuvant-induced arthritis[J].J Pharm Pharmacol,2015,67(7):963-71.
[5] Chen X Y, Li J, Cheng W M, et al. Effect of total flavonoids of Chrysanthemum indicumon the apoptosis of synoviocytes in joint of adjuvant arthritis rats[J].Am J Chin Med, 2008, 36(4): 695-704.
[6] 丁 婧,李 荣,胡向阳,等. 环巴胺对佐剂性关节炎大鼠关节软骨细胞增殖凋亡的影响及其抗凋亡机制[J]. 安徽医科大学学报, 2015,50(4): 446-51.
[7] Gambassi S, Geminiani M, Thorpe S D, et al. Smoothened-antagonists reverse homogentisic acid-induced alterations of Hedgehog signaling and primary cilium length in alkaptonuria[J].J Cell Physiol, 2017, 232(11):3103-11
[8] Musumeci G, Loreto C, Carnazza M L,et al. Characterization of apoptosis in articular cartilage derived from the knee joints of patients with osteoarthritis[J].Knee Surg Sports Traumatol Arthrosc, 2011,19(2):307-13.
[9] Thorpe S D, Gambassi S, Thompson C L, et al.Reduced primary cilia length and altered Arl13b expression are associated with deregulated chondrocyte Hedgehog signaling in alkaptonuria[J].J Cell Physiol,2017, 232(9): 2407-17.
[10] Rockel J S, Yu C, Whetstone H, et al. Hedgehog inhibits β-catenin activity in synovial joint development and osteoarthritis[J].J Clin Invest,2016,126(5):1649-63.
[11] Bechtold T E, Saunders C, Decker R S, et al. Osteophyte formation and matrix mineralization in a TMJ osteoarthritis mouse model are associated with ectopichedgehogsignaling[J].Matrix Biol, 2016, 52:339-54.
