FAM96A在结肠癌组织中的表达差异及其对结肠癌细胞增殖和凋亡的影响
2018-07-04钟蓝海马丹丹
孙 康,钟蓝海,张 杨,马丹丹,蔡 逊,田 俊
结肠癌发生发展、侵袭转移与众多基因、分子异常表达密切相关[1]。研究[2]显示,96序列相似的家庭成员A (family with sequence similarity 96, member A , FAM96A)在胃肠道间质瘤中表达显著降低,过表达FAM96A于间质瘤细胞中,抑制细胞增殖,增加凋亡敏感性诱导细胞凋亡,减少致瘤性,且对FAM96A功能的研究有助于开发新型间质瘤疗法。目前国内外关于FAM96A在结肠癌发生发展中作用的研究报道甚少。该研究主要观察FAM96A在结肠癌组织中的表达差异,并分析其表达差异与结肠癌淋巴结转移、远处转移及TNM分期等临床病理特征的关系,并探讨其对结肠癌细胞系HCT116细胞增殖、凋亡的影响。
1 材料与方法
1.1病例资料收集中国人民解放军武汉总医院普通外科2015年7月~2016年7月60例结肠癌组织标本及距肿瘤边缘>5 cm处为准的癌旁组织标本,离体后液氮灌暂时存放并运送至-80 ℃ 超低温冰箱中长期保存备用。
1.2主要试剂FAM96A、β-actin一抗及二抗均购自英国Abcam公司; TRIzol试剂盒、逆转录试剂盒、SYBR Green荧光定量PCR试剂盒均购自大连TaKaRa生物技术有限公司;总蛋白抽提试剂盒、质粒提取试剂盒、Lipofectamine 2000转染试剂盒、ECL化学发光试剂盒及蛋白浓度检测试剂盒均购自美国Invitrogen公司;细胞凋亡检测试剂盒购自南京凯基生物公司;培养基、胎牛血清、胰酶、MTT均购自日本Sigma公司。人肝癌细胞系HepG2细胞、人正常胎肝L02细胞均保存于本院中心实验室。β-actin F:5′-TGAGACCTTCAACACCCCAG-3′,R:5′-GCCAT CTCTTGCTCGAAGTC-3′;FAM96A F:5′-GCAAAGCA CGCTGGAACT-3′,R:5′-GGCCGAGACAAGCCTAAA-3′均由上海英骏生物工程技术服务公司设计并合成。本研究所需pcDNA3.1-myc-FAM96A重组质粒由华中科技大学同济医学院生物化学与分子生物学系田俊教授惠赠。
1.3Real-timePCR检测FAM96A基因表达提取60例结肠癌组织及配对癌旁组织的总mRNA(参照TRIzol试剂盒操作说明书)。按照逆转录试剂盒操作说明书将mRNA逆转录成cDNA,-20 ℃低温保存备用。Real-time PCR总反应体系为20 μl:2×SYBR Green mix缓冲液10 μl+上下游引物各0.6 μl(浓度为:10 μmol/L)+cDNA 2 μl+DEPC水6.8 μl。反应条件为变性、退火及延伸。本实验中,肝癌组织和细胞所用FAM96A 和β-actin引物、Real-time PCR总反应体系和设定的反应条件均相同,由Real-time PCR仪自动生成数据。
1.4Westernblot法检测FAM96A蛋白表达分别称取0.08~0.10 g结肠癌组织和配对癌旁组织,提取蛋白并定量。各组取120 μg上样,聚丙烯酰胺凝胶电泳分离。PVDF膜转移蛋白, 封闭一抗,标记二抗,化学发光法显影检测。
1.5MTT法检测HCT116细胞活性取对数生长期细胞接种于96孔板,24 h后采用脂质体转染法瞬时转染。分为FAM96A组(转染pcDNA3.1-myc-FAM96A质粒)和对照组(转染pcDNA3.1-vector空白质粒)。酶标仪检测各孔吸光度(absorbance, A)值,绘制细胞生长曲线,其中横纵坐标分别为时间和A值。
1.6流式细胞仪检测HCT116细胞凋亡将细胞收集后,按照说明书加5 μl Annexin V-FITC和5 μl PI混匀,用流式细胞仪检测并分析细胞凋亡率。

2 结果
2.1FAM96A在结肠癌中的表达Real-time PCR检测结果显示:FAM96A mRNA在60例新鲜结肠癌组织和癌旁组织中均有表达,表达量分别为(0.376±0.169)、(1.009±0.248), 差异有统计学意义(t=16.328,P<0.05),即FAM96A mRNA在结肠癌组织中的表达显著低于癌旁组织。Western blot检测结果表明:结肠癌组织及癌旁组织中均可检测到FAM96A蛋白表达,且FAM96A在结肠癌组织中的蛋白表达同样低于癌旁组织。见图1。
2.2FAM96A蛋白表达水平与结肠癌临床病理特征之间的关系FAM96A蛋白表达差异与本研究中60例结肠癌患者的浸润深度、淋巴结转移、是否发生远处转移及TNM分期之间差异有统计学意义(P<0.05),与患者性别、年龄、肿瘤大小及分化程度之间差异无统计学意义(P>0.05)。见表1。
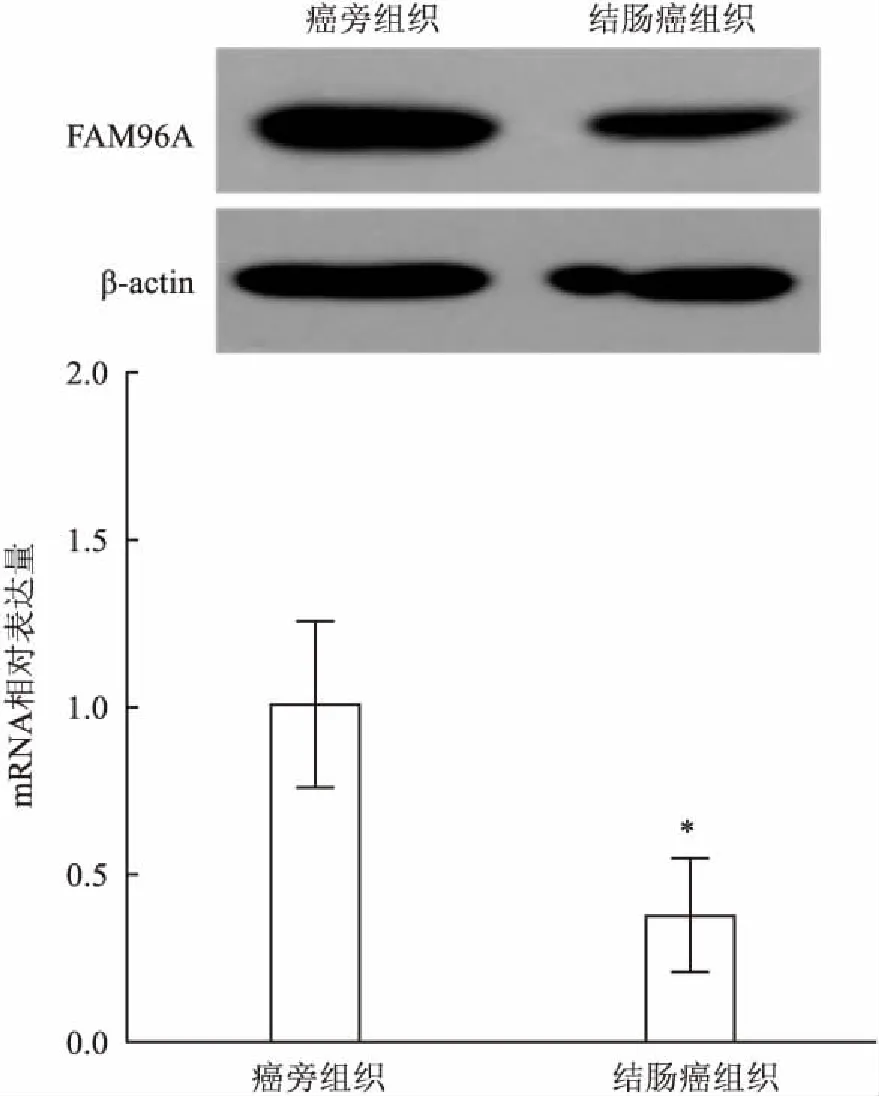
图1 FAM96A在结肠癌及癌旁组织中的表达
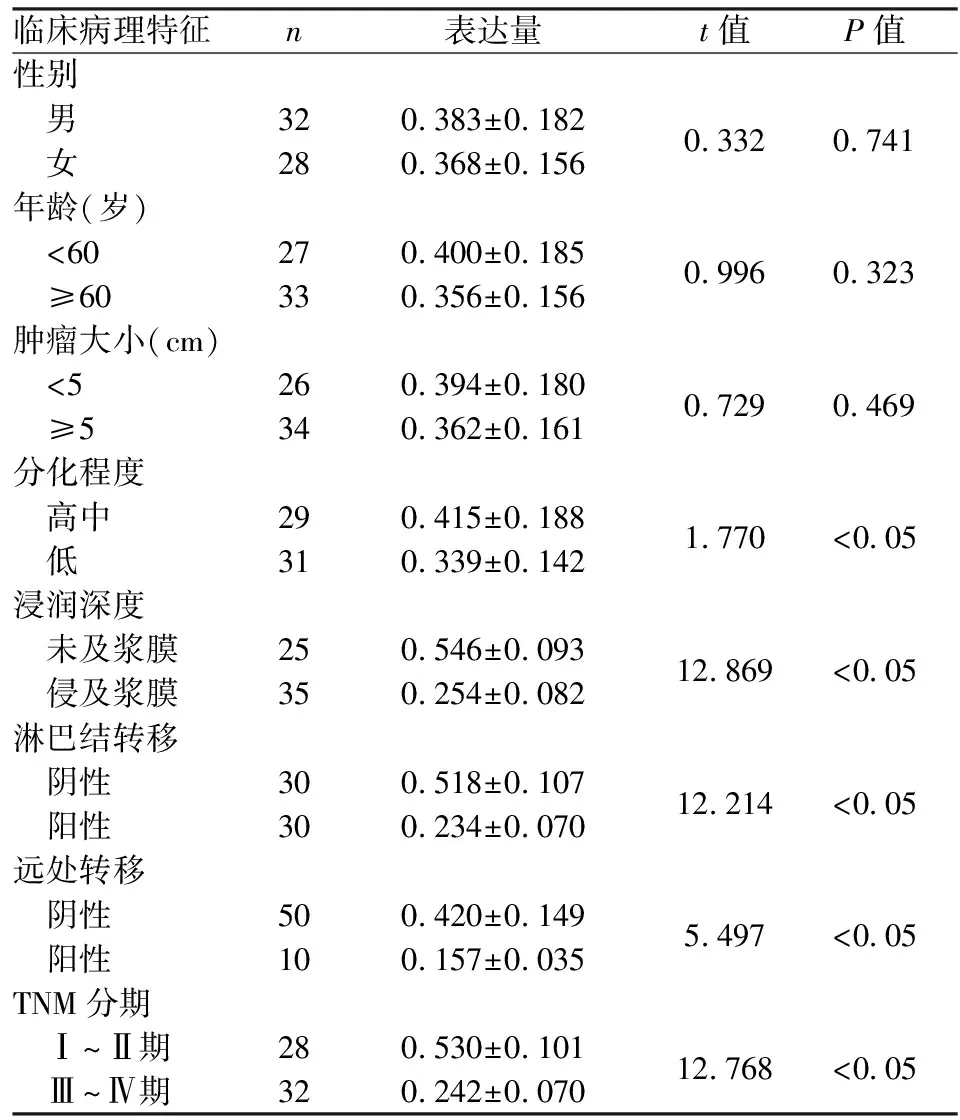
临床病理特征n表达量t值P值性别 男320.383±0.1820.3320.741 女280.368±0.156年龄(岁) <60270.400±0.1850.9960.323 ≥60330.356±0.156肿瘤大小(cm) <5260.394±0.1800.7290.469 ≥5340.362±0.161分化程度 高中290.415±0.1881.770<0.05 低310.339±0.142浸润深度 未及浆膜250.546±0.09312.869<0.05 侵及浆膜350.254±0.082淋巴结转移 阴性300.518±0.10712.214<0.05 阳性300.234±0.070远处转移 阴性500.420±0.1495.497<0.05 阳性100.157±0.035TNM分期 Ⅰ~Ⅱ期280.530±0.10112.768<0.05 Ⅲ~Ⅳ期320.242±0.070
2.3MTT法检测HCT116细胞活性实验结果表明:FAM96A组A值显著低于对照组(P<0.05),即过表达FAM96A可显著抑制HCT116细胞增殖,见图2。
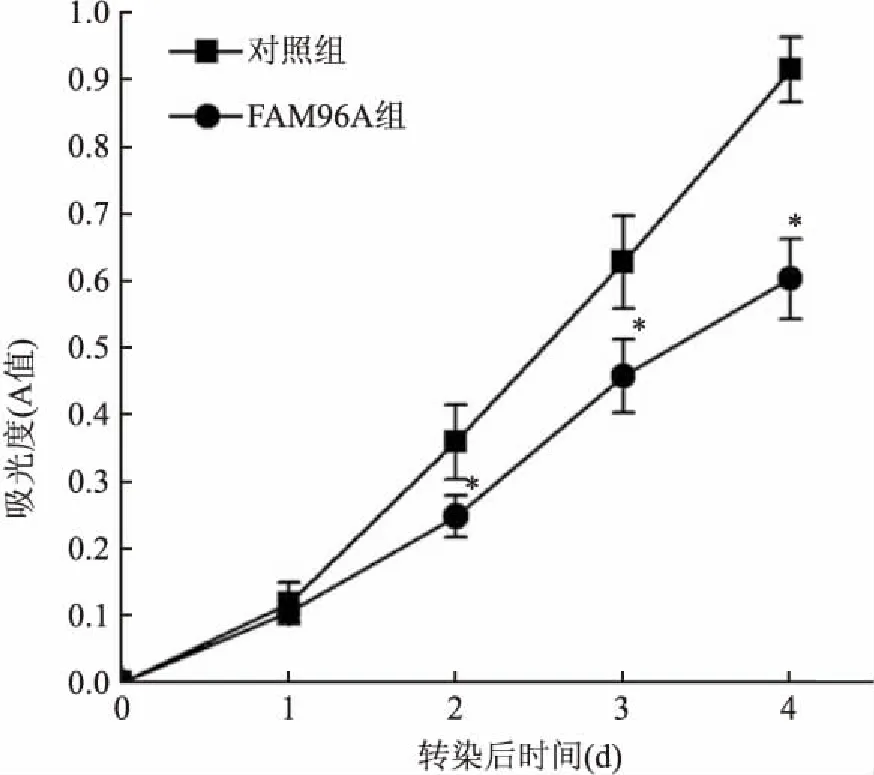
图2 HCT116细胞生长曲线
2.4流式细胞仪检测HCT116细胞凋亡率过表达FAM96A组的细胞凋亡率显著高于对照组[(38.44±3.38)%vs(4.16±0.56)%,t=30.015,P<0.05],即过表达FAM96A可诱导HCT116细胞凋亡。见图3。
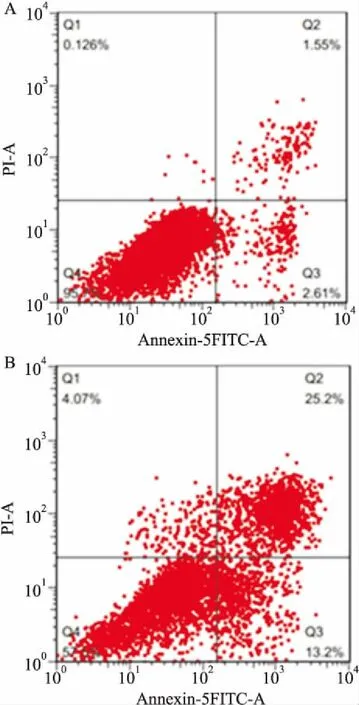
图3 过表达FAM96A对HCT116细胞凋亡的影响
3 讨论
FAM96A与FAM96B属同源蛋白,均含有DUF59结构域,具有50%的序列同一性,不同的是FAM96A具有预测的信号序列而FAM96B没有,均为分子量18 ku的小分子蛋白,均通过相互作用蛋白发挥功能,具体机制不明确。研究[3]表明FAM96A与CIA2A组成蛋白复合物CIA2A-FAM96A维持细胞铁稳态。目前国内外研究[4-6]显示:FAM96B在结肠癌组织中低表达且抑制结肠癌细胞HCT-116增殖并促进凋亡,然而关于FAM96A在结肠癌中的功能研究报道甚少。因此,本研究旨在探索FAM96A在结肠癌组织中的表达差异及细胞生物学功能,以期为结肠癌诊断和治疗提供新的靶点和思路。
分析基因与肿瘤关系的基础是观察肿瘤组织及配对癌旁正常组织的差异性表达,异常表达的基因可认为是潜在的新一类控制细胞增殖和凋亡的癌基因或抑癌基因,并在肿瘤的发生发展中发挥关键作用[7]。本研究中收集60例结肠癌组织及相应配对癌旁组织标本,分别采用Real-time PCR和Western blot技术检测FAM96A在基因和蛋白水平的表达差异。检测结果表明:FAM96A在结肠癌组织中的基因和蛋白表达水平均显著低于癌旁组织。由此可见, FAM96A在结肠癌发生发展过程中具有抑癌基因特性,抑制结肠癌的发生发展。Schwamb et al[2]认为FAM96A作为新的抑癌基因,在胃肠道间质瘤发生发展中发挥重要的肿瘤抑制作用。本实验结果与其研究结论基本一致。
目前结肠癌在我国的发病率和死亡率呈逐年上升趋势,严重威胁人类健康与生命财产安全[8]。导致结肠癌低生存率的关键因素在于肿瘤的侵袭和转移[9],其中肝脏转移是最常见的远处转移[10]。因此,如能阻断结肠癌转移途径,则能大大提高结肠癌患者的生存率。本研究通过对FAM96A蛋白表达与结肠癌临床病理特征之间的相关性进行分析,得出FAM96A在结肠癌组织中低表达,与结肠癌浸润深度、淋巴结转移、远处转移及TNM分期显著相关。提示FAM96A可能是一个与结肠癌浸润、转移相关的分子指标,在结肠癌发展、浸润及转移中起到关键的抑制作用。
为进一步明确FAM96A在结肠癌发生发展中的功能,本研究采用脂质体瞬时转染法将FAM96A质粒转染至结肠癌细胞系HCT116细胞中,观察FAM96A基因过表达对结肠癌细胞生物学功能的影响。Schwamb et al[2]报道FAM96A是胞质铁硫蛋白簇聚集系统成员之一,在调节铁稳态方面起到关键作用。通过线粒体凋亡途径对间质瘤发挥促凋亡作用。过表达FAM96A可增强间质瘤细胞GIST882凋亡敏感性,并在体内和体外抑制肿瘤生长,FAM96A低表达或表达沉默将导致间质瘤的发生。同时,Ito et al[4]报道FAM96B与MMS19、Ciao 1、XPD等组成蛋白复合物MMXD,定位于纺锤体,在有丝分裂染色体正常分离中发挥关键作用,FAM96B基因沉默可导致结肠癌细胞系HCT116细胞不能正常有丝分裂,异型细胞核堆积,细胞凋亡,是癌症潜在的诊断和治疗靶点。本研究中MTT及流式细胞仪检测结果提示:过表达FAM96A可抑制结肠癌细胞系HCT116细胞增殖,并显著诱导其凋亡。证实FAM96A促进结肠癌细胞系HCT116凋亡,但具体作用机制尚待进一步阐明,与国外文献报道基本一致。
[1] Provenzale D, Jasperson K, Ahnen D J, et al. Colorectal cancer screening, version 1. 2015[J]. J Natl Compr Canc Netw, 2015, 13(8):959-68.
[2] Schwamb B, Pick R, Fernandez S B, et al. FAM96A is a novel pro-apoptotic tumor suppressor in gastrointestinal stromal tumors[J]. Int J Cancer, 2015, 137 (6) : 1318-29.
[3] Stehling O, Mascarenhas J, Vashisht A A, et al. Human CIA2A-FAM96A and CIA2B-FAM96B integrate iron homeostasis and maturation of different subsets of cytosolic-nuclear iron-sulfur proteins[J]. Cell Metal, 2013, 18(2):187-98.
[4] Ito S, Tan L J, Andoh D, et al. MMXD, a TFIIH-independent XPD-MMS19 protein complex involved in chromosome segregation[J]. Mol Cell, 2010, 39(4):632-40.
[5] 蔡 逊,马丹丹,田 俊,等. FAM96B基因在结肠癌组织中低表达且抑制癌细胞增殖并诱导其凋亡[J]. 华中科技大学学报(医学版),2016,45(2):132-5.
[6] 蔡 逊,马丹丹,张智勇,等. 96序列相似的家庭成员B基因在结肠癌组织中的表达及其临床意义[J]. 中华实验外科杂志,2016,33(3):567-70.
[7] Si M L, Zhu S, Wu H, et al. MiR-21-mediated tumor growth[J]. Oncogene, 2007, 26(19): 2799-803.
[8] Kin B N, Yamamoto H, Ikeda K, et al. Methylation and expression of P16NK4 tumor suppressor gene in primary colorectal cancer tissues [J]. Int J Oncol, 2005, 26(5):1217-26.
[9] Parkin D M, Bray F, Ferlay J, et al. Global cancer statistics,2002[J]. CA Cancer J Clin, 2005, 55(2):74-108.
[10] Hanahan D, Weinberg R A. The hallmarks of cancer[J]. Cell, 2000, 100(1):57-70.
