CXCL12/CXCR4生物学轴及AMD3100对舌鳞癌Tca8113细胞侵袭行为的影响
2018-07-03王钢董国伟
王钢 董国伟
舌癌是我国最常见的口腔颌面部恶性肿瘤之一,恶性程度高,浸润性强[1]。本实验旨在通过应用CXCL12及其抑制剂 AMD300,作用于体外培养的Tca8113细胞,应用PCR检测Tca8113细胞表面CXCR4受体mRNA表达量;通过Transwell小室侵袭实验研究该学轴对Tca8113细胞侵袭转移过程中所发挥的作用及AMD3100对此过程的干预。
1 材料与方法
1.1 细胞株
舌鳞癌细胞Tca8113购自中国科学院上海生命科学研究院。
1.2 主要材料
培养基 RPMI 1640、胎牛血清(杭州四季青公司);CCK-8试剂(Sigma,美国);DMSO(二甲亚砜)、CXCL12因子、AMD3100、CXCR4抗体(北京博奥森生物技术有限公司);Taq DNA聚合酶(Transgene)、Matrigel(BD公司,美国);Transwell小室及配套孔板(Costar公司,美国)等。
1.3 实验方法
1.3.1 细胞培养 Tca8113细胞于含10% 胎牛血清的RPMI 1640培养液(含100 U/ml青霉素和100 μg/ml链霉素),37℃、5%CO2的饱和湿度孵箱中培养,每2~3 d换液1次,0.25%胰蛋白酶消化传代。
1.3.2 逆转录PCR 检测一定浓度的CXCL12及其特异性抑制剂AMD3100对Tca8113细胞CXCR4受体mRNA表达量的影响,分4组:对照组;CXCL12因子刺激组(CX组),调整CXCL12因子的终浓度为100 ng/ml;单独 AMD3100组(AMD组)(终浓度为 1 μg/ml);AMD3100干预组(1μg/ml),AMD3100预先孵育细胞1 h后加入终浓度为100 ng/ml CXCL12因子(AM+CX组),干预后培养48 h,提取细胞的总RNA;按照逆转录试剂盒说明书扩增目的基因。
1.3.3 侵袭转移 采用铺有Matrigel的 Transwell小室研究Tca8113细胞的侵袭转移力。实验细胞分组同上,用含0.1%BSA的无血清RPMI 1640稀释重悬,计数,调整细胞浓度;抽取200μl细胞悬液接种于transwell上室内,transwell下室加入含有20%FBS的RPMI 1640培养液600μl;孵育24 h,用棉签轻轻擦掉未穿过膜的细胞及膜面的Matrigel,PBS漂洗,多聚甲醛固定,苏木精染色15 min,流水冲洗10 min,盐酸酒精分化2 s,自来水冲洗10 min,然后置于空气中风干。用手术刀将膜切下后,盖上盖玻片,中性树胶封片,待过夜后干燥即可长期保存。倒置显微镜下,随机选取膜上5个不同视野计数穿过膜的细胞数,重复3次,求平均值。
1.4 统计学处理
应用SPSS 17.0统计软件进行数据处理,实验数据均以珋x±s表示。计量资料进行单因素方差分析,两两分析比较结果。
2 结果
2.1 逆转录PCR
CXCR4受体 mRNA的表达量以 CXCR4受体DNA条带灰度值和内参照基因GAPDH的DNA条带灰度值的比值表示(表1,图1)。CXCR4受体基因的灰度值与内参的灰度值的比值代表CXCR4 mRNA的表达量。
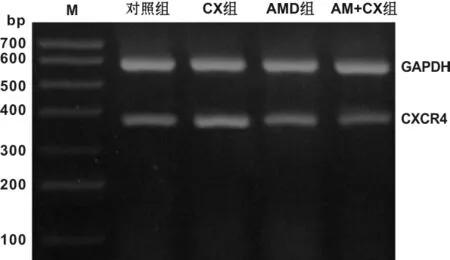
图1 CXCR4 mRNA的表达Fig 1 CXCR4 mRNA expression of the 4 groups
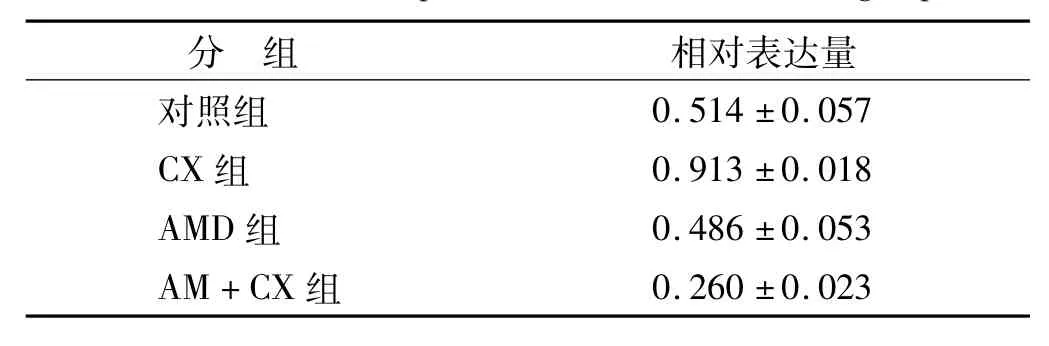
表1 各组细胞CXCR4 mRNA的表达Tab 1 CXCR4 mRNA expression of the cells of the 4 groups
2.2 侵袭实验
体外侵袭实验表明:CXCL12因子刺激组穿膜细胞数目最多,AMD3100预先孵育组穿膜细胞数目最少,对照组和单独AMD3100的穿膜细胞数目差别不明显。预先孵育CXCR4受体的拮抗剂AMD3100可以对抗CXCL12因子对肿瘤细胞的趋化作用,使穿膜细胞数低于CXCL12刺激组。计算趋化指数(CI),CI=趋化因子CXCL12组平均穿膜的细胞总数/对照组平均穿膜的细胞总数,侵袭抑制率(IR),IR=(趋化因子CXCL12组平均穿膜的细胞总数-抑制剂预先孵育组平均穿膜的细胞总数)/趋化因子CXCL12组平均穿膜细胞总数×100%。
CXCL12因子刺激组穿膜细胞数目为平均(75.1±2.9)个,而AMD3100预先孵育组穿膜细胞平均数目减少为32.2 ±1.9,经 SPSS统计分析,CXCL12 因子刺激组与AMD3100预先孵育组的穿膜细胞数目差异有统计学意义(P<0.05),单独AMD3100组和对照组之间穿膜细胞数目差异无统计学意义(P>0.05)(表2,图2)。

表2 各组穿膜细胞数(珋x±s)Tab 2 The invaded cells throught the transwell membrane of the 4 groups(珋x±s)
3 讨论
CXCL12/CXCR4生物学轴是指由趋化因子CXCL12,与CXCR4互相连接而形成的一个偶联分子对[2],此生物学轴与多种恶性肿瘤细胞的侵袭、器官特异性转移等密切相关[3-4]。
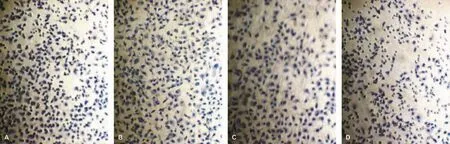
A:对照组;B:CX组;C:AMD组;D:AM+CX组图2 4组穿膜细胞 (苏木精染色,×100)A:Control group;B:CX group;C:AMD group;D:AM+CX groupFig 2 The invaded cells throught the transwell membrane of the 4 groups (×100)
肿瘤细胞高表达特异的趋化因子受体,而特异性的器官高表达其相应的配体,趋化因子与其受体相互结合,导致出现癌细胞器官特异性的转移。Muller等[5]研究显示:涎腺腺样囊性癌细胞可检测到,CXCR4 受体的高表达,AlmoftiA 等[6]和李五一等[7]研究结果显示口腔鳞癌细胞表达CXCR4受体。越来越多的研究证实:CXCR4受体可以在多种肿瘤细胞表面表达,与相应的趋化因子相互作用,相互结合,影响肿瘤细胞的相关生物学行为。
为了研究证实Tca8113细胞高表达CXCR4受体,从基因水平来检测Tca8113细胞表面CXCR4的表达。通过应用逆转录PCR,基因水平检测CXCR4受体mRNA发现,4组均表达CXCR4受体mRNA,刺激组最高,抑制剂AMD3100预先干预组表达量最低。这说明正常的Tca8113细胞表面表达CXCR4受体,在CXCL12的相关作用下,肿瘤细胞表达的CXCR4mRNA及其翻译表达的蛋白质都相应的高表达,证实了CXCR4受体在Tca8113细胞的高表达,为本实验研究奠定了一个坚实的实验基础。同时本实验也观察到单独应用AMD3100对CXCR4受体的表达无明显抑制作用,关于此方面的研究还很少,还需进一步的研究探讨。
Muller等[5]发现,趋化因子 CXCL12可以促使高表达CXCR4受体的涎腺腺样囊性癌细胞定向迁移。邱际华等[8]对鼻咽癌细胞的研究结果示:CXCL12对鼻咽癌的侵袭转移具有促进作用,同时这种促进作用可以被CXCR4受体的特异性拮抗剂AMD3100所抑制。Kajiyama等[9]的研究显示 CXCL12/CXCR4生物学轴对卵巢癌和乳腺癌细胞的生长及转移起非常重要的作用,而AMD3100则能够明显抑制肿瘤细胞的转移。
本实验通过Transwell小室及应用Matrigel构建与天然基底膜的结构十分相似人工基底膜,具有侵袭能力的肿瘤细胞在下室的趋化因子诱导下穿过滤膜,模拟了肿瘤细胞在机体内侵袭基底膜的过程来研究探讨该学轴对Tca8113细胞侵袭性的影响。100 ng/ml的CXCL12因子是能促进Tca8113细胞增殖的有效浓度[10];本实验研究显示一定浓度的 CXCL12因子对Tca8113细胞的侵袭转移具有促进作用,CXCL12因子刺激组,其穿过小室膜的细胞数目多于对照组,同时应用AMD3100预先干预组[10],其穿过小室膜的细胞数目少于空白对照组,说明CXCL12因子对Tca8113细胞的侵袭转移的促进作用可以被CXCR4受体的拮抗剂所抑制,说明CXCR12因子对Tca8113细胞的侵袭转移的促进效应是通过CXCR4受体来介导实现的。由此我们认为,淋巴结、肺组织等这些容易发生转移的器官,其可能高表达CXCR4受体,恶性肿瘤细胞在趋化因子的趋化牵引作用下,逆浓度梯度出现器官特异性转移。关于Tca8113细胞的具体的器官特异性迁移机制还不甚明了,还需进一步研究证实。AMD3100作为CXCL12因子的特异性拮抗剂,其可以竞争性阻断CXCL12因子与CXCR4的结合,从而阻断CXCL12/CXCR4生物学轴的信号传导通路,导致了Tca8113细胞侵袭转移能力的减弱。
综上所述,本实验中利用一定浓度的CXCL12因子及其抑制剂AMD3100,作用于体外培养的Tca8113细胞,证明了CXCL12/CXCR4生物学轴在肿瘤细胞体外侵袭转移方面中发挥着重要的促进作用。关于CXCR4受体的抑制剂AMD3100,其阻断CXCL12/CXCR4生物学轴的具体机制,以及其作为一种新的有望成为抗肿瘤转移的药物,其作用机制及应用前景还需要进一步的研究和证实。
[1] 邱蔚六,张震康,张志愿.口腔颌面外科学[M].6版.北京:人民卫生出版社,2011:230-231.
[2] Wu X,Lee VC,Chevalier E,et al.Chemokine receptors as targets for cancer therapy[J].Curr Pharm Des,2009,15(7):742-757.
[3] Cheng Z,Zhou S,Wang X,et al.Characterization and application of two novel monoclonal antibodies against human CXCR4:Cell proliferation and migration regulation for glioma cell line in vitro by CXCR4/SDF-1alpha signal[J].Hybridoma(Larchmt),2009,28(1):33-41.
[4] Balkwill F.The significance of cancer cell expression of the chemokine receptor CXCR4[J].Semin Cancer Biol,2004,14(3):171-179.
[5] Muller A,Sonkoly E,Eulert C,et al.Chemokine receptors in head and neck cancer:Association with metastatic spread and regulation during chemotherapy[J].Int J Cancer,2006,118(9):2147-2157.
[6] Almofti A,uchida D,Begum NM,et al.The clinicopathological significance of the expression of CXCR4 protein in oral squamous cell carcinoma[J].Int J Oncol,2004,25(1):65-71.
[7] 李五一,徐萌,刘建国,等.趋化因子受体CXCR4在口腔颌面部恶性肿瘤中表达的研究[J].口腔医学研究,2011,27(5):411-413.
[8] 邱际华,刘求真,陈丽,等.CXCR4/SDF21对鼻咽癌细胞增殖与迁移能力的影响[J].第三军医大学学报,2009,31(7):598-600.
[9] Lapteva N,Yang AG,Sanders DE,et al.CXCR4 knockdown by small interfering RNA abrogates breast tumor growth in vivo[J].Cancer Gene Ther,2005,12(1):84 -89.
[10] 刘纪雷,董国伟,韩新光.CXCL12/CXCR4生物学轴对舌鳞癌Tca8113细胞增殖行为的影响及AMD3100对其的干预[J].口腔医学研究,2013,29(6):532-534,537.
