新型胶原膜的研制及降解性能初探
2018-07-03钮春子程浩德李宇李德华
钮春子 程浩德 李宇 李德华
引导骨再生 (GBR),是种植医学上用以增加缺牙区骨量的重要技术,是口腔种植医学发展过程中的里程碑。其成功的关键在于利用屏障膜隔绝外部的上皮和结缔组织,稳定血凝块,促进血管再生和成骨细胞的增殖,实现骨再生[1-2]。胶原膜作为一种可生物降解的屏障膜,因其良好的生物相容性、促进止血和伤口愈合,在临床上应用广泛[3-4]。不同的胶原原料种类、提取方法、加工成膜技术以及是否使用人工交联等,都会影响胶原膜的性能[5-6]。人工交联可以提高胶原膜的酶稳定性,增强膜的机械强度,但残留的交联剂通常具有细胞毒性,抑制组织愈合和血管化进程[7-8]。Bio-Gide膜是目前临床上应用广泛的非交联胶原膜,大量研究证实了其在引导骨再生中促进缺损区成骨的可靠性,但其价格昂贵且降解速率偏快,有专家建议覆盖双层膜以增加其屏障时间。本实验采用新的成膜技术,以牛皮来源的I型胶原为原料,利用溶剂挥发法研制一种新型胶原膜,以期延缓胶原的降解,延长胶原膜的屏障时间。
1 材料与方法
1.1 实验材料和试剂
本实验使用提取自牛皮的I型胶原,由常州药物研究所提供;Tris-盐酸缓冲液(TBS,北京雷根生物技术有限公司产品,批号0906A17);I型胶原酶(collagenase type I,C0130,Sigma-Aldrich,美国)。
1.2 实验方法和步骤
1.2.1 I型胶原膜的制备 将I型胶原溶于稀盐酸,形成胶原混悬液,离心除去混悬液中的小分子和气泡。将胶原匀浆置于真空干燥箱中梯度真空干燥,形成结构致密的I型胶原膜。包装后环氧乙烷灭菌:温度37℃、相对湿度40%,环氧乙烷浓度1 000 mg/L,灭菌3 h。常温干燥环境下储存备用。
1.2.2 I型胶原膜的形貌观察及特征峰检测 将I型胶原膜的表面、横纵界面形成自然断面,表面喷金、铂,扫描电子显微镜 (HITACHI,S-3400N,日本)观察其表面形貌;利用能谱仪 (EDAX-GENESIS,美国)分析其元素组成;采用傅里叶红外光谱仪 (SHIMADZU,FTIR-8400S,日本)分析检测胶原特征峰。
1.2.3 I型胶原膜的体外降解实验 实验组:I型胶原膜;对照组:Bio-Gide(BG)胶原膜;每组设3个重复样。将实验组和对照组的膜裁剪成5 mm×5 mm方形大小,分别置于1.5 ml离心管中,加入I型胶原酶溶液(1 mg/ml的 TBS溶液,含 0.005 mol/L CaCl2·2H2O)1 ml,于37℃恒温箱中进行酶解反应。分别于10、40 min后取出膜,立即用去离子水润洗3次,-80℃预冻24 h,-50℃真空冻干24 h。干燥后的膜表面喷金、铂,扫描电镜观察膜的孔径变化。
2 结果
2.1 I型胶原膜的形貌观察及特征峰检测结果
扫描电镜示I型胶原膜表面平坦,结构致密,无明显孔隙;放大可见胶原纤维典型的串珠样结构,纤维与纤维间紧密排列形成较粗的纤维束,无其他杂质结构;断面示胶原膜内部结构紧密,无明显分层(图1A~1D)。能谱分析示I型胶原膜的主要元素组成为C、O、N元素,第四处吸收峰为喷金、铂后的铂的吸收峰,无其余杂质成分(图1E)。傅里叶红外光谱分析示I型胶原膜、BG胶原膜上典型的胶原酰胺键吸收峰:3 400 cm-1附近(NH)、1 650 ~1 655 cm-1(C=O键)、1 480 ~1 600 cm-1(NH、CN)、1 200 ~1 360 cm-1(NH、CN),红色为BG胶原膜,蓝色为I型胶原膜(图 1F)。
2.2 I型胶原膜体外降解实验结果
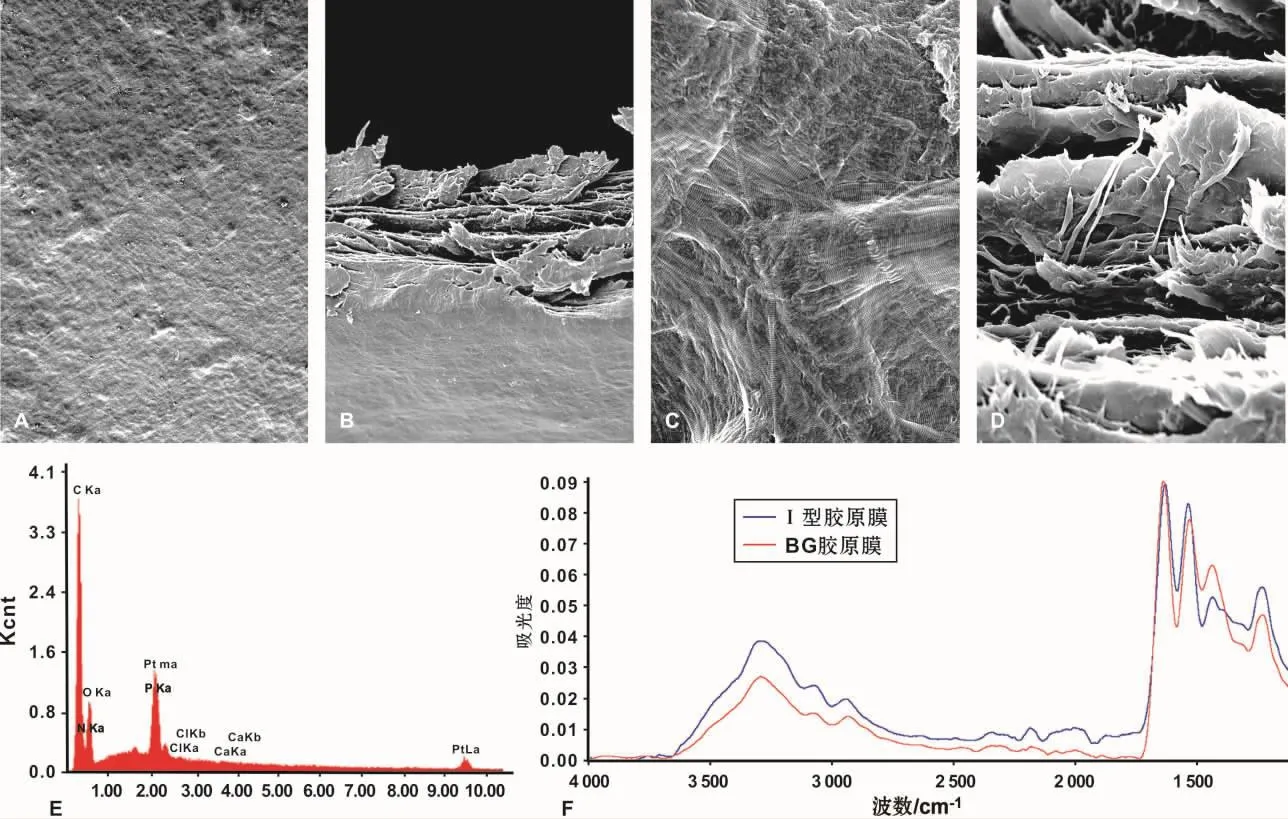
A~D:扫描电镜图(A:×100,B:×1000,C、D:×10 000);E:能谱分析图;F:傅里叶红外光谱分析图图1 I型胶原膜形貌结构及特征峰检测图A-D:SEM images(A: ×100,B:×1000,C,D: ×10 000);E:The energy spectrum analysis;F:Fourier infrared spectrum analysisFig 1 The structure and characteristic peak detection of the type I collagen membrane
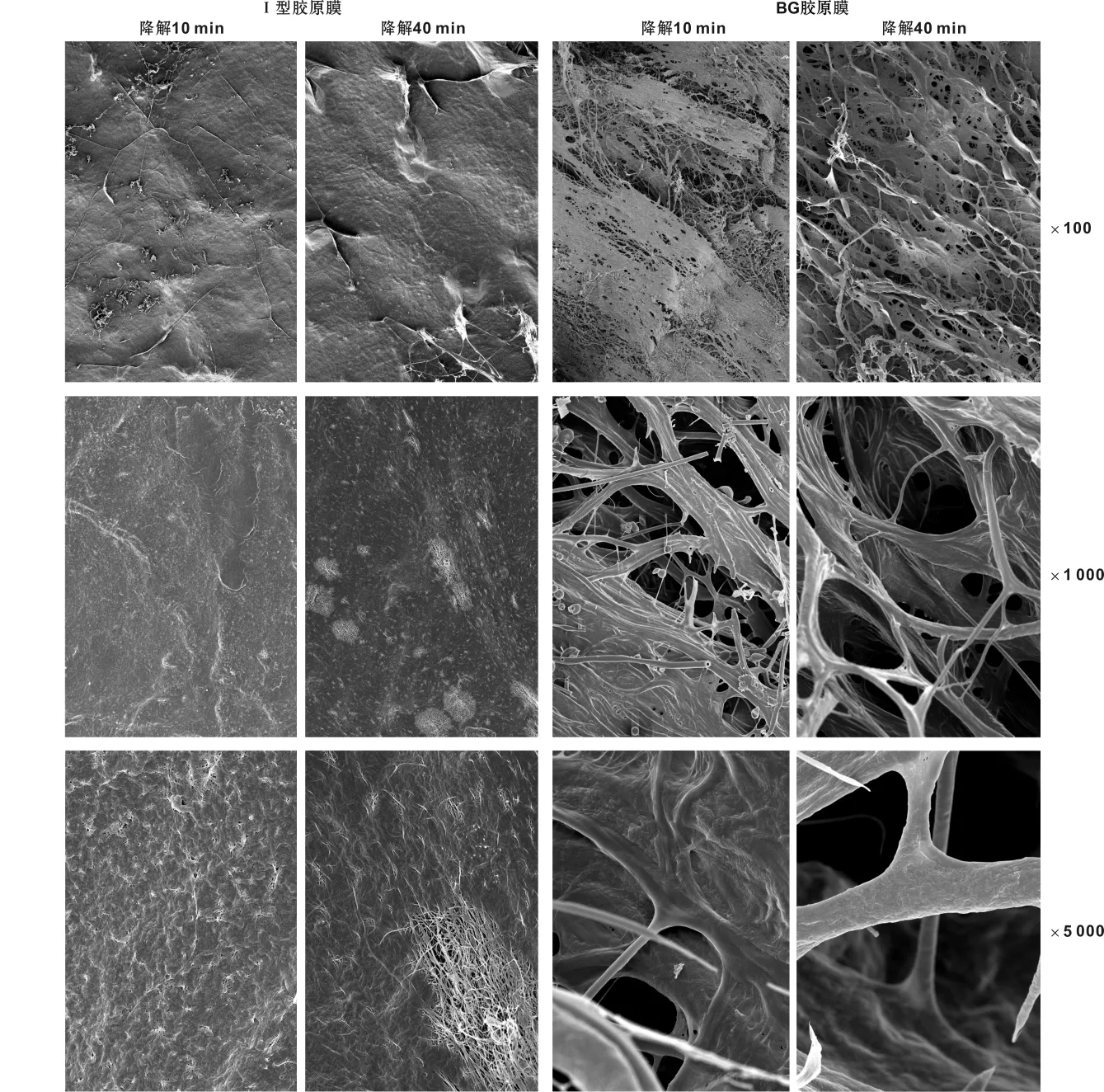
图2 I型胶原膜和BG胶原膜体外胶原酶降解后的孔隙变化图Fig 2 The pore size changes of the type I collagen membrane and BG membrane after degradation in vitro
在体外I型胶原酶的作用下,I型胶原膜和BG胶原膜均逐渐降解。降解10 min时,I型胶原膜结构致密,未见明显孔隙(图2);BG胶原膜致密层出现直径大于10μm的孔隙,且孔隙向其内部延伸(图2)。降解40 min时,I型胶原膜结构仍较完整,可见部分直径小于2μm的微小孔隙(图2);而此时BG胶原膜进一步降解,致密层的结构明显破坏,大的孔洞相互交通,膜的屏障作用显著减弱(图2)。该实验结果提示:此I型胶原膜的孔径变化明显慢于BG胶原膜。
3 讨论
GBR和GTR是基于成骨细胞和或牙周细胞增殖与分化的再生技术,利用屏障膜阻隔快速增殖的上皮和结缔组织,为缺损区的成骨细胞或牙周组织提供一个相对稳定的再生环境。通常认为在GTR中需要4周才能实现牙周再生[3,9];而成骨细胞需要4-6个月才能形成较成熟的新骨[10-11]。因此屏障膜应在上述时间内保持一定的完整性,才能真正发挥其屏障作用[12]。目前通常通过测量降解过程中膜的厚度、面积或质量的变化,来评价膜的降解程度[12-16]。膜剩余量的测量直观、方便,但其并不能直接反应膜的屏障作用。屏障膜作用的本质应体现在其在缺损区成骨过程中发挥的阻拦作用,成纤维细胞的直径约为10~15 μm,若在降解过程中若形成足够大的、贯穿全层的孔洞,则剩余的胶原膜亦无法发挥完整的屏障作用。
传统的冻干法制备的胶原膜具有较高的吸水膨胀率,且酶稳定性较差。本实验采用溶剂挥发法制备的I型胶原膜,结构致密。以I型胶原酶作为体外降解酶检测此胶原膜的酶稳定性[12,17-18]。降解 10 min 时 I型胶原膜表面未见明显孔隙,而BG膜的致密层已经出现大量直径大于10μm的孔隙;进行到40 min时,I型胶原膜表面出现少量直径小于2μm的微小孔隙,而此时BG膜的致密层可见大的孔洞相互交通向膜的内部延伸。BG膜的结构相对疏松,纤维束之间存在一定空隙,这使得胶原酶在破坏其表面的同时易于向其深层渗透,表层和深层均受到破坏,屏障作用大大减弱。因此尽管BG膜仍有大量剩余,但相互贯通的孔洞和塌陷的纤维可能已经无法阻止成纤维细胞的侵入。而I型胶原膜以其均匀的致密结构延缓了胶原酶的降解和渗透,在观察时间内仍保持完整的屏障作用。因此本实验结果提示此I型胶原膜的屏障作用明显强于BG膜。值得注意的是,体外降解实验存在一定局限性,无法完全模拟在体环境,仍需后续进一步动物实验检测此I型胶原膜的屏障作用。
4 结论
本实验通过溶剂挥发法制备结构致密的I型胶原膜,在体外胶原酶降解过程中呈较强的酶稳定性,屏障作用明显增强,为胶原膜的研究提供一个新的实验依据。
[1] Tal H,Pitaru S,Moses O,et al.Collagen gel and membrane in guided tissue regeneration in periodontal fenestration defects in dogs[J].J Clin Periodontol,1996,23(1):1-6.
[2] Melcher AH.On the repair potential of periodontal tissues[J].JPeriodontol,1976,47(5):256 -260.
[3] Bunyaratavej P,Wang HL.Collagen membranes:A review[J].J Periodontol,2001,72(2):215 -229.
[4] 曹良菊,唐玲,王汝丽.Bio-Oss和胶原膜治疗牙周炎重度垂直骨吸收的临床观察[J].实用口腔医学杂志,2008,24(6):867-870.
[5] Sheikh Z,Qureshi J,Alshahrani AM,et al.Collagen based barrier membranes for periodontal guided bone regeneration applications[J].Odontology,2017,105(1):1 -12.
[6] Patino MG,Neiders ME,Andreana S,et al.Collagen as an implantable material in medicine and dentistry[J].J Oral Implantol,2002,28(5):220 -225.
[7] Schwarz F,Rothamel D,Herten M,et al.Angiogenesis pattern of native and cross-linked collagen membranes:An immunohistochemical study in the rat[J].Clin Oral Implants Res.2006,17(4):403 -409.
[8] Rothamel D,Schwarz F,Sager M,et al.Biodegradation of differently cross-linked collagen membranes:An experimental study in the rat[J].Clin Oral Implants Res,2005,16(3):369-378.
[9] Becker W,Becker BE,Berg L,et al.New attachment after treatment with root isolation procedures:Report for treated Class III and Class II furcations and vertical osseous defects[J].Int JPeriodontics Restorative Dent,1988,8(3):8 -23.
[10] McAllister BS,Haghighat K.Bone augmentation techniques[J].JPeriodontol,2007,78(3):377 -396.
[11] Hutmacher DW,Kirsch A,Ackermann KL,et al.A tissue engineered cell-occlusive device for hard tissue regeneration——A preliminary report[J].Int JPeriodontics Restorative Dent,2001,21(1):49 -59.
[12] Bozkurt A,Apel C,Sellhaus B,et al.Differences in degradation behavior of two non-cross-linked collagen barrier membranes:An in vitro and in vivo study[J].Clin Oral Implants Res,2014,25(12):1403 -1411.
[13] Rothamel D,Schwarz F,Fienitz T,et al.Biocompatibility and biodegradation of a native porcine pericardium membrane:Results of in vitro and in vivo examinations[J].Int J Oral Maxillofac Implants,2012,27(1):146-154.
[14] Kozlovsky A,Aboodi G,Moses O,et al.Bio-degradation of a resorbable collagen membrane(Bio-Gide)applied in a double-layer technique in rats[J].Clin Oral Implants Res,2009,20(10):1116-1123.
[15] Moses O,Vitrial D,Aboodi G,et al.Biodegradation of three different collagen membranes in the rat calvarium:A comparative study[J].JPeriodontol,2008,79(5):905 -911.
[16] 王新木,董研,张存宝,等.几丁糖胶原可吸收膜的体内埋植及降解实验研究[J].实用口腔医学杂志,2010,26(3):298-301.
[17] Niu LN,Jiao K,Qi YP,et al.Intrafibrillar silicification of collagen scaffolds for sustained release of stem cell homing chemokine in hard tissue regeneration[J].FASEB J,2012,26(11):4517-4529.
[18] Song JH,Kim HE,Kim HW.Collagen-apatite nanocomposite membranes for guided bone regeneration[J].J Biomed Mater Res B Appl Biomater,2007,83(1):248 -257.
