LncRNA-7460调控炎症来源牙周膜干细胞成骨分化的研究
2018-07-03徐悦蓉邹宛桦秦文王丽颖刘佳金作林
徐悦蓉 邹宛桦 秦文 王丽颖 刘佳 金作林
人牙周膜间充质干细胞(human periodontal mesenchymal stem cells,hPDLSCs)是一种特异来源于人牙周组织的间充质干细胞,是修复牙周缺损的细胞来源[1]。但是,炎症微环境下的 hPDLSCs(periodontal mesenchymal stem cells from periodontitis patients,PPDLSCs)的成骨分化能力明显下降[2-3]。探索影响PPDLSCs成骨分化的因素,提高其成骨分化潜能,成为研究的方向。近年发现,长链非编码RNA(long noncoding RNAs)可能参与骨形成调控[4]。
实验组前期研究采用Arraystar人类LncRNA芯片(v3.0)成功的筛选出了健康微环境来源的牙周膜间充质干细胞(periodontal mesenchymal stem cells from healthy microenvironment,HPDLSCs)与 PPDLSCs中差异表达的lncRNA[5]。本实验选取位于第7号染色体19159555~19161539,长度为 692 bp的 lncRNA7460为研究对象。在细胞水平观察其调控能力,为改善PPDLSCs成骨分化能力,发展牙周再生治疗探寻新的方向。
1 材料与方法
1.1 实验试剂和仪器
1.1.1 主要实验试剂 胎牛血清、α-MEM 培养基(Gibco,美国);0.25%胰蛋白酶、抗坏血酸、β-甘油磷酸钠、地塞米松、I型胶原酶、茜素红、Polybrene(Sigma,美国);Trizol Reagent Life(Technologies,美国);RNase A(Invitrogen,美国);PrimeScriptTMRT Master Mix(TAKARA No.RR036A,美国);SYBR(TAKARA No.RR820A,美国);引物(上海锐博公司);lncRNA-7460过表达、抑制慢病毒、Enhanced Infection Solution(上海吉凯基因公司);碱性磷酸酶测试剂盒(南京建成生物有限公司);碱性磷酸酶染色试剂盒(碧云天)。
1.1.2 主要实验仪器 YJ-875型超净工作台(苏州净化设备厂);二氧化碳恒温孵箱(Forma,美国);倒置相差显微镜及照相系统、倒置荧光显微镜(Olympus,日本);离心机(Kubota2l00,日本);紫外线分光光度仪(Eppendorf,德国);Real-time PCR(Applied Biosystems,美国)。
1.2 实验方法
1.2.1 选取 HPDLSCs、PPDLSCs样本,原代培养 自10位31~41岁的健康志愿者取得HPDLSCs的牙齿样本,PPDLSCs牙齿样本取自28~40岁的10位慢性牙周炎志愿者,牙槽骨吸收大于根长1/2。离心收集根中1/3牙周膜组织块,I型胶原酶37℃消化1 h。含10%胎牛血清的α-MEM于37℃、5%CO2条件孵箱培养。原代细胞培养至细胞融合达80%时,低密度传代。
1.2.2 实时荧光定量聚合酶链反应 据Trizol试剂说明抽提细胞总RNA,控制RNA浓度在300~500 ng/μl,A260/A280为1.8 ~2.0。据试剂说明书反转录生成cDNA,进行qPCR检测。qPCR反应条件:预变性:95℃,30 s,1 Cycle;PCR反应:95℃ 5 s,60℃ 20 s,40 Cycles;融解曲线分析:95℃ 0 s,65℃ 15 s,95℃ 0 s。实验所用引物序列如表1所示。
1.2.3 lncRNA-7460过表达、抑制慢病毒转染至细胞lncRNA-7460过表达、抑制慢病毒委托上海吉凯基因化学技术有限公司构建,根据转染说明行PPDLSCs转染。3 d后倒置荧光显微镜观察,提取细胞RNA,RT-PCR验证转染效果及成骨基因表达情况。行成骨诱导,7 d后分别行RT-PCR验证成骨基因表达情况、ALP染色及活性检测。成骨诱导21 d行茜素红染色及定量测定。
1.2.4 成骨分化试验及茜素红染色 成骨培养液:含10%胎牛血清α-MEM培养基,加 β-甘油磷酸钠10 mmol/L、抗坏血酸 50 g/ml、地塞米松 1 × 10 mol/L。PPDLSCs成骨培养第1、7、14、21天提取细胞总RNA,21 d开始茜素红染色;茜素红染液:1 g茜素红溶于100 ml蒸馏水。成骨诱导21 d PPDLSCs,多聚甲醛(4%)于室温固定,茜素红染液染色20 min。观察并定量分析;茜素红定量:六孔板每孔加入1.0 ml SDS。30 min后,吸取0.10 ml于520 nm分析吸光度。

表1 引物序列Tab 1 Primer sequences
1.2.5 ALP染色以及 ALP活性测定 多聚甲醛(4%)于室温固定成骨诱导7 d的PPDLSCs,ALP染液染色,37℃,5%CO2,30 min避光孵育后观察;成骨诱导7 d的PPDLSCs破碎,与ALP活性测定工作液一起加入96孔板,37℃,5%CO2孵育30 min,加显色液。酶联免疫检测仪520 nm检测样品吸光度,记录数据。
1.3 统计学分析
数据均以珋x±s表示,用SPSS 13.0软件(SPSS,Inc.,Chicago,IL,USA)进行处理。单向方差分析法分析数据,P<0.05表示统计学上存在显着性差异。
2 结果
2.1 确定 lncRNA-7460为 PPDLSCs成骨分化相关lncRNA
据本研究组前期基因芯片结果,选6个PPDLSCs中表达明显下调的lncRNA为筛选目标。qPCR检测成骨培养7 d后各lncRNA表达变化(图1),发现lncRNA-7460上调10倍以上,将其作为研究目标。

图1 PPDLSCs成骨诱导7 d lncRNAs的变化Fig 1 lncRNA expression of PPDLSCs after osteogenic differentiation for 7 d
2.2 lncRNA-7460在PPDLSCs成骨分化不同时间点的表达
实验观察PPDLSCs成骨诱导1~21 d的表达情况。发现lncRNA-7460的表达在成骨诱导后的1、7 d不断升高,14、21 d的表达量虽下降,但仍高于成骨前(图 2)。
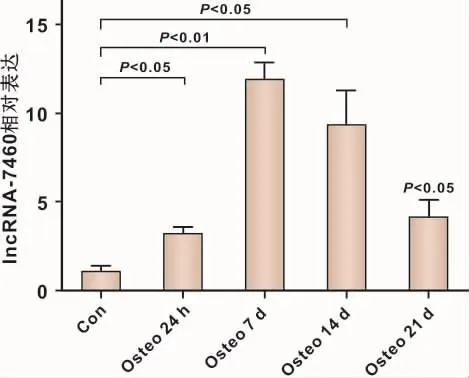
图2 PPDLSCs成骨诱导过程中lncRNA-7460的表达变化Fig 2 The expression of lncRNA-7460 at different time of osteogenic induction in PPDLSCs
2.3 lncRNA-7460过表达慢病毒感染PPDLSCs
转染3 d后,荧光显微镜可观察到PPDLSCs中绿色荧光染色(图 3A)。qPCR显示 PPDLSCs感染 lncRNA-7460过表达慢病毒后,lncRNA-7460的表达相对空病毒转染组升高达10.08倍(图3B)。
2.4 lncRNA-7460下调慢病毒可以成功转染 PPDLSCs
为筛选高效lncRNA-7460下调慢病毒,构建了3个lncRNA-7460下调慢病毒,分别是58380-1、58381-1、58382-1。转染 3 d后(图 4A)qPCR检测发现,58382-1抑制效率最高(图4B),用于后续试验。
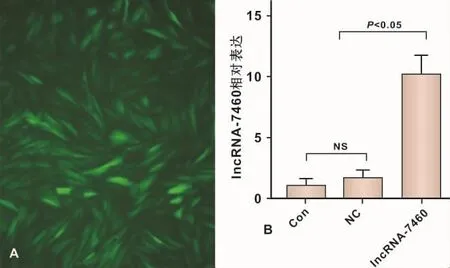
A:荧光显微镜观察(×200);B:量化分析图3 lncRNA-7460过表达慢病毒转染效率A:Fluorescence microscope observation(×200);B:Quantitative analysisFig 3 The infection efficiency of lncRNA-7460-overexpressing lentiviral into PPDLSCs
2.5 lncRNA-7460可以在体外培养条件下,促进PPDLSCs的成骨分化
PPDLSCs转染lncRNA-7460过表达慢病毒后,成骨培养7 d,qPCR检测成骨相关基因表达情况。3个标志基因Runx2,ALP,OCN的mRNA均明显升高(图5A)。ALP染色和ALP活性检测证明过表达组的ALP含量高于对照组(图5C、5D)。成骨诱导21 d后,过表达组形成更多的钙结节(图5C、5E)。
相反,lncRNA-7460下调组PPDLSCs的成骨相关基因下调(图5B);ALP表达量和钙结节的形成量也明显下降(图5C~5E)。
3 讨论
牙周炎是由细菌引起的牙周组织慢性感染性疾病,是导致成年人牙齿丧失的主要原因[6]。修复重建已被破坏的牙周组织的牙周再生治疗依赖干细胞,生长因子以及细胞外基质支架[7]。
hPDLSCs是一种来源于牙周膜组织的间充质干细胞,特定培养条件下可向骨组织、脂肪组织、软骨组织、神经组织等分化[1],是再生牙周缺损最具潜力的种子细胞。但是,牙周炎症条件引起hPDLSCs的成骨分化能力下降,是牙周再生困难的重要原因[8]。Liu等[2]首次发现,从慢性牙周炎症组织中分离培养的PPDLSCs增殖能力增强,而成骨分化能力减弱。
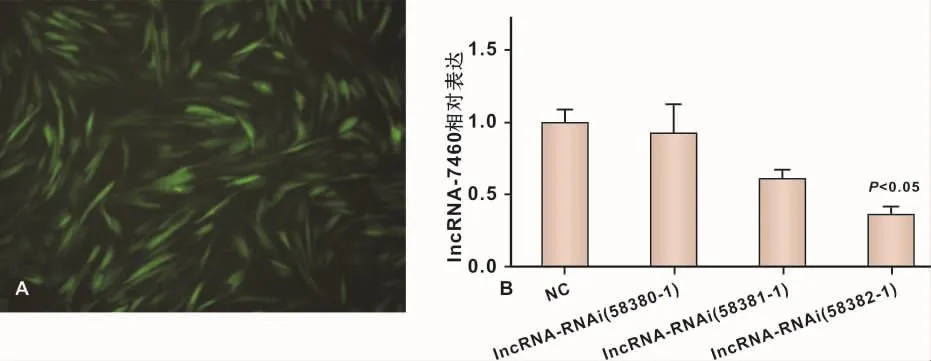
A:荧光显微镜观察(×200);B:量化分析图4 lncRNA-7460抑制慢病毒转染效率A:Fluorescence microscope observation(×200);B:Quatitative analysisFig 4 The efficiency of lncRNA-7460-knockdown lentivirus into PPDLSCs

A、B:qPCR检测成骨相关基因;C:茜素红、ALP染色检测细胞成骨分化能力;D:ALP活性测定;E:茜素红定量图5 lncRNA-7460对PPDLSCs成骨分化的调节作用。A:Expression of osteogenic differentiation related mRNAs in PPDLSCs infected by lncRNA-7460-overexpressing lentivirus;B:Expression of osteogenic differentiation related mRNAs in PPDLSCs infected by lncRNA-7460-downregulating lentivirus;C:Osteogenic differentiation determined by Alizarin Red Sand ALPstaining;D:ALPactivity;E:Quantitative analysis of Alizarin red stainingFig 5 lncRNA-7460 promotes osteogenic differentiation of PPDLSCs
lncRNA在广泛的生物途径和细胞过程中发挥重要的调节作用,包括染色体失活[9]和分化[10],干细胞多能性重编程[11]和细胞凋亡[12]。同时还参与了包括神经系统、心血管系统、炎症和癌症等疾病的发生发展[13-14]。许多研究认为lncRNA参与调控了干细胞成骨能力。Huang等[4]比较MSC成骨诱导分化前后的lncRNA,发现 H19可以剪切产生 miR-675,通过H19/miR-675/TGF-β1/Smad3/HDAC通路促进 MSC成骨分化。还有研究发现,lncRNA-ANCR通过抑制经典Wnt/β-catenin信号通路,抑制hPDLSCs成骨分化能力[15]。lncRNA-ANCR同样可以在 MSC中结合EZH蛋白,抑制关键转录因子Runx2从而抑制成骨分化[16]。
本实验组前期研究应用Arraystar人类lncRNA芯片(v3.0),对PPDLSCs和 HPDLSCs中差异表达的lncRNA进行了分析,发现共有89个lncRNA和387个mRNA 差异表达(Change Fold >2,P <0.05)[5]。
本研究首次发现lncRNA-7460参与调控PPDLSCs成骨分化。芯片结果显示,lncRNA-7460在HPDLSCs、PPDLSCs中均有较高的基础表达,且在PPDLSCs明显下调。是否是lncRNA-7460减少导致了PPDLSCs成骨能力的下降?本实验利用qPCR检测PPDLSCs成骨诱导前、成骨诱导1、7、14、21 d的 lncRNA-7460表达,发现成骨诱导后均发生了上调;据此推测lncRNA-7460可能与PPDLSCs成骨诱导过程相关。
该研究实验设计构建了lncRNA-7460过表达和下调慢病毒,上调或下调lncRNA-7460的表达,并通过多种体外实验验证了对细胞成骨分化的影响。qPCR检测发现,PPDLSCs在成骨诱导7 d后,成骨相关基因Runx2,ALP,OCN的mRNA表达量均较成骨诱导前有明显升高。同时,lncRNA-7460上调组成骨相关基因表达水平较对照组上升更为明显,而lncRNA-7460下调组的成骨相关mRNA升高不明显。同样,ALP染色、ALP活性测定以及茜素红染色、定量等实验结果也证明,lncRNA-7460上调组成骨能力增强,而下调组成骨能力减弱。本研究证实,lncRNA-7460可在体外条件下促进PPDLSCs的成骨分化过程,lncRNA-7460能否在体内环境下调节成骨分化需要进一步实验验证。
[1] Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament.[J].Lancet,2004,364(9429):149 -155.
[2] Liu N,Shi S,Deng M,et al.High levels ofβ-catenin signaling reduce osteogenic differentiation of stem cells in inflammatory microenvironments through inhibition of the noncanonical Wnt pathway[J].J Bone Miner Res,2011,26(9):2082-2095.
[3] Kong X,Liu Y,Ye R,et al.GSK3β is a checkpoint for TNF-α-mediated impaired osteogenic differentiation of mesenchymal stem cells in inflammatory microenvironments[J].Biochim Biophys Acta,2013,1830(11):5119-5129.
[4] Huang Y,Zheng Y,Jia L,et al.Long Noncoding RNA H19 Promotes Osteoblast Differentiation Via TGF-β1/Smad3/HDAC Signaling Pathway by Deriving miR-675[J].Stem Cells,2015,33(12):3481 -3492.
[5] Wang L,Wu F,Song Y,et al.Long noncoding RNA related to periodontitis interacts with miR-182 to upregulate osteogenic differentiation in periodontal mesenchymal stem cells of periodontitis patients[J].Cell Death Dis,2016,7(8):e2327.
[6] Nanci A,Bosshardt DD.Structure of periodontal tissues in health and disease[J].Periodontol 2000,2006,40:11 -28
[7] 冯晓珂,董岩,李治治,等.骨髓间充质干细胞复合脱细胞软骨和富血小板血浆的体内成骨实验[J].实用口腔医学杂志,2017,33(2):148-151.
[8] Zhu W,Liang M.Periodontal ligament stem cells:Current status,concerns,and future prospects[J].Stem Cells Int,2015,2015:972313.
[9] Lee JT,Bartolomei MS.X-inactivation,imprinting,and long noncoding RNAs in health and disease[J].Cell,2013,152(6):1308-1323.
[10] Guttman M,Donaghey J,Carey BW,et al.lincRNAs act in the circuitry controlling pluripotency and differentiation[J].Nature,2011,477(7364):295-300.
[11] Ng SY,Stanton LW.Long non-coding RNAs in stem cell pluripotency[J].Wiley Interdiscip Rev RNA,2013,4(1):121-128.
[12] ∅rom UA,Shiekhattar R.Long noncoding RNAs usher in a new era in the biology of enhancers[J].Cell,2013,154(6):1190-1193.
[13] Wapinski O,Chang HY.Long noncoding RNAs and human disease[J].Trends Cell Biol,2011,21(6):354 -361.
[14] 苏花,周珅玥,郭新程,等.LncRNA H19与OSF发生及癌变的关系[J].实用口腔医学杂志,2017,33(2):235-238.
[15] Jia Q,Jiang W,Ni L.Down-regulated non-coding RNA(lncRNA-ANCR) promotes osteogenic differentiation of periodontal ligament stem cells[J].Arch Oral Biol,2015,60(2):234-241.
[16] Zhu L,Xu PC.Downregulated LncRNA-ANCR promotes osteoblast differentiation by targeting EZH2 and regulating Runx2 expression[J].Biochem Biophys Res Commun,2013,432(4):612-617.
