山东地区医院获得性嗜麦芽寡养单胞菌的耐药性及感染相关危险因素分析*
2018-07-03吕刚飞刘海洋赵乔妹
吕刚飞,刘海洋,赵乔妹
(枣庄矿业集团中心医院 a.检验科;b.药剂科,山东枣庄 277800;2.解放军总医院第一附属医院检验科,北京 100048)
嗜麦芽窄食单胞菌(stenotrophomonasmaltophilia,SMA)也称嗜麦芽寡养单胞菌,是一种非发酵致病菌、无孢子专性需氧革兰氏阴性杆菌,也是一种常见条件致病菌[1]。SMA生存能力强,在自然界分布广泛,并大量存在于医院环境中,如医院空气、医疗器械、各种医疗管道及医护人员等。随着多种广谱抗生素、糖皮质激素和各种免疫制剂的应用,SMA的感染率和临床耐药性逐渐升高,已经成为重要的院内感染病原菌[2]。大多数SMA菌株具有明显的多重耐药性,临床对SMA感染的治疗多以联合抗生素治疗为主,但是不同地区、不同医院环境、不同病原菌以及临床抗生素药物使用情况的不同对SMA的耐药性影响各不相同,因此对本地区医院获得性SMA的临床特征进行调查,探究其耐药性和相关危险因素对本地区的临床抗SMA治疗具有重要的指导意义。本研究对山东地区医院获得性SMA耐药性及相关危险因素进行回顾性分析,旨在为本地区的临床治疗提供依据,现报道如下:
1材料与方法
1.1 资料来源 2016年山东省细菌耐药监测以收集数据为主进行被动监测,通过全国细菌耐药监测网数据报送系统收集相关数据,监测部位包括所有无菌部位来源的非污染细菌、开放部位来源的病原菌,收集时间为2015年10月1日~2016年9月30日,共纳入118家医院,其中83家为三级医院。标本包括送检痰液、肺泡灌洗液、尿液、血液、引流液,对上述标本进行细菌培养,分离得到SMA菌株4 808株。
纳入标准:①病历资料完整;②送检标本经培养确认分离得到SMA菌株;③入院48 h后分离得到SMA菌株。排除标准:①排除入院时处于潜伏期,在入院48 h内分离得到SMA菌株的患者资料;②临床有非发酵革兰阴性菌感染但优势菌是其他细菌的患者资料;③排除反复出入院并长期住院患者资料。
1.2 试剂仪器 梅里埃VITEK-2 COMPACT全自动细菌鉴定及药敏分析仪。
1.3 方法 对上述标本进行菌株分离培养,标本培养菌株分离操作严格按照第四版《全国临床检验操作规程》[3]进行。抗生素药物纸片来源于英国Oxoid公司,药敏试验采用Kirby-Bauer纸片法进行,采用法国生物梅里埃公司生产的VITEK-60鉴定系统进行菌株鉴定,判定标准参照美国临床实验室标准化研究所(Clinical and laboratory standards institute, CLSL)[4]标准。以大肠埃希菌ATCC25922,铜绿假单胞菌ATCC27853作质控菌株。
从SMA感染的患者中选取病例资料完整的患者作为观察组,收集上述患者的年龄、性别、基础疾病、手术情况、侵入性操作、临床药物治疗情况等病例资料,选择同科室、年龄±3岁且未发生SMA感染的患者作为对照组,分析SMA耐药情况及感染的相关危险因素。
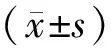
2结果
2.1 菌株标本来源与科室分布 见表1。4 808株SMA的标本来源中3 856株来自呼吸道标本,其中以痰液(3 012株)占比最高(62.65%),其次为肺泡灌洗液(BALF)(844株),占比17.55%。SMA标本科室分布占比最高的为ICU和呼吸内科,分别为56.47%,26.87%。

表1 4 808株菌株标本来源与科室分布(n=4 808)
2.2 SMA对常用抗生素的耐药结果 见表2。耐药分析结果表明:SMA对左旋氧氟沙星、复方新诺明、米诺环素和环丙沙星有较低的耐药性,耐药率均在10%以下;SMA对氨苄西林、头孢唑林、庆大霉素、亚胺培南和美罗培南有较高的耐药性,耐药率均在60%以上,甚至高达90%;SMA对头孢他啶、头孢呋辛、头孢噻肟、四环素、阿莫西林/克拉维酸和哌拉西林/他唑巴坦的耐药率在37.51%~45.00%之间。
2.3 SMA感染单因素分析 见表3。每组共纳入2 000例患者,对观察组和对照组的一般资料进行单因素分析,结果显示观察组与对照组在ICU入住率、慢性肺部疾病、入侵性操作、机械通气、使用碳青霉烯类抗生素、使用三种以上抗生素、免疫抑制剂上差异均有统计学意义(P<0.05)。
2.4 Logisitc多因素分析 见表4。对以上单因素分析两组差异有统计学意义的7个项目进行Logisitic多因素回归分析,得到导致SMA感染的独立危险因素为:ICU入住、慢性肺部疾病、入侵性操作、使用三种以上抗生素、免疫抑制剂。

表2 SMA对常用抗生素的耐药结果

表3 SMA感染单因素分析[n=2 000,n(%)]

表4 SMA感染的Logistic多因素分析
3讨论SMA是一种非发酵、专性需氧革兰氏阴性杆菌。该菌广泛存在于自然界水、土壤、植物根系和食物等环境中,同时还能定植于人体皮肤、胃肠道及呼吸道等,具有黏附性,常规消毒剂、肥皂等具有较好的耐受性[5]。虽然SMA毒性较弱,但却是院内感染最常见条件致病菌之一,SMA大量存在于医院环境中,如空气、管道装置、各种医疗器械(如氧气湿化瓶、人工呼吸装置等)表面,呼吸道、皮肤伤口、泌尿道及血液等部位都有可能感染SMA,医院内较大的人口密度,更大大增加了患者感染医院获得性SMA的风险[6]。随着广谱抗生素、免疫抑制剂、糖皮质激素等在临床治疗的广泛应用,以及各种有创性医疗操作的开展,SMA感染率呈逐年上升趋势,在非发酵菌的临床分离率中仅次于铜绿假单胞菌和鲍曼不动杆菌,列第三位[7]。临床抗生素的不当使用又导致了SMA的耐药性进一步升高,本研究旨在对山东地区的医院获得性SMA的耐药性进行调查,同时分析SMA感染的危险因素,以期对山东地区SMA的临床治疗提供指导。
通过对山东省118家医院分离得到的SMA标本进行分析发现,上下呼吸道感染是SMA感染的最主要部位,其中62.65%来自痰液,17.55%为BALF标本,而引流液、尿液、血液等标本中虽然分离得到SMA菌株但是总占比不足20%,说明SMA最主要的感染方式还是通过呼吸道感染引发呼吸道、肺部疾病。SMA标本科室分布比例最高为ICU和呼吸内科,分别为56.47%和26.87%,与文献报道该SMA感染常发生在免疫力严重低下、病情危重的患者中相符[8]。这是由于ICU病房大多病情严重、住院时间长、活动能力受限或长期卧床,且多年纪偏大并发多种基础疾病,自身免疫力低下,多数行气管插管、机械通气和中心静脉置管等有创性诊疗操作以及侵入性手术操作,更易感染SMA[9]。呼吸内科患者则多伴有慢性呼吸系统疾病,部分病情严重患者伴有吞咽、咳嗽等反射功能障碍,使痰液淤积堵塞气道,进食或饮水时容易呛咳、返流引起误吸,长期治疗过程中普遍应用大量广谱抗生素,极易引起SMA等条件致病菌感染[10]。
临床SMA治疗主要使用抗生素,抗生素主要分为五大类:分别是β-内酰胺类抗生素(如青霉素类、头孢菌素类、单环类抗生素)、磺胺类(如复方新诺明)、四环素类、奎诺酮类(如环丙沙星、左旋氧氟沙星)、氨基糖苷类(如庆大霉素)。对于SMA菌株耐药性的报道很多,但多局限个别医院或个别市区,标本量少,本研究对山东省一年内分离得到的4 808株SMA菌株的耐药性进行调查,结果发现SMA耐药性最低的抗生素是:米诺环素、环丙沙星、左旋氧氟沙星、复方新诺明,均在10%以内,这与中国CHINET SMA检测2016年15%相近[11];本省SMA对第一代头孢菌素头孢唑林和青霉素类、氨苄西林有极高的耐药性,对第二代、第三代头孢的耐药性为19.99%~37.51%,对碳青霉烯类亚胺培南、美罗培南有较高的耐药性,对氨基糖苷类庆大霉素的耐药性为60.02%;对阿莫西林/克拉维酸、哌拉西林/他唑巴坦等抗β-内酰胺类抗生素的耐药性分别为40.16%和45.00%;对四环素的耐药性为33.01%。
分析原因认为SMA的耐药机制复杂,其对某种抗生素的耐药性是在多种抗生素的压力下、多种机制共同作用的结果,与医院环境、抗生素的应用情况密切相关。其耐药机制主要可以包括五个方面[12~14]:①外膜通透性改变:SMA的外膜通透性较低,可以阻碍多种药物进入,增加其耐药性,同时其外膜微孔蛋白的丢失使其对碳青霉烯类抗生素有天然耐药性。②产生β-内酰胺酶:SMA能生长L1和L2两种β-内酰胺酶,L1类酶能水解多种β-内酰胺酶抗生素,包括青霉素类、头孢菌素类、碳青霉烯类,L2类酶能水解单环类抗生素和头孢类抗生素。③氨基糖苷类钝化酶:SMA能产生氨基糖苷类钝化酶,能够降低其对氨基糖苷类抗生素的敏感性。④主动外排机制:这是导致SMA具有天然耐药性的重要原因,SMA通过smeABC和smeDEF两个外排泵系统外排氨基糖苷类、喹诺酮类、大环内酯类抗生素,且部分smeABC突变菌株不仅对上述抗生素耐药,其水解β-内酰胺酶的能力也大大增强。⑤抗生素作用靶位改变和整合子介导的耐药机制:部分SMA发生DNA旋转酶和拓扑异构酶活性位点突变产生对喹诺酮类耐药性;SMA菌株之间通过质粒、转座子以及噬菌体的船体进行耐药性传播,加强了其对头孢菌素类、碳青霉烯类、β-内酰胺类、氨基糖苷类的耐药性。
在此基础上,本研究对2 000例医院获得性SMA感染患者和2 000例对照组患者进行单因素分析,结果发现观察组与对照组在ICU入住率、慢性肺部疾病、入侵性操作、机械通气、使用碳青霉烯类抗生素、使用三种以上抗生素、免疫抑制剂上差异有统计学意义(P<0.05),经Logistic多因素分析最终确定了医院获得性SMA感染的独立危险因素为ICU入住率、慢性肺部疾病、入侵性操作、使用三种以上抗生素、免疫抑制剂。ICU入住多为重症患者、身体机能较差的易感人群;慢性肺部疾病患者伴有长期呼吸道疾病,而呼吸道又是SMA主要感染部位;入侵性操作包括气管切开、手术操作等,会破坏机体防御屏障,管道接触和开放性伤口面积扩大是导致SMA感染的重要原因;使用免疫抑制剂会破坏甚至摧毁患者的自身免疫系统,是感染的高危人群;SMA对碳青霉烯类抗生素具有较高的天然耐药性,会增加其感染风险,使用三种以上抗生素也是导致SMA耐药性和多重耐药性加重的重要原因,会增加感染风险[15,16]。
综上,各科医生尤其是ICU和呼吸内科应加强对SMA的重视,加大对菌群的监控力度,对于长时间入住ICU的患者,应减少不必要的有创诊疗操作,避免广谱抗生素和免疫抑制剂滥用,预防医源性感染的发生,同时加强医护人员院感知识培训和无菌操作,减少交叉感染,从而做到早预防、早隔离、早控制,降低医院获得性SMA感染率。
参考文献:
[1] Paopradit P,Srinitiwarawong K,Ingviya N,et al.Distribution and characterization ofStenotrophomonasmaltophiliaisolates from environmental and clinical samples in Thailand[J].J Hosp Infect,2017,97(2):185-191.
[2] 莫泽珣,陈 蕊,王玲玲,等.老年重症患者主要非发酵菌流行病学特征及耐药性分析[J].中华医院感染学杂志,2017,27(2):267-271.
Mo ZX,Chen R,Wang LL,et al.Epidemiological characteristics and antimicrobial resistance of main non-fermenting bacteria isolated from criticall ill elderly patients[J].Chin J Nosocomiol,2017,27(2):267-271.
[3] 尚 红,王毓三,申子瑜.全国临床检验操作规程[S].4版.北京:人民卫生出版社,2015:1041.
Shang H,Wang YS,Shen ZY.National guide to clinical laboratory procedures[S].4th Ed.Beijing:People’s Health Publishing House,2015:1041.
[4] Clinical and Laboratory Standards Institute (CLSI)/ NCCLS.Performance Standards for Aulimicrobial Susceptibility testing Standards:twentyth Informational Supplement[S].Wayne:PA,CLSI M100-S22,2012.
[5] 刘莎莎,侯伟伟,李 冬.775株非发酵菌的临床分布和耐药性分析[J].实验与检验医学,2016,34(5):627-629.
Liu SS,Hou WW,Li D.Clinical distribution and drug resistance analysis of 775 strains of non fermented bacteria[J].Experimental and Laboratory Medicine,2016,34(5):627-629.
[6] Zhao S,Yang L,Liu H,et al.Stenotrophomonasmaltophiliain a university hospital of traditional Chinese medicine:molecular epidemiology and antimicrobial resistance[J].J Hosp Infect,2017,96(3):286-289.
[7] Sun E,Liang G,Wang L,et al.Antimicrobial susceptibility of hospital acquiredStenotrophomonasmaltophiliaisolate biofilms[J].Braz J Intfect Dis,2016,20(4):365-373.
[8] 谢金兰,秦 颖,邵 俊,等.嗜麦芽窄食单胞菌合并多重耐药菌感染危险因素及耐药性分析[J].中华实验和临床感染病杂志(电子版),2015,9(2):170-173.
Xie JL,Qin Y,Shao J,et al.Risks and drug resistance analysis ofStenotrophomonasmaltophiliaco-infection with multidrug-resistance organism[J].Chin J Exp Clin Infect Dis(Electronic Edition),2015,9(2):170-173.
[9] 武沛佩,涂友慧,徐爱晖.某三甲医院2016年度非发酵菌临床特征与耐药性分析[J]. 临床肺科杂志,2017,22(11):1972-1975.
Wu PP,Tu YH,Xu AH.Analysis of clinical characteristics and drug resistance of non-fermentative bacteria in a third-class hospital in 2016[J].Journal of Clinical Pulmonary Medicine,2017,22(11):1972-1975.
[10] 赵书平,姜梅杰,谭 斌,等.某院2014年度嗜麦芽窄食假单胞菌的耐药性及分布[J].中华实验和临床感染病杂志(电子版),2016,10(6):736-738.
Zhao SP,Jiang MJ,Tan B,et al.Drug resistance and clinical distribution ofStenotrophomonasmaltophiliain a hospital in 2014[J].Chin J Exp Clin Infect Dis (Electronic Edition),2016,10(6):736-738.
[11] 胡付品,郭 燕,朱德妹,等.2016年CHINET细菌耐药性监测[J].中国感染与化疗杂志,2017,17(5):481-491.
Hu FP,Guo Y,Zhu DM,et al.CHINET surveillance of bacterial resistance across China: report of the results in 2016[J].Chin J Infect Chemother,2017,17(5):481-491.
[12] Wang CH,Lin JC,Chang FY,et al.Risk factors for hospital acquisition of trimethoprim-sulfamethoxazole resistantStenotrophomonasmaltophiliain adults:A matched case-control study[J].J Microbiol Immunol,2017,50(5):646-652.
[13] Corlouer C,Lamy B,Descroches M,et al.Stenotrophomonasmaltophiliahealthcare-associated infections:identification of two main pathogenic genetic backgrounds[J].J Hosp Infect,2017,96(2):183-188.
[14] Pien CJ,Kuo HY,Chang SW,et al.Risk factors for levofloxacin resistance inStenotrophomonasmaltophiliafrom respiratory tract in a regional hospital[J].J Microbiol Immunol,2015,48(3):291-295.
[15] 赵 进,刘运喜,倪文涛,等.嗜麦芽寡养单胞菌感染管理与临床治疗研究进展[J].中华医院感染学杂志,2017,27(10):2397-2400.
Zhao J,Liu YX,Ni WT,et al.Progress of study on management and clinical treatment ofStenotrophomonasmaltophiliainfections[J].Chin J Nosocomio,2017,27(10):2397-2400.
