隐球菌脑膜炎患者外周血单个核细胞PILRα升高及意义*
2018-07-03李腾达龙曙萍黄元兰张薇薇谷明莉邓安梅
李腾达,刘 鹏,龙曙萍,刘 云,黄元兰,张薇薇,郭 杰,谷明莉,邓安梅
(1.第二军医大学长海医院,上海 200433;2.解放军455医院,上海 200052)
新型隐球菌(Cryptococcusneoformans)是一种机会性致病真菌,常经下呼吸道入侵机体,当机体由于肿瘤治疗、移植、人类免疫缺陷病毒感染等而致免疫力低下时,隐球菌可从肺部入侵血液,经血脑屏障到达脑部形成隐球菌脑病,威胁患者生命[1]。在隐球菌病中固有免疫巨噬细胞M1亚型在抵抗真菌感染中起到了重要作用,其主要产生IL-1,IL-6和TNF-α等细胞因子,可促进机体的Th1细胞分化及TNF-α,IFN-γ等细胞因子的产生[1~4]。NK细胞作为一种重要的固有免疫淋巴细胞,在隐球菌病中亦发挥了重要作用,可通过穿孔素介导的细胞毒作用杀伤隐球菌,该作用能够被IL-12促进[5,6]。
II型成对免疫球蛋白样受体(paired immunoglobin-like type 2 receptor alpha,PILRα)是一种免疫抑制受体,表达于粒细胞、单核细胞、巨噬细胞等细胞上[7,8]。该蛋白包含两种能够激活髓细胞抑制作用的免疫酪氨酸受体抑制性基序(immunoreceptor tyrosine-based inhibitory motif,ITIM),可识别单纯疱疹病毒1等配体[7,8]。研究表明PILRα与NK细胞结合可提高其IFN-γ产量与细胞毒性,有利于实现NK细胞功能[8],亦有cDNA微阵列分析显示PILRα可作为巨噬细胞I亚型(M1)的新型标志性分子[9],意味着PILRα可能参与了M1细胞相关的免疫炎症作用。而M1,NK细胞等固有免疫细胞在隐球菌病中发挥了重要作用。基于此,本文对PILRα在新型隐球菌脑病中表达情况进行研究,初步探讨其作用机制,进而为隐球菌脑病的诊治提供新的治疗靶点。
1材料和方法
1.1 研究对象 收集2014年5月~2016年11月于长海医院诊断为隐球菌脑膜炎患者作为实验组,诊断标准为患者脑脊液新型隐球菌染色或培养阳性,患者平均年龄37.21±6.93岁,男性11例,女性19例。30例同期体检的健康个体为对照组,平均年龄38.12±7.08岁,男女比例为2∶3,两组间年龄、性别差异无统计学意义(P>0.05)。本研究经第二军医大学长海医院医学科研伦理委员会批准,所有受试对象均签署知情同意书。
1.2 试剂与仪器 Ficoll (Sigma公司),ELISA试剂盒及抗体(ThermoFisher公司),PCR试剂盒(Taraka公司),Trizol(Thermo公司),酶标仪(Thermo公司),PCR仪(ThermoFisher公司)。
1.3 方法
1.3.1 外周血血浆及PBMCs分离:收集2~3 ml受试对象外周血装入抗凝管,3 000 r/min离心10 min分离得到血浆,用于细胞因子检测,待测血浆储存于-80℃。将血细胞以PBS稀释后加入到Ficoll试剂进行密度梯度离心,收集中间白膜层,并以约5倍体积的PBS洗两次,以2 490 r/min离心10 min,得到的沉淀即为PBMCs,将细胞置于冻存盒中于-80℃放置2~3天后,转移到液氮长期保存。
1.3.2 反转录及PCR检测PBMCs中PILRα的表达情况:每106个细胞加入1 ml Trizol 进行PBMCs总RNA的抽提,依次加入氯仿、异丙醇、乙醇进行提取纯化,最后用无RNA的双蒸水溶解RNA,于56℃,水浴15 min,浓度及纯度符合检测标准的RNA样本可用于PCR测定,测定方法按照PCR试剂盒进行。
1.3.3 ELISA法检测血浆细胞因子:按照ELISA试剂盒操作说明对PILRα,IL-1,IL-6,IFN-γ,TNF-α等细胞因子进行检测定量。
1.4 统计学分析 以独立样本t检验进行两组间计量资料的比较,采用Pearson相关性系数表示两变量间的关系,检验水准为0.05。分析软件为Graph Prism 6.0。
2结果
2.1 实验组与对照组PILRα的表达情况 实验组与对照组PBMCs中PILRα的mRNA相对表达量为2.49±0.74 vs 1.77±0.69(t=3.898,P=0.000 3);实验组与对照组血浆中PILRα的蛋白表达量分别为33.81±10.21 ng/ml vs 20.01±6.74 ng/ml(t=6.178,P<0.000 1),差异均具有统计学意义。
2.2 实验组与对照组相关免疫分子的表达 见表1。与对照组比较,实验组血浆中IL-1,IL-6蛋白表达水平增高,IFN-γ表达降低,差异具有统计学意义(t=17.74,10.13,4.720,均P<0.05),TNF-α,IL-12,IL-4的蛋白表达水平在实验组与对照组不具有统计学差异(t=0.858 5,1.276,0.266 3,均P>0.05)。
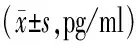
表1 实验组与对照组Th1/Th2细胞相关免疫分子表达的比较
2.3 实验组PILRα与细胞因子Pearson相关性分析 实验组血浆中PILRα的蛋白表达水平与相关细胞因子的相关性分析显示,PILRα与IL-1,IL-6,IFN-γ呈正相关,差异具有统计学意义(r=0.456,0.521,0.467,均P<0.05),与其他细胞因子不具有相关性(TNF-α:r=0.237,P>0.10;IL-12:r=0.311,P>0.05;IL-4:r=0.256,P>0.10)。
3讨论新型隐球菌是一种普遍存在于外界环境中的条件致病真菌,其主要依赖于毒力因子多糖荚膜、胞壁黑色素等来抵抗外界射线、温度等压力[1,10]。当机体免疫功能缺陷时,其可通过细胞外分泌形式从肺部巨噬细胞逃逸,经特洛伊木马现象扩散到中枢神经形成感染病灶致隐球菌脑病[1,11]。目前隐球菌病主要发生于服用免疫抑制药物患者、免疫细胞功能缺陷病人、肿瘤、器官移植及肝病患者等[11]。在机体抵抗隐球菌的免疫过程中,人体第一道固有免疫屏障的肺泡巨噬细胞发挥了重要作用,M1型巨噬细胞可分泌IL-1,IL-6等因子,进而诱导机体产生Th1样反应及IFN-γ等细胞因子的分泌,同时M1可通过Th1反应促进真菌杀伤性NO的产生,杀死细胞内吞噬的真菌[1~4]。NK细胞亦是机体重要免疫细胞,其在隐球菌感染中亦发挥了重要作用,在试管实验中,NK细胞能抑制新型隐球菌的生长,而在小鼠模型中其可通过一系列细胞活动诱导病菌的免疫清除,在人体中NK细胞可通过穿孔素作用直接杀死新型隐球菌,以防止其进一步扩增及感染[5,6]。
PILRα是一种转膜受体,由303个氨基酸组成,可识别O-糖基化黏蛋白受体例如PILR-相关的神经蛋白(PANP),神经元分化和增殖因子-1(NPDC1)和胶原凝素-12(COLEC-12),表达于髓细胞包括粒细胞、单核细胞、巨噬细胞、树突状细胞等[7,8]。研究表明PILRα-Ig可结合于人类NK细胞自然细胞毒性受体(natural cytotoxicity receptors,NCR)NKp44,NKp46等,可通过促进细胞杀伤作用和提高IFN-γ产量来实现NK细胞功能[8]。cDNA微阵列芯片分析显示,PILRα可作为M1的新型标志分子,意味着其可能参与了M1相关免疫活动[9]。在类风湿性关节炎滑膜组织中,PILRα表达增高且与炎症细胞浸润程度相关[12],证明PILRα在炎症反应中起到了重要作用。综上所述M1与NK细胞在新型隐球菌病的免疫活动中的重要性,PILRα与M1,NK细胞之间的关联性及其在炎症反应中的作用,本研究假设PILRα在隐球菌感染免疫过程中可能亦发挥了重要作用。研究结果表明PILRα在隐球菌脑膜炎患者外周血单个核细胞中表达升高,且与IL-1,IL-6,IFN-γ呈正相关,表明PILRα可能参与了隐球菌病的免疫病理及炎症过程,是该病潜在的靶点。但值得注意的是,本研究样本量不足,尚需进一步扩大样本量,并进行深入的PILRα机制性探索以明确其具体作用机理。
参考文献:
[1] Panackal AA,Wuest SC,Lin YC,et al.Paradoxical immune responses in Non-HIV cryptococcal meningitis[J].PLoS Pathogens,2015,11(5):e1004884.
[2] Coelho C,Souza AC,Derengowski Lda S,et al.Macrophage mitochondrial and stress response to ingestion ofCryptococcusneoformans[J].Journal of Immunology,2015,194(5):2345-2357.
[3] Ikeda-Dantsuji Y,Ohno H,Tanabe K,et al.Interferon-gramma promotes phagocytosis ofCryptococcusneoformansbut notCryptococcusgattiiby murine macrophages[J].Journal of Infection and Chemotherapy,2015,21(12):831-836.
[4] Leopold Wager CM,Hole CR,Wozniak KL,et al.STAT1 signaling within macrophages is required for antifungal activity againstCryptococcusneoformans[J].Infection and Immunity,2015,83(12):4513-4527.
[5] Ogbomo H,Mody CH.Granule-dependent natural killer cell cytotoxicity to fungal pathogens[J].Frontiers in Immunology,2016(7):692.
[6] Kyei SK,Ogbomo H,Li S,et al.Mechanisms by which interleukin-12 corrects defective NK cell anticryptococcal activity in HIV-infected patients[J]. mBio,2016,237(4):dio10.1128/mBio.00878-16.
[7] Kohyama M,Matsuoka S,Shida K,et al.Monocyte infiltration into obese and fibrilized tissues is regulated by PILRα[J].European Journal of Immunology,2016,46(5):1214-1223.
[8] Ophir Y,Duev-Cohen A,Yamin R,et al.PILRα binds an unknown receptor expressed primarily on CD56 bright and decidual-NK cells and activates NK cell functions[J].Oncotarget,2016,7(27):40953-40964.
[9] Bagheri M,Dong Y,Ono M.Molecular diversity of macrophages in allergic reaction:comparison between the allergenic modes;Th1- and -Th2-Derived immune conditions[J].Iranian Journal of Allergy,Asthma,and Immunology,2015,14(3):261-272.
[10] 李腾达,龙曙萍,徐贵霞,等.CD26/DPP4对隐球菌脑膜炎患者CD4+T细胞及相关细胞因子的影响与临床意义[J].现代检验医学杂志,2016,31(5):38-41.
Li TD,Long SP,Xu GX,et al.Affection of CD26/DPP4 on CD4+T cells and relative cytokines in patients with crytococcal meningitis and its clinical significance[J].J Mod Lab Med,2016,31(5):38-41.
[11] McQuiston TJ,Williamson PR.Paradoxical roles of alveolar macrophages in the host response toCryptococcusneoformans[J].Journal of Infection and Chemotherapy,2012,18(1):1-9.
[12] Sun Y,Caplazi P,Zhang J,et al.PILRα negatively regulates mouse inflammatory arthritis[J].Journal of Immunology,2014,193(2):860-870.
