人乳头瘤病毒58型L1/E7“假病毒”疫苗的制备及免疫效果评价*
2018-07-03王亚婷李文生闫小飞齐宗利
王亚婷,李文生,闫小飞,齐宗利,郭 华
(1.陕西省人民医院病理科,西安 710068;2.西安交通大学基础医学院,西安 710061)
子宫颈癌是女性最常见的生殖道恶性肿瘤,严重威胁着女性的生命健康。流行病学调查结果表明,高危型人乳头瘤病毒(human papillomavirus,HPV)感染,是宫颈癌的重要启动因子[1]。在世界范围内,高危型HPV感染常见型别是HPV16和HPV18型,但在我国宫颈病变中,HPV58型是继HPV16之后的重要型别[2]。研制HPV58型预防及治疗性疫苗,对降低我国宫颈癌发生率尤为重要。
HPV基因组结构按功能可分为上游调节区(LCR)、早期基因区(E1,E2,E4,E5,E6,E7)和晚期基因区(L1,L2)。其中,E6,E7基因编码的蛋白与宿主细胞转化功能直接相关,L1基因编码的衣壳蛋白可自我组装成病毒样颗粒(virus-like particles,VLPs),可刺激机体产生长效的中和抗体[3]。目前已经上市的两种HPV疫苗均是以L1蛋白为目标抗原的重组疫苗[4],均为预防性疫苗,对于已经感染HPV及发生宫颈癌的病人没有治疗作用,同时已上市的两种L1 VLP混合型HPV预防性疫苗都是针对欧美地区HPV在宫颈癌中的流行分布特点研发,均不含HPV58 L1 VLP。
结合我国宫颈癌发生的实际情况,研制高效廉价的预防性和治疗性HPV58型疫苗是我国宫颈癌防治的最佳策略之一。本研究利用昆虫-杆状病毒系统构建了由HPV58 L1蛋白组成的病毒样颗粒(virus-like particles,VLPs),在VLP内部包裹突变型HPV58 E7基因(通过突变去除了E7蛋白的转化活性,但保持了它的抗原性),制备了HPV58VLP/E7DNA“假病毒”疫苗,同时具有预防和治疗作用,用“假病毒”疫苗免疫小鼠,评估疫苗的体液和细胞免疫效果。
1材料与方法
1.1 实验材料 含HPV58 L1的重组昆虫-杆状病毒以及Tc-1细胞由本实验室保存;mE7-pcDNA3.1+质粒由本实验室构建;HPV58 E7蛋白由本实验室纯化保存;sf9昆虫细胞购自中国科学院上海生命科学研究院。小鼠抗HPV58L1单克隆抗体MAB885购自美国Millipore公司;HRP标记山羊抗鼠IgG抗体购自Santa Cruz公司;Grace’s昆虫细胞培养液购自invitrogen公司。小鼠IFN-γ ELISA试剂盒购自北京索莱宝科技有限公司。C57BL/c小鼠,Balb/c雌性,8~10周龄,购于西安交通大学医学院实验动物中心。
1.2 方法
1.2.1 HPV 58 L1重组蛋白的表达鉴定及假病毒的组装:利用重组的杆状病毒感染sf9昆虫细胞,4天后收集细胞,0.5 mg/dl NP-40裂解细胞,1 000 r/min离心10 min收集细胞核,超声裂解细胞核,12 000 r/min离心收集上清,加入His-Ni亲和层析纯化HPV58 L1 VLP,100 μg的HPV58 VLPs 用解离缓冲液(pH 7.15 Tris-HCl,0.115 mmol/L NaCl,1 mmol/L EDTA,20 mmol/L DTT)室温透析2 h,然后向已经解离的衣壳粒中加入100 μg的mE7-pcDNA3.1+质粒,采用5 mmol/L的CaCl2室温透析过夜,超速离心后,收集组分行HPV58 E7基因PCR扩增。
1.2.2 电镜观察:将需要观察的样品进行透析除去其中的高浓度盐分,吸取10 μl样品滴于铜网支持的碳膜上,经磷钨酸复染,H- 600透射电镜观察。
1.2.3 小鼠红细胞凝集试验:取正常C57BL/c小鼠红细胞,制成10 ml/L悬液;取不同稀释度的裂解细菌上清,50 μl分别加至96孔圆底板,再加50 μl红细胞悬液,4℃孵育3 h观察。
1.2.4 动物免疫:将“假病毒” 以及VLPs免疫Balb/c小鼠。每只小鼠滴鼻免疫50 μg“假病毒”或VLPs,14天后进行加强免疫,接种与第1 次相同剂量的抗原。免疫后7天进行免疫效果评价。作为阴性对照的小鼠以PBS滴鼻处理。
1.2.5 ELISA法检测血清中IgG和IgA含量:用HPV16 VLPs包被酶标板,4℃包被过夜。用洗涤液洗3次,加入封闭液室温封闭4 h;用洗涤液洗3次,分别加入不同稀释度的小鼠血清,室温反应2 h;用洗涤液洗3次,加入HRP-标记的二抗,室温反应2 h。用洗涤液洗3次,加入底物后显色,利用酶标仪测定450 nm光吸收。
1.2.6 脾淋巴细胞IFN-γ的分泌水平测定:将5×106/ml的效应细胞接种于细胞板中,E7蛋白5 μg/ml进行体外刺激,于37℃ 5%(v/v) CO2培养箱孵育72 h后,取其上清液ELISA检测IFN-γ浓度。在酶标板中设好倍比稀释的标准品作为对照,每孔分别加入样品100 μl,各设3个复孔。按试剂盒说明步骤依次加入检测工作液、洗涤液、显色剂各100 μl,其间洗板5次,最后加入终止液,测吸光度A450nm,绘制标准曲线并推算各样本的浓度。
1.2.7 CTL反应的测定:利用LDH方法测定小鼠脾淋巴细胞的CTL反应。将小鼠脾淋巴细胞作为效应细胞,Tc-1细胞(利用HPV16的E6和E7基因转化的C57BL 6小鼠的细胞系)作为靶细胞进行检测。
1.3 统计学分析 采用SPSS 19.0软件进行统计学分析,使用单因素方差(Turkey)分析,以P<0.05为差异有统计学意义。
2实验结果
2.1HPV58L1蛋白在sf9昆虫体系中大量表达 收集接种了重组昆虫-杆状病毒的sf9细胞,SDS-PAGE和Western-blotting分析结果显示,感染HPV58L1重组病毒的sf9细胞表达了约56kD的目的蛋白,其分子量大小与HPV58L1理论预期值一致,而sf9细胞组未见特异性条带,见图1A,1B),表明HPV58L1蛋白确实在sf9细胞中得到高效表达。小鼠红细胞凝集实验结果显示,sf9细胞表达的HPV58L1蛋白可引起小鼠红细胞凝集,说明表达的HPV58L1蛋白具有较好的生物活性,见图1C。
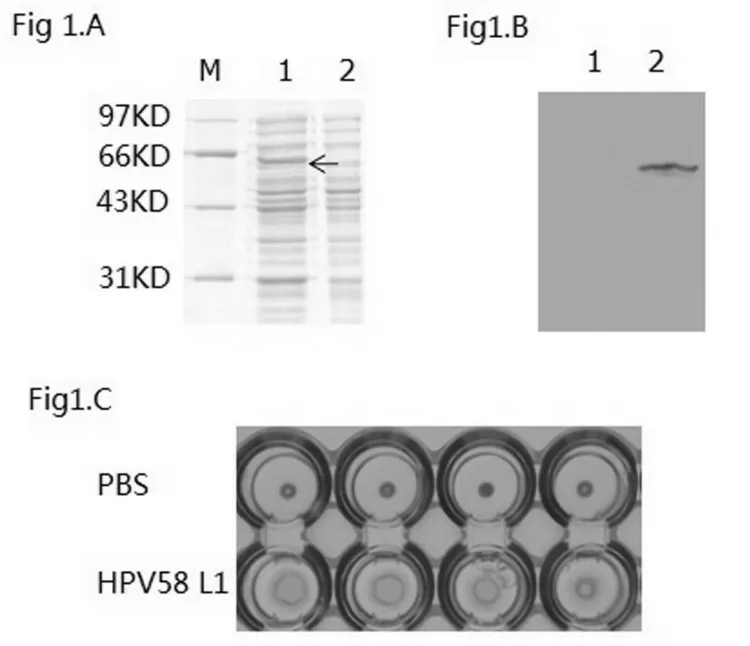
(A)SDS-PAGE 鉴定sf9细胞表达HPV58 L1蛋白。lane 1.低分子量蛋白标准品;lane 2.感染了HPV58 L1重组杆状病毒的sf9细胞核裂解上清;lane 3.使用空白杆状病毒感染sf9细胞核裂解上清。(B)Western-blotting鉴定sf9细胞表达的HPV58 L1蛋白。lane 1.空白杆状病毒感染sf9昆虫细胞裂解物;lane 2.重组杆状病毒感染sf9昆虫细胞裂解物。(C)小鼠红细胞凝集试验分析纯化后HPV58 L1蛋白的生物活性。
2.2HPV58L1蛋白的电镜形态学观察 经电镜观察证实,纯化的HPV58L1蛋白可形成直径约55nm的球形空心颗粒(图2A),与HPVVLP相符,说明表达的L1蛋白有形成VLP的能力,使用解离缓冲液处理病毒样颗粒,室温透析2h,电镜观察可以看到呈解离状态的病毒样颗粒亚基(图2B)。解离的病毒样颗粒亚基在CaCl2透析后,能重新聚合成“假病毒”(图2C)。取少量重新聚合的“假病毒”进行PCR扩增,扩增出特异性条带,大小约340bp,与HPV58E7基因大小相符,证实重新聚合的病毒样颗粒中包裹有mE7-pcDNA3.1+质粒。
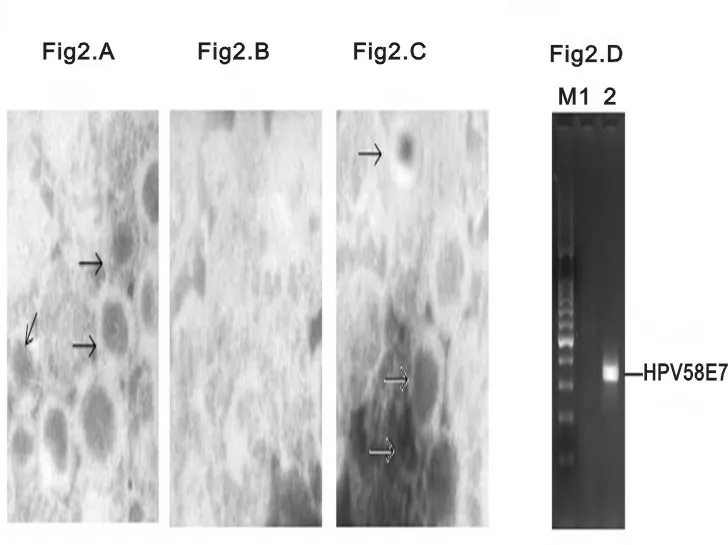
(A)电镜观察HPV58 L1蛋白形成的VLP;(B)VLP经解离缓冲液处理后的电镜形态;(C)CaCl2和mE7-pcDNA3.1+质粒存在下重新聚合的“假病毒”;(D)PCR扩增“假病毒”中的HPV58 E7基因。
2.3VLP和“假病毒”刺激机体产生体液和黏膜免疫反应 用VLP和“假病毒”滴鼻免疫Balb/c小鼠,再次加强免疫7天后,血清学ELISA结果显示:VLP和“假病毒”均能引起显著的体液和黏膜免疫反应,但是两者之间无显著性差异,而PBS组未检出抗HPV58IgG,IgA,见图3A和3B。
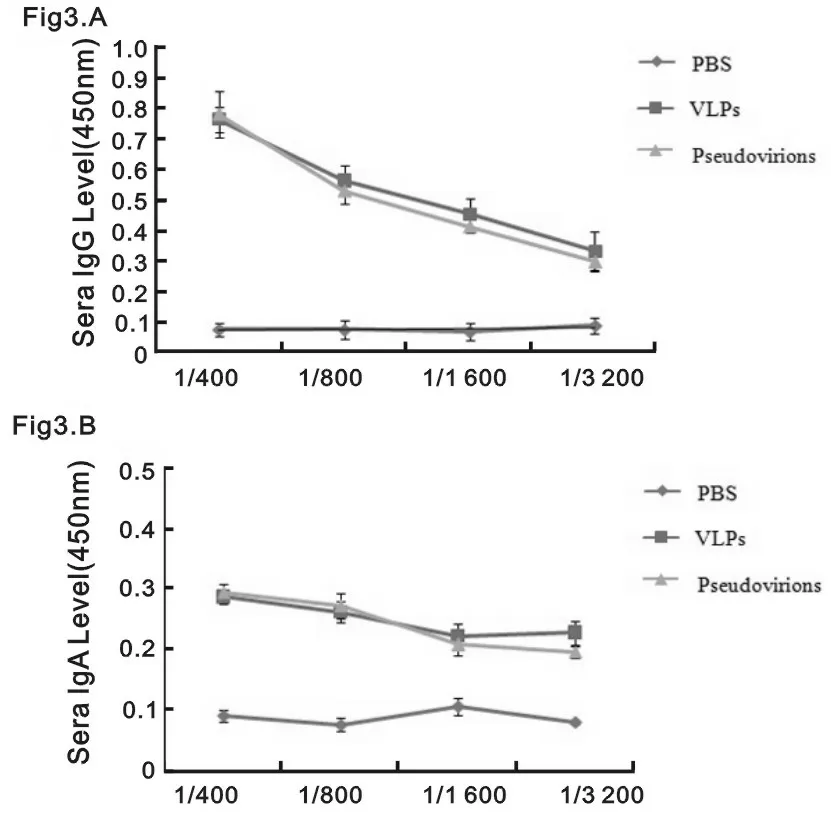
图3 小鼠血清中HPV58 L1特异性IgG
2.4 “假病毒”引起细胞免疫反应IFN-γ是Th1细胞分泌的重要细胞因子,用HPV58E7蛋白体外刺激免疫小鼠脾细胞,通过ELISA定量检测IFN-γ分泌情况,“假病毒”免疫组产生的IFN-γ明显高于VLP免疫组与空白组(P<0.001)(图4A)。CTL反应结果发现,“假病毒”免疫过的小鼠脾淋巴细胞可以特异性杀伤Tc-1 细胞,引起CTL反应,而VLPs免疫的小鼠则无此反应(图4B)。
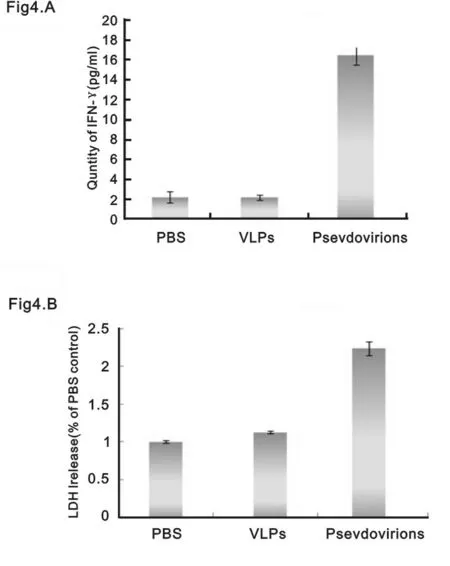
(A)用E7蛋白体外刺激免疫后小鼠脾细胞,通过ELISA定量检测IFN-γ分泌情况。“假病毒”免疫组产生的IFN-γ明显高于VLP免疫组与空白组(P<0.001)。(B)“假病毒”免疫引起E7特异性的CTL反应(P<0.001)。
3讨论人乳头瘤病毒L1衣壳蛋白在病毒感染过程中有着非常重要的作用,通过免疫反应产生针对病毒外壳的中和抗体,可以减少病毒的入侵,达到保护效果[5]。目前上市的HPV疫苗,就是针对L1蛋白的预防性疫苗,流行病学研究证实,此类疫苗可有效预防HPV感染,但对于已有HPV感染或癌前病变者并无明显治疗作用。
HPV持续感染时,病毒早期基因整合到细胞基因组中,E6,E7蛋白结合并促进肿瘤抑制蛋白p53及pRb的降解,干扰细胞周期,促进细胞恶变[6,7]。但机体缺乏HPV特异的T细胞免疫反应性,不能及时有效地清除表达E6,E7蛋白的HPV感染细胞,刺激机体产生HPV特异性T细胞免疫反应,开发针对HPV感染相关癌前病变的治疗性疫苗,是HPV疫苗研发的另一热点。
本研究中利用sf9昆虫-杆状病毒表达系统表达HPV58 L1蛋白。SDS-PAGE及Western blot分析证实,在大约56kD处出现了可与HPV58 L1 mAb特异性结合的条带,表明sf9昆虫-杆状病毒表达系统可成功表达L1目的蛋白。小鼠红细胞凝集试验证实表达的HPV58L1 有诱导小鼠红细胞凝集的能力,表明蛋白具有较好的活性。电镜观察可见表达蛋白有自组装成VLP的能力。用解离缓冲液室温透析纯化的VLP颗粒,聚集的VLP衣壳蛋白发生解离,向已经解离的衣壳粒中加入mE7-pcDNA3.1+质粒,再用CaCl2室温透析过夜,电镜观察发现,VLP可以解聚和再聚集,再聚合的“假病毒”颗粒中包裹有E7DNA,这个“假病毒”具有病毒的外壳蛋白,而里面包裹的是经过改造没有转化危险的E7基因,因此,从理论上讲,这个假病毒具有嵌合疫苗的作用,即可以预防HPV58病毒的感染,同时还可以治疗HPV58导致的宫颈癌前病变或宫颈癌。
分别用HPV58 VLP和 “假病毒”免疫小鼠,动物实验结果证实,HPV58VLP和假病毒都能够引起宿主体液免疫反应,血清中产生足够数量的IgG中和抗体。由于HPV主要感染上皮细胞,因此分泌型抗体IgA是抵抗HPV病毒感染的首要防线。经黏膜免疫,VLP和假病毒均能产生分泌型IgA抗体,这些结果表明:“假病毒”具有预防HPV感染的效果。IFN-γ是细胞免疫反应的重要特点,“假病毒”刺激机体产生的IFN-γ明显高于VLP免疫组,而且“假病毒”免疫过的小鼠脾淋巴细胞可以特异性的杀伤Tc-1细胞,引起CTL反应,说明“假病毒”除了可以预防HPV感染之外,还能够刺激机体产生HPV特异性T细胞免疫反应,特异性杀伤HPV感染的阳性细胞,具有HPV治疗性疫苗的作用。
本实验研制的新型HPV58VLPL1/E7DNA“假病毒”疫苗,可引起宿主的抗体反应和细胞免疫反应,为防治HPV58感染及其所致的宫颈癌及宫颈上皮内病变提供新的思路。
参考文献:
[2] 刘宝印,李 洁,De Villiers EM,等.我国人乳头瘤病毒58型感染与宫颈癌的关系[J].中华实验和临床病毒学杂志,1996,10(2):118-121.
Liu BY,Li J.De villiers EM,et al.Investigation on relationship between the papillomavirus type 58 (HPV58) infection and cervix cancer in China[J].Chinese J Exp Clin Virol,1996,10(2):118-121.
[3] 刘景会,刘玉林,褚 迪,等.截短型人乳头瘤病毒58型L1蛋白在昆虫细胞中的表达[J].中国生物制品学杂志,2015,3(28):233-238,244.
Liu JH,Liu YL,Chu D,et al.Expression of truncated human papilomavirus 58 L1 protein in insect cells[J].Chinese Journal of Biologicals,2015,28(3):233-238,244.
[4] Mohsen MO,Zha L,Cabral-Miranda G,et al.Major findings and recent advances in virus-like particle (VLP)-based vaccines[J].Semin Immunol,2017,34:123-132.
[5] Roden RB,Weissinger EM,Henderson DW,et al.Ne-utralization of bovine papillomavirus by antibodies to L1 and L2 capsid proteins[J].J Virol,1994,68(11):7570-7574.
[6] McIntyre MC,Frattini MG,Grossman SR,et al.Human papillomavirus type 18 E7 protein requires intact Cys-X-X-Cys motifs for zinc binding,dimerization,and transformation but not for Rb binding[J].J Virol,1993,67(6):3142-3150.
[7] Duensing S,Munger K.The human papillomavirus ty-pe 16 E6 and E7 oncoproteins independently induce numerical and structural chromosome instability[J].Cancer Res,2002,62(23):7075-7082.
