川陈皮素对非酒精性脂肪肝细胞的保护作用和lncLSTR的调控机制
2018-07-02周建伟
汪 娇,蒋 鹏,周建伟△
(1西南医科大学中西医结合学院, 四川 泸州 646000; 2成都市青羊区人民医院全科, 四川 成都 610031)
非酒精性脂肪性肝病(nonalcoholic fatty liver di-sease,NAFLD)是指除了酒精和其它明确损伤因素以外的,由于脂肪过量沉积在肝脏时的临床病理综合征[1-3]。NAFLD通常由肝脏脂质合成和脂质氧化紊乱引起,其中游离脂肪酸(free fatty acid,FFA)在肝细胞中的蓄积具有关键作用。近年研究表明,一些传统中药中的天然成分具有调节血脂和抗氧化等作用,其中川陈皮素(nobiletin)提取自中药陈皮,对多种慢性疾病有良好的防治作用[4-5],但其对NAFLD的治疗作用报道较少。
长链非编码RNA(long noncoding RNA,lncRNA)是一类转录本长度超过200 nt的单链RNA分子,因为缺乏蛋白质编码功能,以往的研究中被认为是“垃圾基因”,最近研究表明,lncRNA参与了机体多种生物过程[6-8],其中,lncLSTR(liver-specific triglyceride regulator)参与了肝脏脂质代谢调控[2]。本研究拟采用离体细胞模型来研究川陈皮素对游离脂肪酸棕榈酸(palmitic acid,PA)[9]诱导的肝细胞脂质沉积的作用及lncLSTR可能的调控机制。
材 料 和 方 法
1 材料
肝细胞AML12购自中科院上海细胞所。PA和川陈皮素购自Sigma;反转录试剂盒和实时荧光定量PCR试剂均购自宝生物工程(大连)有限公司。引物序列通过PrimerBank网站在线获得,PubMed网站进行BLAST验证后由生工生物工程(上海)股份有限公司合成。
2 方法
2.1细胞培养与处理 细胞用含10%胎牛血清的RPMI-1640培养基培养。培养瓶放置于37 ℃、5% CO2培养箱中,细胞生长至铺满瓶底80%左右时消化、传代。
2.2PA脂性培养基配制 根据文献[10],采用0.2 mmol/L的PA诱导肝细胞发生脂质沉积。PA脂性培养基的配制主要步骤为:将PA粉末加入浓度为0.01 mol/L的NaOH溶液中,置70 ℃水浴30 min至PA完全溶解,配制成20 mmol/L的PA溶液;配制30%牛血清白蛋白(bovine serum albumin,BSA)溶液,置55 ℃水浴30 min;取配置好的PA溶液200 μL与330 μL的BSA溶液混匀,加入20 mL的1640 RPMI-培养基,即配成终浓度为0.2 mmol/L的PA脂性培养基。
2.3油红O染色检测肝细胞脂质沉积 将细胞接种于6孔板,对照(control)组细胞不做任何干预;PA组细胞加入0.2 mmol/L的PA培养24 h;预保护(protection)组分别加入1 mg/L、5 mg/L、15 mg/L和50 mg/L的川陈皮素预保护细胞2 h后,再加入0.2 mmol/L的PA刺激细胞,共同培养24 h。24 h后吸弃各组细胞培养基,用PBS冲洗2次,10%甲醛固定15 min,油红O染色30 min,60%异丙醇分化,苏木素复染胞核,显微镜(×400)观察及采集图像。
2.4qPCR检测基因表达 将细胞接种于6孔板,实验分为3个组,对照组、PA组和预保护组(50 mg/L川陈皮素)。每组设3个复孔,重复3次。各组细胞用TRIzol法提取细胞总mRNA,逆转录试剂盒转为cDNA。检测RNA浓度、纯度和完整性后逆转录成cRNA。通过qPCR扩增检测目的基因的表达,反应体系为20 μL。qPCR反应条件为:预变性95 ℃ 3 min;变性95 ℃ 10 s、退火60 ℃ 30 s、返回95 ℃ 10 s,扩增39个循环;65℃~95 ℃,每0.5 ℃ 5 s梯度递增;终止反应。引物序列见表1。荧光定量PCR系统为Applied Biosystems®7300,数据采用StepOne Software v2.3分析。
2.5Western blot检测蛋白表达量 3组细胞蛋白用裂解缓冲液提取。使用BCA蛋白测定试剂盒定量蛋白浓度。蛋白样品用5% SDS-PAGE分离,然后电转移到聚偏二氟乙烯膜上。将膜与多克隆兔抗鼠 I 抗(1 ∶1 000)在4 ℃下孵育12 h,随后与辣根过氧化物酶缀合的山羊抗兔II抗在室温1 h。采用凝胶成像仪采集图像。使用Quantity One对蛋白质条带强度进行定量,内参照选用β-actin。
3 统计学处理
采用软件SPSS 19.0进行统计分析。数据用均数±标准差(mean±SD)表示。3组数据的差异采用单因素方差分析并用Bonferroni校正的t检验对各组均数进行两两比较。率或构成比比较采用卡方检验。以P<0.05为差异有统计学意义。
结 果
1 肝细胞脂质沉积情况
油红O染色结果示,0.2 mmol/L的PA处理肝细胞24 h后,细胞脂质沉积明显;采用1 mg/L、5 mg/L和15 mg/L的川陈皮素预保护后再用PA处理细胞,细胞脂质沉积无明显变化;采用50 mg/L的川陈皮素预保护后用PA处理细胞,细胞内脂质沉积明显减弱,见图1。因此后续实验采用50 mg/L的川陈皮素预保护细胞。

表1 qPCR引物序列Table 1. The sequences of the primers for qPCR
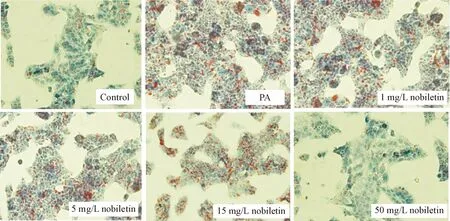
Figure 1. The lipid deposition in hepatocytes detected by Oil red O staining (×400).
图1各组肝细胞油红O染色情况
2 肝脂质代谢相关因子的mRNA表达
为了确定川陈皮素减弱PA诱导的肝脂质沉积的关键调节因子,本研究检测了肝脏脂质合成和氧化相关因子的mRNA表达。相对于对照组,PA组的Apoc2表达明显下调(P<0.01),50 mg/L的川陈皮素预保护对其下调有抑制作用(P<0.01),见图2。
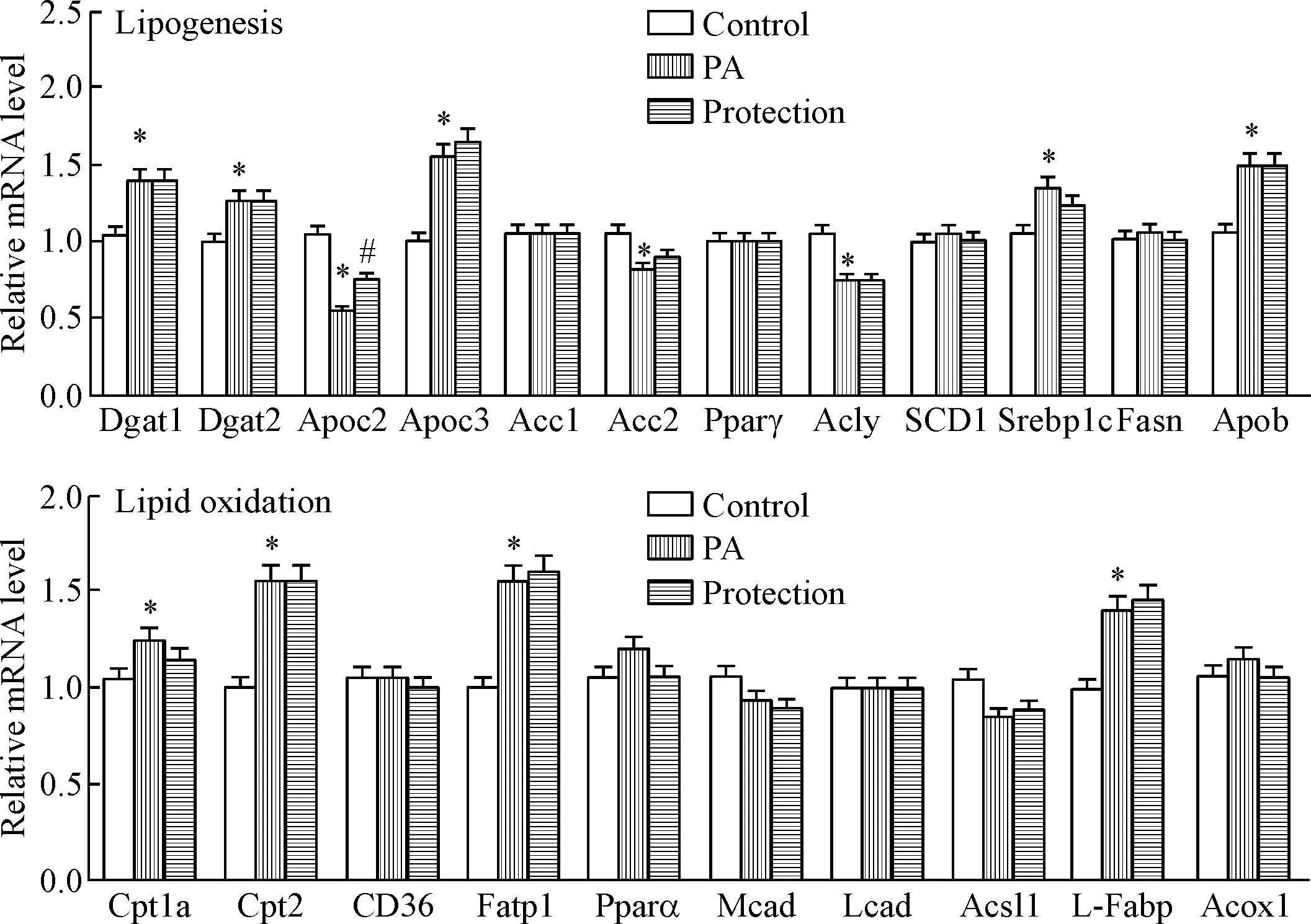
Figure 2. The mRNA expression of lipogenesis-and lipid oxidation-related factors in hepatocytes among groups detected by qPCR. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsPA group.
图2各组细胞脂质合成和脂质氧化相关因子的mRNA表达
3 lncLSTR和Apoc2蛋白的表达
相对于对照组,PA组lncLSTR表达明显升高(P<0.01),预保护组lncLSTR表达比PA组降低(P<0.01),见图3A。相对于对照组,PA组Apoc2蛋白表达明显降低(P<0.01),预保护组Apoc2蛋白表达比PA组升高(P<0.01),见图3B。

Figure 3. The expression of lncLSTR (A) and Apoc2 protein (B) in the hepatocytes among groups. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsPA group.
图33组细胞lncLSTR和Apoc2蛋白的表达
4 Apoc2蛋白与lncLSTR表达相关性分析
采用Pearson相关分析评估Apoc2蛋白与lncLSTR的相关性,结果显示,PA组Apoc2蛋白与lncLSTR的表达呈负相关,具有统计学意义(R2=0.717 9,P<0.01),见图4A;预保护组Apoc2蛋白与lncLSTR表达呈负相关,具有统计学意义(R2=0.525 3,P<0.05),见图4B。
讨 论
NAFLD是影响全球数百万人的全球性慢性非传染性疾病,是慢性肝病的危险因素之一,已成为发达国家慢性肝病的重要病因。目前广泛接受“二次打击”理论来阐述NAFLD发病和进展的理论:“一次打击”为细胞内脂质过度沉积引起的,太多游离脂肪酸经β氧化产生能量的同时也会产生多种氧自由基,导致线粒体损伤。脂质沉积引起的慢性炎症反应构成了“二次打击”[11-13]。然而肝细胞脂肪沉积发生的确切机制和治疗靶点目前尚缺乏足够的认识。
祖国传统医学在NAFLD的治疗优势近年来逐渐受到重视,临床实践也证实中医药对于NAFLD的治疗具有较好的效果。陈皮始见于《神农本草经》:“橘柚,味辛温而命名‘橘皮’”。《药性论》记载陈皮具有清痰涎、开胃理气调中之功效[14-15]。川陈皮素是从陈皮中提取的一种多甲氧基黄酮类化合物,目前已证实具有抗肿瘤、抗氧化和强心升血压等药理学作用,而且对肠平滑肌有双向调节的作用,并可能对代谢性疾病有一定的防治作用[4-5],但目前川陈皮素对于NAFLD的治疗尚未有报道。本研究通过油红O染色发现,50 mg/L的川陈皮素预处理能显著降低PA引起的肝细胞脂质沉积。肝脏是主要的脂质代谢器官,因此本研究检测了12个肝脏脂质合成相关因子和10个脂质氧化相关因子,结果显示PA组Apoc2表达明显下调,川陈皮素对其下调具有明显抑制作用。Apoc2蛋白属于载脂蛋白家族[2],能激活脂蛋白脂酶,清除细胞内甘油三酯。在本研究中PA诱导Apoc2下调并导致甘油三酯清除率降低,而川陈皮素预保护可以抑制这种Apoc2下调导致的甘油三酯清除率降低。
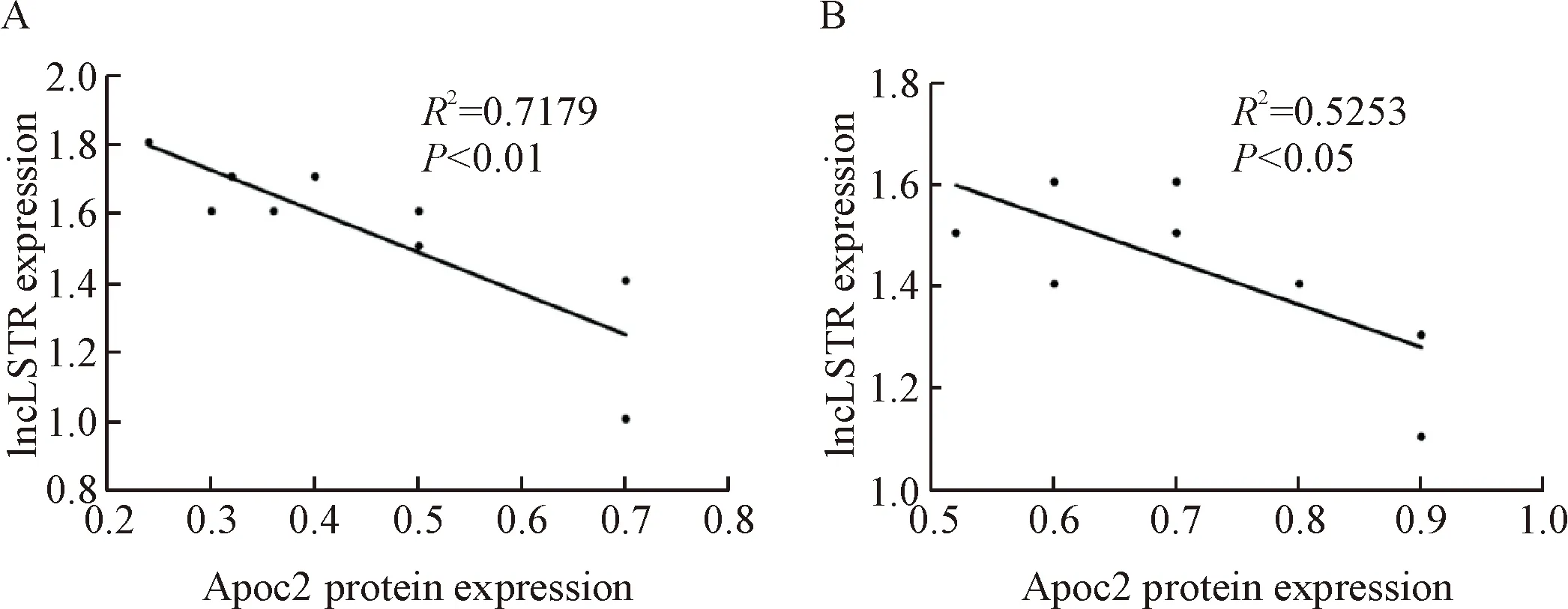
Figure 4. The correlation analysis of Apoc2 protein and lncLSTR expression in PA group (A) and protection group (B).
图4Apoc2蛋白与lncLSTR表达量的相关性分析
lncRNA被定义为长于200 nt的转录本,但是由于缺乏开放阅读框而不具备任何编码蛋白的功能。虽然lncRNA的生理功能在很大程度上是未知的,但是许多lncRNA在肿瘤、细胞周期和代谢中扮演了重要角色[16-17]。lncRNA可通过影响上游基因启动子转录、抑制RNA聚合酶Ⅱ或者介导染色质重构以及组蛋白修饰、与编码蛋白基因的转录本形成互补双链干扰mRNA的剪切等方式调控生理功能[16]。文献报道lncLSTR可以调控Apoc2的表达[2],本研究lncLSTR发现PA组的lncLSTR表达上调,川陈皮素能抑制其上调。采用Pearson相关分析发现PA组和预保护组中Apoc2蛋白与lncLSTR的表达均呈负相关。这些结果说明lncLSTR的上调可能直接/间接调控了Apoc2的表达,而川陈皮素有可能调节lncLSTR的表达来抑制PA诱导的肝细胞脂质沉积,具体机制将在以后的研究中验证。
综上所述,本次研究通过棕榈酸诱导肝细胞脂质沉积建立NAFLD细胞模型,观察到川陈皮素减轻PA对肝细胞脂质沉积的作用。本研究的结果提示川陈皮素对肝细胞的保护作用主要是通过抑制肝脏中lncLSTR的上调、进而抑制肝脏Apoc2下调、增加肝脏甘油三酯清除率来实现的。本研究为探索川陈皮素在治疗NAFLD中的应用和从中医药的角度寻找NAFLD治疗上新的靶点提供了新的实验证据。
[参 考 文 献]
[1] Hwang JT, Shin EJ, Chung MY, et al. Ethanol extract of Allium fistulosum inhibits development of non-alcoholic fatty liver disease[J]. Nutr Res Pract, 2018, 12(2):110-117.
[2] Li P, Ruan X, Yang L, et al. A liver-enriched long non-coding RNA, lncLSTR, regulates systemic lipid metabolism in mice[J]. Cell Metab, 2015, 21(3):455-467.
[3] Agyei-Nkansah A. Mitigating the scourge of non-alcoholic fatty liver disease in Ghana[J]. Ghana Med J, 2017, 51(3):98-100.
[4] 杨 华, 田 萌, 刘喜燕. 川陈皮素对脑梗死大鼠 HIF-1α和VEGF含量及神经细胞凋亡的影响与机制[J]. 临床和实验医学杂志, 2017, 16(20):1980-1983.
[5] 车 妍, 唐其柱, 张 宁, 等. 川陈皮素对脂毒性心肌病的保护作用机制研究[J]. 中华生物医学工程杂志, 2016, 22(6):439-444.
[6] Chen G, Yu D, Nian X, et al. LncRNA SRA promotes hepatic steatosis through repressing the expression of adipose triglyceride lipase (ATGL)[J]. Sci Rep, 2016, 6:35531.
[7] Zhu X, Wu YB, Zhou J, et al. Upregulation of lncRNA MEG3 promotes hepatic insulin resistance via increasing FoxO1 expression[J]. Biochem Biophys Res Commun, 2016, 469(2):319-325.
[8] Zhou G, Li C, Feng J, et al. lncRNA UCA1 is a novel regulator in cardiomyocyte hypertrophy through targeting the miR-184/HOXA9 axis[J]. Cardiorenal Med, 2018, 8(2):130-139.
[9] Joshi-Barve S, Barve SS, Amancherla K, et al. Palmitic acid induces production of proinflammatory cytokine interleukin-8 from hepatocytes[J]. Hepatology, 2007, 46(3):823-830.
[10] Akazawa Y, Cazanave S, Mott JL, et al. Palmitoleate attenuates palmitate-induced Bim and PUMA up-regulation and hepatocytes lipoapoptosis[J]. J Hepatol, 2010, 52(4):586-593.
[11] 孙 莉, 宋海燕, 季 光. 非酒精性脂肪肝代谢调控与炎症反应的共同通路[J]. 中华肝脏病杂志, 2011, 19(5):395-397.
[12] Zhou YY, Zhou XD, Wu SJ, et al. Nonalcoholic fatty liver disease contributes to subclinical atherosclerosis: a systematic review and meta-analysis[J]. Hepatol Commun, 2018, 2(4):376-392.
[13] 杨卫利, 王君佩, 崔庆华, 等. 非编码RNA与肝脏糖脂代谢调控[J]. 生理科学进展, 2016, 47(3):194-202.
[14] 李欣然, 王 静, 余晓燕, 等. 陈皮的研究进展[J]. 中国医药指南, 2016, 14(24):31-32.
[15] 何占坤, 张国梁, 唐 方, 等. 陈皮、藿香不同提取物对胃肠动力障碍大鼠胃肠平滑肌收缩活动及胃肠激素的影响[J]. 天津医药, 2017, 45(11):1175-1179.
[16] Wang YH, Ji J, Wang BC, et al. Tumor-derived exosomal long noncoding RNAs as promising diagnostic biomarkers for prostate cancer[J]. Cell Physiol Biochem, 2018, 46(2):532-545.
[17] 易 红, 张 政. lncRNA与miRNA相互作用对疾病的影响[J]. 基础医学与临床, 2016, 36(2):267-271.
