上调miR-133a表达水平对自发性高血压大鼠心肌纤维化的影响*
2018-07-02谭文鹏李文杰黄兆琦
谭文鹏,李文杰,黄兆琦
(广州医科大学附属第三医院心内科, 广东 广州 510150)
高血压是发病率极高的心血管疾病,可以诱导心肌纤维化和细胞凋亡等心肌重构表现,最终导致心力衰竭。微小核糖核酸(microRNA,miRNA,miR)通过与目标基因的信使RNA结合,调控其翻译水平从而影响目标蛋白的表达[1-3]。miRNAs在心肌重构、增殖和分化等过程中具有重要的调控作用[4-5]。miR-133a是心肌组织中含量最丰富的miRNA之一,密切参与心肌肥厚和细胞凋亡等病理生理过程[6-7]。在心肌梗死患者及动物模型中,心肌组织中miR-133表达水平均明显降低[8-9]。近期研究显示,miR-133a有望成为心血管疾病新的治疗靶点[6, 10]。本文通过上调心肌组织中miR-133a表达水平,观察其对自发性高血压大鼠(spontaneously hypertensive rats, SHR)心肌纤维化的影响。
材 料 和 方 法
1 实验动物和试剂
14周龄的雄性SHR随机分为SHR组、空白病毒转染(SHR+AAV)组和miR-133a过表达(SHR+miR-133a-AAV)组,每组8只,另取8只14周龄的雄性Wiskar-Kyoto(WKY)大鼠设为正常对照(WKY)组。大鼠体质量220~240 g,购自北京维通利华生物公司,许可证编号为SCXK(京)2013-0009,清洁环境喂养。采用心脏亲和性高的9型腺相关病毒(adeno-associated virus-9,AAV-9)作为载体。AAV和miR-133a-AAV 由深圳百恩维公司合成。抗转化生长因子-β1(transforming growth factor-β1,TGF-β1)小鼠单克隆抗体(MAB240,R&D);抗结缔组织生长因子(connective tissue growth factor,CTGF)兔多克隆抗体(ab6992,Abcam);抗β-actin抗体(Jackson,稀释度1∶1 000);TRIzol试剂(Invitrogen);miScript Reverse Transcription Kit、miR-133a引物和内参照U6引物(QIAGEN)。
2 方法
2.1携带miR-133a的腺相关病毒构建 首先构建中间载体质粒pGenesil-12-pre-miR-133a,限制性酶切位点后的片段中包含了启动子及目的基因miR-133a的2个臂,即miR-133a-5’和miR-133a-3’;然后构建腺相关病毒质粒pAAV-pre-miR-133a,包含转录终止信号和哺乳动物细胞高水平基因表达的相关元件。将质粒导入AAV-293细胞,产生含目的基因miR-133a的腺相关病毒,滴度1×1011TU/L。
2.2大鼠血压测量 在大鼠安静清醒状态下用无创测压法测定大鼠尾动脉压。恒温系统加热至39 ℃,使尾动脉出现明显的搏动波,尾袖气囊充气,阻断尾动脉搏动波,缓慢放气测量血压,反复测量3次。
2.3miR-133a-AAV转染大鼠心肌 大鼠腹腔注射10%水合氯醛(350 mg/kg)麻醉,仰卧位固定。暴露气管,横向剪开气管2~3 mm,插管连接小型动物呼吸机行呼吸支持,设定呼吸频率70次/min,潮气量10~12 mL,呼吸比1∶1。开胸后暴露心脏,采用冠脉灌注法转导病毒载体:miR-133a-AAV组大鼠左心室腔内注射0.1 mL miR-133a-AAV,空白病毒组注射0.1 mL AAV。注射病毒液的同时用血管钳夹闭主动脉10 s,使病毒液不能进入体循环而泵入冠状动脉。关胸后撤除呼吸机,缝合颈部皮肤。
2.4大鼠心肌组织Masson染色及观察 4组大鼠均在转染4周后(18周龄时)取心脏标本。心肌组织石蜡切片行Masson胶原染色,光学显微镜下观察心肌组织胶原改变。测量心肌胶原容积分数[collagen volume fraction,CVF,CVF(%)=心肌胶原面积∕所测视野面积×100%]及血管周围胶原面积与管腔面积比率(perivascular collagen area to lurninal area ratio,PVCA/LA=小动脉周围胶原面积∕小动脉管腔面积)。
2.5免疫组织化学染色 切片脱蜡后抗原热修复,消除内源性过氧化物酶,分别加入小鼠抗大鼠TGF-β1单克隆抗体(1∶50)和兔抗大鼠CTGF兔多克隆抗体(1∶800),4 ℃孵育过夜;相应 II 抗室温孵育2 h;ABC工作液孵育后DAB法显色。光学显微镜下观察,棕色颗粒为阳性。
2.6Western blot检测 提取心肌组织总蛋白,测定蛋白浓度;行10% SDS-PAGE 分离蛋白质,转膜;封闭1 h,加入抗TGF-β1小鼠单克隆抗体(1∶10 000)和CTGF兔多克隆抗体(1∶5 000),4 ℃孵育过夜;加入羊抗鼠II抗(1∶2 000)和羊抗兔 II 抗(1∶5 000)室温孵育1 h;显色显影定影,扫描胶片,用图像分析软件进行灰度分析。
2.7Real-time PCR 提取大鼠心肌总RNA;逆转录合成cDNA,逆转录反应体系为miScript HiFlex Buffer 2 μL、Nucleics Mix 1 μL、miScript Reverse Trans-criptase Mix 1 μL和总RNA 6 μL。miR-133a的上游引物序列为5’-GCCAAGCTGGTAAAATGGAA-3’,下游引物序列为5’-TATGGTTTTGACGACTGTGTGAT-3’,内参照U6的上游引物序列为5’-CTCGCTTCGGCAGCACA-3’,下游引物序列为5’-AACGCTTCACGAATTTGCG-3’。PCR反应体系为cDNA 1 μL、miScript Universal Primer 1 μL、miR-133a引物或U6引物各1 μL、SYBR Green qPCR Mix 10 μL和水7 μL。PCR扩增反应完成后,在实验系统中调整基线和阈值,达到阈值时的循环数为各反应孔的Ct值。目的基因相对量用2-ΔΔCt法计算。
3 统计学处理
采用SPSS 22.0软件对数据进行统计分析。检测结果以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 大鼠的一般情况
与对照组比较,SHR组、SHR+AAV组和SHR+miR-133a-AAV组大鼠的尾动脉收缩压(systolic blood pressure,SBP)和舒张压(diastolic blood pressure,DBP)均明显升高,见表1。
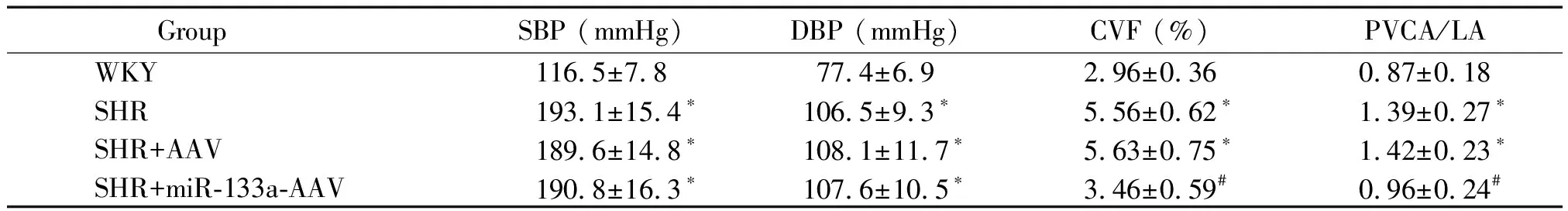
表1 各组大鼠尾动脉压与心肌胶原含量的变化Table 1. Comparison of tail artery pressure and collagen in myocardial tissues of the rats (Mean±SD. n=8)
*P<0.05vsWKY group;#P<0.05vsSHR group.
2 大鼠心肌组织中miR-133a的表达
SHR组大鼠心肌组织中miR-133a表达水平明显低于对照组;冠脉灌注miR-133a-AAV至大鼠心脏,4周后检测心肌组织中miR-133a的表达,发现miR-133a表达水平显著升高(P<0.05),见图1。

Figure 1. The expression of miR-133a in the myocardial tissues of rats. Mean±SD.n=8.*P<0.05vsWKY group;#P<0.05vsSHR group.
图1各组大鼠心肌组织中miR-133a的表达
3 大鼠心肌组织Masson染色结果
与对照组相比,SHR组大鼠心肌细胞间隙增宽,可见大量蓝色胶原纤维沉积,出现明显的心肌纤维化,CVF和PVCA/LA明显升高(P<0.05);与SHR组相比,SHR+miR-133a-AAV组大鼠心肌细胞胶原沉积明显减少,心肌纤维化程度降低,CVF和PVCA/LA明显降低(P<0.05),见图2、表1。
4 大鼠心肌组织TGF-β1和CTGF蛋白表达的变化
免疫组化检测显示,TGF-β1主要在成纤维细胞中表达,分布在细胞膜、细胞浆及细胞间隙,CTGF表达在成纤维细胞及心肌细胞,主要分布在胞浆。对照组心肌组织中有少量TGF-β1和CTGF表达,SHR组心肌组织中可见TGF-β1和CTGF大量表达,SHR+miR-133a-AAV组心肌TGF-β1和CTGF表达减少,见图3、4。Western blot定量检测显示,SHR组心肌组织中TGF-β1和CTGF蛋白表达水平显著高于对照组,SHR+miR-133a-AAV组心肌组织中TGF-β1和CTGF蛋白表达水平明显低于SHR组(P<0.05),见图5。
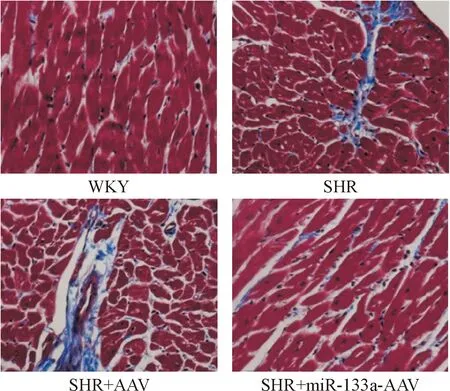
Figure 2. Masson staining of the myocardial tissues of the rats (×400).
图2大鼠心肌组织Masson染色结果
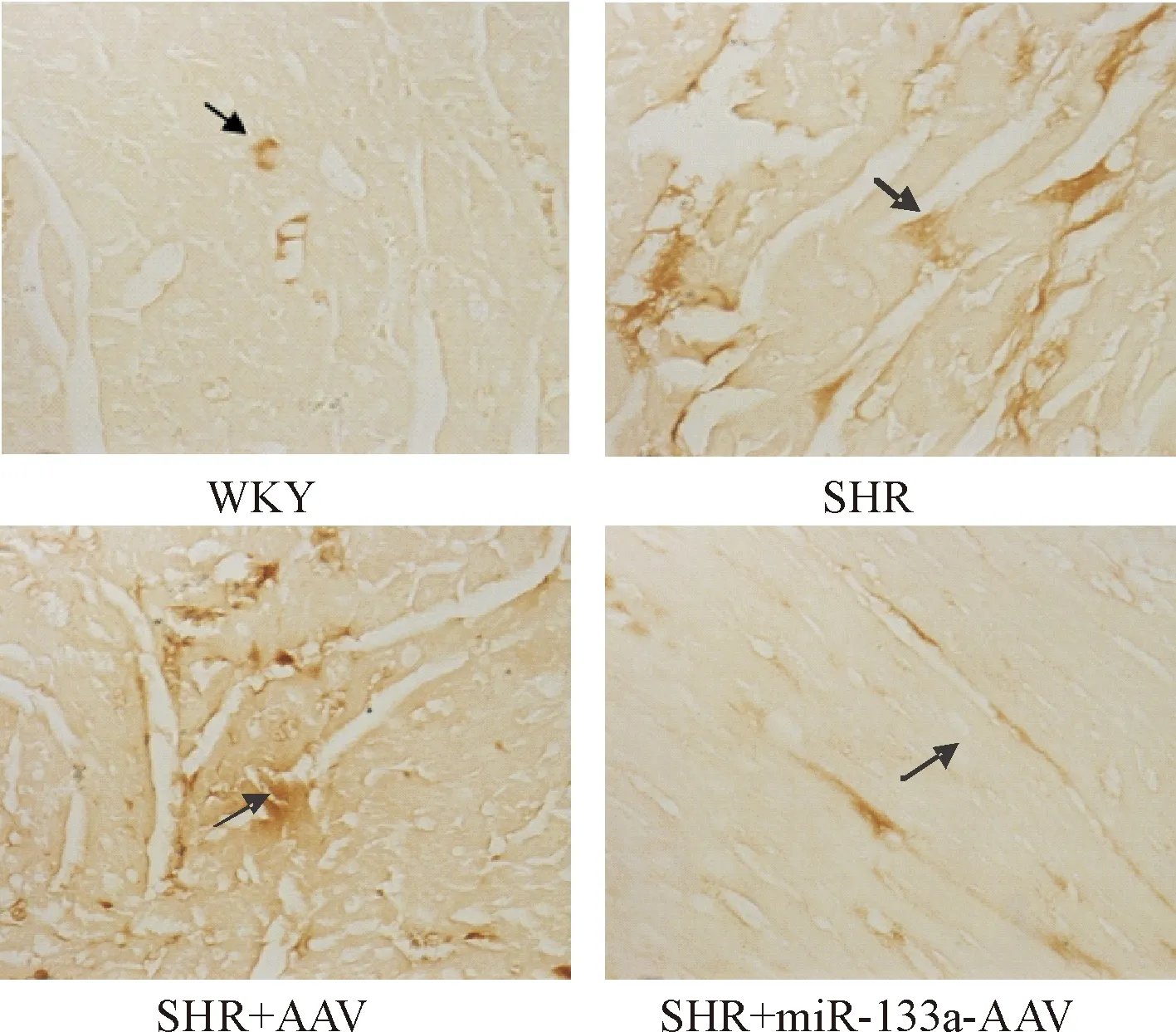
Figure 3. The immunohistochemical staining for TGF-β1 in the myocardial tissues of the rats (×400).
图3大鼠心肌组织中TGF-β1免疫组化结果
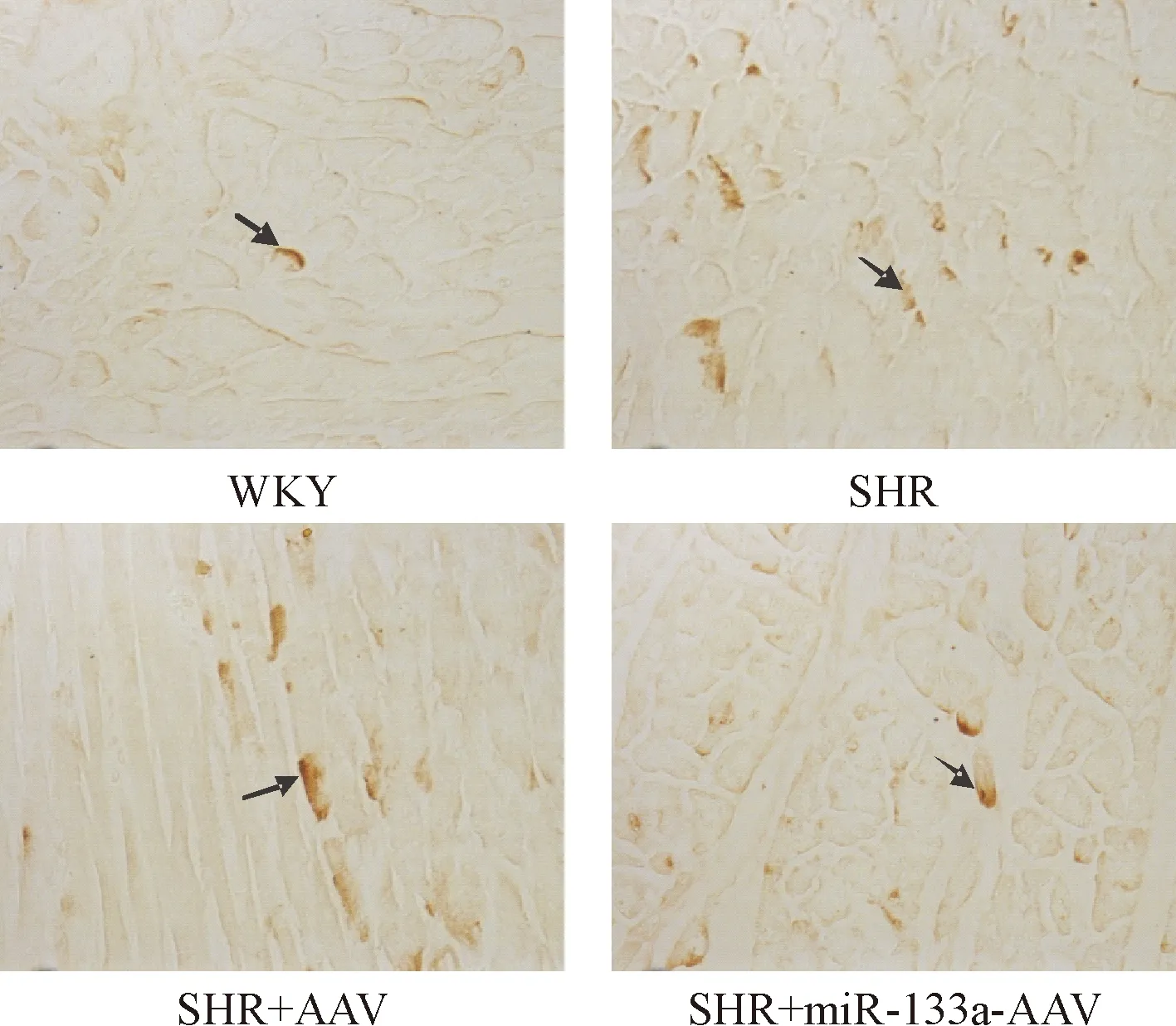
Figure 4. The immunohistochemical staining for CTGF in the myocardial tissues of the rats (×400).
图4大鼠心肌组织中CTGF免疫组化结果

Figure 5. The protein levels of TGF-β1 and CTGF in the myocardial tissue of the rats. Mean±SD.n=12.*P<0.05vsWKY group;#P<0.05vsSHR group.
图5各组大鼠心肌组织中TGF-β1和CTGF蛋白水平的变化
讨 论
miR-133a是肌肉特异性miRNA,在心肌组织中表达丰富。在心肌梗死患者和动物模型中,心肌miR-133a表达水平出现明显降低,并影响心肌收缩力[8-9]。研究显示,miR-133a基因敲除小鼠的心脏发生严重的心肌纤维化,并最终因心力衰竭死亡,表明miR-133a在心肌细胞间质合成平衡中具有关键作用[11]。高血压可导致心肌细胞外间质胶原沉积,引起心脏结构和功能异常。研究发现,在自发性高血压大鼠心肌组织中miR-133a的表达水平显著降低,伴随明显的胶原沉积[12],说明miR-133a可能参与高血压心肌纤维化的进程。
TGF-β1和CTGF是非常重要的促纤维化的细胞因子[13]。TGF-β1是调节细胞外间质代谢和启动纤维化的关键因子[14];CTGF是TGF-β1促纤维化作用通路的重要下游因子,并维持纤维化进展[15]。TGF-β1在成纤维细胞及心肌细胞都能诱导产生CTGF。TGF-β1通过Smad信号通路以及细胞激酶C和Ras/MEK/ERK信号途径诱导CTGF合成,共同形成复杂的调控网络[15-16]。研究发现,在尼古丁刺激下的心房成纤维细胞中,miR-133a表达水平下调并导致TGF-β1蛋白水平显著升高,伴随大量胶原合成[17];在SRF基因过表达的心肌肥厚动物模型中,miR-133a表达下调导致CTGF大量合成[18]。miR-133a与TGF-β1/CTGF有密切关系,但是miR-133a能否通过TGF-β1/CTGF途径调控高血压心肌纤维化尚不明确。
本研究发现,SHR的尾动脉压明显升高,伴随心肌细胞间隙大量胶原纤维沉积,导致心肌纤维化。病理检测显示SHR心肌成纤维细胞及心肌细胞合成大量TGF-β1及CTGF,蛋白定量检测也发现,SHR心肌TGF-β1及CTGF蛋白水平明显升高;上调SHR心肌miR-133a表达水平,抑制了心肌TGF-β1及CTGF蛋白合成,使心肌间隙的胶原沉积减少,心肌纤维化水平显著降低。
因此,我们推测miR-133a通过抑制TGF-β1及CTGF蛋白表达,对高血压心肌纤维化发挥调控作用,为高血压纤维化治疗寻找新靶点提供了依据。
[参 考 文 献]
[1] Ul Hussain M. Micro-RNAs (miRNAs): genomic organisation, biogenesis and mode of action[J]. Cell Tissue Res, 2012,349(2):405-413.
[2] Lee S, Vasudevan S. Post-transcriptional stimulation of gene expression by microRNAs[J]. Adv Exp Med Biol, 2013,768:97-126.
[3] 何 铃, 方梅霞, 陈利国, 等. 高血压病血瘀证相关miRNA的筛选[J]. 中国病理生理杂志, 2015,31(5):817-822.
[4] Lv D, Liu J, Zhao C, et al. Targeting microRNAs in pathological hypertrophy and cardiac failure[J]. Mini Rev Med Chem, 2015,15(6):475-478.
[5] Tao L, Bei Y, Zhou Y, et al. Non-coding RNAs in cardiac regeneration[J]. Oncotarget, 2015,6(40):42613-42622.
[6] Chen Y, Sun P, Bai W, et al. MiR-133a regarded as a potential biomarker for benzene toxicity through targeting Caspase-9 to inhibit apoptosis induced by benzene metabolite (1,4-Benzoquinone)[J]. Sci Total Environ, 2016, 571: 883-891.
[7] Diniz GP, Lino CA, Guedes EC, et al. Cardiac micro RNA-133 is down-regulated in thyroid hormone-mediated cardiac hypertrophy partially via Type 1 Angiotensin II receptor[J]. Basic Res Cardiol, 2015, 110(5):49.
[8] BoštjaniE, Zidar N, GlavaD. MicroRNAs and cardiac sarcoplasmic reticulum calcium ATPase-2 in human myocardial infarction: expression and bioinformatic analysis[J]. BMC Genomics, 2012,13:552.
[9] Dakhlallah D, Zhang J, Yu L, et al. MicroRNA-133a engineered mesenchymal stem cells augment cardiac function and cell survival in the infarct heart[J]. J Cardiovasc Pharmacol, 2015,65(3):241-251.
[10] Liu Y, Liang Y, Zhang JF, et al. MicroRNA-133 mediates cardiac diseases: Mechanisms and clinical implications[J]. Exp Cell Res, 2017, 354(2):65-70.
[11] Liu N, Bezprozvannaya S, Williams AH, et al. micro RNA-133a regulates cardiomyocyte proliferation and suppresses smooth muscle gene expression in the heart[J]. Genes Dev, 2008, 22(23):3242-3254.
[12] 谭文鹏, 杨 侃, 陈晞明, 等. 自发性高血压大鼠心肌组织microRNA-133a与TGF-β1蛋白表达的改变及意义[J]. 中国病理生理杂志, 2013, 29(4):748-751.
[13] 应赵建, 黄晓敏, 余垭妮, 等. PI3K/CTGF信号通路在TGF-β1诱导A549细胞表达collagen Ⅰ过程中的作用[J]. 中国病理生理杂志, 2017, 33(3):489-494.
[14] Liu G, Ma C, Yang H, et al. Transforming growth factor β and its role in heart disease[J]. Exp Ther Med, 2017, 13(5):2123-2128.
[15] Chatzifrangkeskou M, Le Dour C, Wu W, et al. ERK1/2 directly acts on CTGF/CCN2 expression to mediate myocardial fibrosis in cardiomyopathy caused by mutations in the lamin A/C gene[J]. Hum Mol Genet, 2016, 25(11):2220-2233.
[16] Cheng JC, Chang HM, Fang L, et al. TGF-β1 up-regulates connective tissue growth factor expression in human granulosa cells through Smad and ERK1/2 signaling pathways[J]. PLoS One, 2015,10(5):e0126532.
[17] Shan H, Zhang Y, Lu Y, et al. Downregulation of miR-133 and miR-590 contributes to nicotine-induced atrial remodelling in canines[J]. Cardiovasc Res, 2009, 83(3):465-472.
[18] Angelini A, Li Z, Mericskay M, et al. Regulation of connective tissue growth factor and cardiac fibrosis by an SRF/microRNA-133a axis[J]. PLoS One, 2015,10(10):e0139858.
