赶黄草配伍葛花对乙醇诱导下L-02肝细胞的影响*
2018-07-02舒承倩吴晶魁
舒承倩,吴晶魁,周 滢△
(1重庆医科大学中医药学院中医药研究室, 重庆 400016; 2天津医科大学, 天津 300070)
酒精性肝病(alcoholic liver disease,ALD)主要由于酒精的大量摄入,继而引发的中毒性肝损伤,是世界范围内高发病率和死亡率的一个重要原因[1]。在过去的数十年中,研究人员认为ALD的发病机制主要与氧化应激、炎症反应、肠道微生态、细菌脂多糖(lipopolysaccharide,LPS)通路以及先天免疫系统有关[2]。在ALD的初期,炎症反应起着重要的作用[3],释放的肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素6(interleukin-6,IL-6),扩大炎症反应,最终导致肝损伤[4]。丙氨酸转氨酸(alanine aminotransferase,ALT)和天冬氨酸转氨酶(aspartate aminotransferase,AST)是反映肝功能异常的重要指标。值得注意的是,最近的研究证实核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)对减轻氧化应激具有决定性的作用,长期的酒精摄入会导致Nrf2及相关靶目标表达的下调[5-6]。抗氧化酶,如超氧化物歧化酶(superoxide dismutase,SOD)在肝脏抗氧化系统中发挥重要的作用,而丙二醛(malondialdehyde,MDA)被广泛的认为是氧化应激的标记物,是脂质过氧化物及脂质自身增加引起的活性氧簇(reactive oxygen species,ROS)和酒精诱导的肝损伤表现相关的一个有力证据[7-8]。
赶黄草(PenthorumchinensePursh)作为四川古蔺解酒道地药材,具有抗氧化和保肝护肝的药理作用[9-10];同样作为解酒专药的葛花(Puerariaeflos),其提取的活性成分均有抗炎作用[11]。赶黄草和葛花为治疗酒精性肝损伤的常用药,在临床运用中分别治疗酒精性肝病,保肝疗效显著。但二药配伍合用能否共同降低炎症反应,减少氧化应激,鲜有相关报道,有待验证。本实验运用real-time PCR 和Western blot方法检测乙醇诱导的L-02肝细胞损伤模型中TNF-α、IL-6、Nrf2和HO-1 mRNA和蛋白的表达,探讨其可能的作用机制,为指导临床提供实验依据。
材 料 和 方 法
1 材料
1.1细胞株和实验动物 人正常肝细胞L-02购自中国科学院上海细胞库,由重庆医科大学药学院提供。SPF级SD大鼠,雌雄各半,体重在200~220 g,由重庆医科大学动物实验中心提供,动物许可证号为SYXK(渝)2012-0001。
1.2药物和试剂 赶黄草和葛花饮片均购自太极集团重庆桐君阁大药房,药物经重庆医科大学中医药学院曹纬国副教授鉴定为正品。兔抗人TNF-α多克隆抗体和兔抗人IL-6多克隆抗体(BIOSS,货号分别为bs-2081R和bs-4539R,规格均为0.1 mL); 兔抗人血红素加氧酶1(heme oxygenase-1, HO-1)多克隆抗体和兔抗人Nrf2多克隆抗体(Affinity,货号分别为AF5393和AF0639,规格均为50 μL);逆转录试剂盒和SYBR Green(TaKaRa);ALT、AST、SOD和MDA检测试剂盒(南京建成生物工程研究所);胎牛血清(Biological Industries);RPMI-1640培养基、0.25% 胰蛋白酶和1%双抗(HyClone);MTT和DMSO(Sigma)。
1.3仪器 PCR仪(Applied Biosystems);台式蒸汽灭菌锅(LabTech);低温离心机(Sigma);ND-2000核酸蛋白分析仪(NanoDrop);倒置显微镜(Leica);超净台(中国苏州安泰空气技术有限公司);数显三用恒温水箱(金坛市荣华仪器制造有限公司);Gel Doc 2000凝胶成像系统(Bio-Rad);多功能酶标仪(BioTek)。
2 方法
2.1药物制备 赶黄草配伍葛花1∶1组、2∶1组和1∶2组成人临床用量分别为0.5 g/kg、0.75 g/kg和0.75 g/kg,按“动物与人体每公斤体重折算系数表”(成人与大鼠折算系数为6.25)计算,大鼠相对于成人的临床等效剂量分别为3.13 g/kg、4.69 g/kg和4.69 g/kg,此为低剂量,按照1、2和4倍来确定低、中、高剂量。实验选择4倍高剂量为大鼠灌胃剂量。凯西莱(tiopronin)药物组按60 mg/kg给药,生理盐水组按照10 mL/kg给药。
2.2含药血清制备 50只SPF级清洁SD大鼠适应性饲养1周后,随机分为5组:生理盐水组,赶黄草配伍葛花1∶1组、2∶1组和1∶2组,凯西莱组。各组均按每天10 mL/kg 的量给药,每天2次,连续3 d,最后1次灌胃2 h后用乙醚麻醉,无菌条件下心脏采血。血液静置4 h,3 000 r/min离心15 min后收集含药血清。56 ℃、30 min水浴灭活,0.22 μm过滤器过滤收集含药血清。
2.3细胞培养 L-02细胞在5%CO2、37 ℃的细胞培养箱中用含10%胎牛血清的完全培养基(内含RPMI-1640和1%双抗)中培养。每日在显微镜下观察细胞状态,细胞隔天换液1次,细胞覆盖培养瓶底80%~90%左右时进行传代。
2.4细胞干预 倒置显微镜下观察细胞生长至80%~90%时加入0.25%胰酶消化,进行实验。实验分为6组:空白对照组,模型组,赶黄草配伍葛花1∶1组、2∶1组和1∶2组,凯西莱组。空白对照组和模型组给予含10%生理盐水组大鼠血清的RPMI-1640培养基,1∶1组、2∶1组和1∶2组分别给予相应组别的10%赶黄草配伍葛花的含药血清,凯西莱组给予10%凯西莱含药血清。给药1 h后,除空白对照组继续用含有10%生理盐水组大鼠血清的RPMI-1640培养基外,其余各组均给予含终浓度100 mmol/L乙醇的RPMI-1640培养基。各组细胞在5%CO2、37 ℃的细胞培养箱中培养24 h后收集细胞。
2.5MTT法检测含药血清对乙醇损伤 L-02 细胞活力的影响 将处于对数生长期且存活率大于90%的L-02细胞用完全培养基混成1×108/L的细胞悬液,接种于96孔板(90 μL),设调零组(含10%生理盐水血清的完全培养基)、空白对照组、模型组、1∶1组、2∶1组、1∶2组和凯西莱组。每组设6个复孔,48 h后细胞贴壁达90%以上,空白对照组、调零组和模型组加入完全培养基代替,其余各组加入相应的10%含药血清进行预处理。给药1 h后,除调零组和空白对照组加入完全培养基外,其余各组分组给予终浓度100 mmol/L乙醇的RPMI-1640培养基,各孔10 μL。继续培养24 h后去培养液,所有孔加入浓度为5 g/L 的MTT (每孔20 μL)孵箱孵育4 h后,弃上清加入150 μL DMSO充分溶解结晶,振荡10 min,酶标仪上490 nm波长处检测吸光度(A)值。实验孔实际A值=实验孔实测A值-调零孔A值。细胞活力(%)=(实验组A值-调零组A值)/(正常组A值-调零组A值)。
2.6含药血清对乙醇损伤L-02细胞ALT、AST、MDA及SOD水平的影响 将L-02细胞接种于48孔板中,接种体积为每孔180 μL,加样和造模体积为每孔20 μL,其余方法均同2.5。培养24 h后,分别取细胞上清液和提取肝细胞,用试剂盒及酶标仪检测ALT(510 nm波长)、AST(510 nm波长)、MDA(530 nm波长)和SOD(450 nm波长)的A值,计算相应指标。
2.7Real-time PCR法检测L-02肝细胞内TNF-α、IL-6、Nrf2和HO-1的mRNA表达 L-02细胞按每孔1×108/L接种于6孔板,每孔2.5 mL,待细胞生长至80%~90%融合时,吸弃培养基,各组加入相应含药血清及试剂,24 h后收集细胞。提取细胞总RNA并收集样本:移入 1.5 mL EP管中,加1 mL TRIzol,冰上裂解 20 min,加0.2 mL氯仿,漩涡振荡混匀;4 ℃离心机中12 000 r/min 离心5 min;转上层水相(约 400 μL)于另一1.5 mL EP 管中;加等体积异丙醇,振荡混匀;4 ℃离心机中12 000 r/min离心20 min;弃上清,加预冷的75%乙醇1 mL;4 ℃,12 000 r/min离心 5 min;弃上清,加无水乙醇 1 mL;4 ℃,12 000 r/min离心5 min;弃上清,空气干燥 5~10 min; 溶于 40 μL DEPC 水中,使用NanoDrop ND-2000超微量核酸蛋白测定仪测RNA浓度并校准,按逆转录试剂盒说明书步骤进行逆转录。Real-time PCR步骤按照TaKaRa说明书操作,运用2-ΔΔCt方法计算用药组与对照组的比值。β-actin、TNF-α、IL-6、Nrf2和HO-1的引物均由上海生工生物工程有限公司合成,序列见表1。

表1 引物序列Table 1. The sequences of the primers for real-time PCR
2.8Western blot检测L-02肝细胞内TNF-α、IL-6、Nrf2和HO-1蛋白的表达 L-02细胞接种、培养及药物处理同2.7。将细胞收集后用蛋白裂解液裂解细胞,冰上裂解30 min,4 ℃ 12 000 r/min离心 20 min;提取的细胞蛋白用BCA法测定蛋白浓度。灌制凝胶,12%分离胶,5%浓缩胶; 上样量 50 μg,电泳结束后取出凝胶,和相同大小的PVDF置于3层滤纸中间,放入转移槽中,加满转移液,电转300 mA 约 90 min。取出 PVDF 膜,晾干后,置于 95% 乙醇中固定,TBST洗 5 min; 放入 5% 脱脂奶粉中封闭,室温下1 h;TBST洗3次,每次10 min,加 I 抗,室温下3~4 h; TBST洗3次,每次10 min; 加 II 抗,室温下1~2 h; TBST洗3次,每次10 min,ECL发光,并使用ImageJ统计条带强度。
3 统计学处理
采用SPSS 19.0统计软件分析。数据用均数±标准差(mean±SD)表示。组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 含药血清对乙醇损伤的L-02细胞活力的影响
与空白对照组相比,模型组细胞活力明显降低,差异有统计学意义(P<0.01),表明造模成功;与模型组相比,1∶1组、2∶1组和1∶2组及凯西莱组的细胞活力均明显提高,差异有统计学意义(P<0.01);各治疗组间的差异无统计显著性,见图1。

Figure 1. The effects of drug-containing serum on the viability of L-02 cells induced by ethanol. Mean±SD.n=6.**P<0.01vscontrol group;##P<0.01vsmodel group.
图1含药血清对乙醇诱导损伤的L-02细胞存活率的影响
2 含药血清对乙醇损伤的L-02细胞中ALT、AST、MDA及SOD水平的影响
酶标法检测结果显示,与空白对照组相比,模型组的ALT、AST和MDA水平均明显增高,SOD活性明显降低(P<0.01);与模型组相比,1∶1组、2∶1组、1∶2组和凯西莱组的ALT、AST和MDA水平均明显降低,SOD活性明显增高(P<0.01),见表2。
3 Real-time PCR的结果
与空白对照组相比,模型组TNF-α和IL-6的mRNA表达均显著上调,Nrf2和HO-1 的mRNA表达均显著下调(P<0.01);与模型组相比,1∶1组、2∶1组、1∶2组和凯西莱组TNF-α和IL-6的mRNA表达均显著下调,Nrf2和HO-1的mRNA表达均显著上调(P<0.01),见表3、4。

表2 含药血清对乙醇损伤的L-02 细胞中ALT、AST、MDA及SOD水平的影响Table 2. The levels of ALT, AST, MDA and SOD in the L-02 liver cells (Mean±SD. n=6)
**P<0.01vscontrol group;##P<0.01vsmodel group.
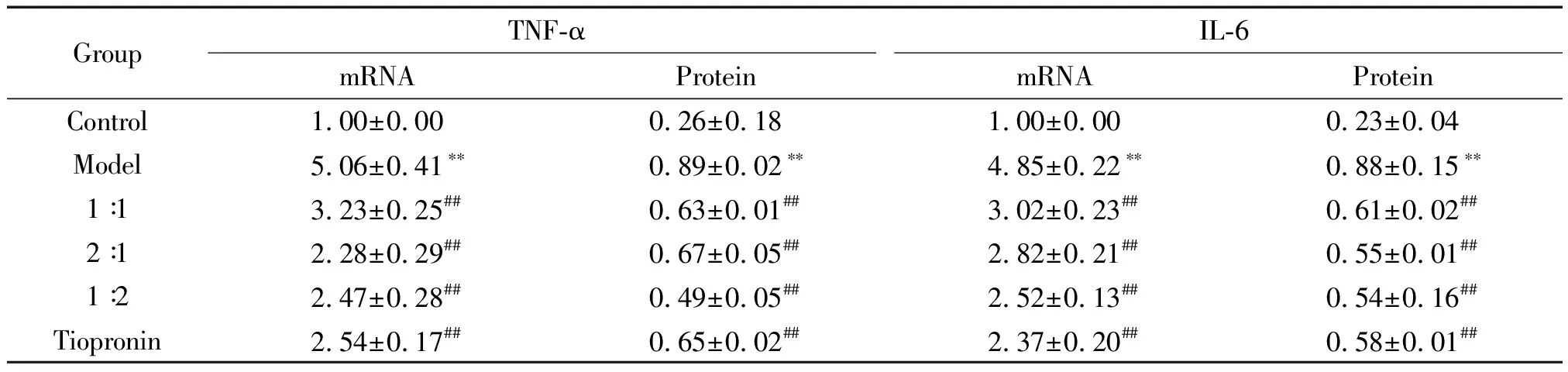
表3 含药血清对乙醇损伤的L-02 细胞中TNF-α和IL-6 mRNA和蛋白表达的影响Table 3. The expression of TNF-α and IL-6 at mRNA and protein levels in the L-02 liver cells (Mean±SD. n=3)
**P<0.01vscontrol group;##P<0.01vsmodel group.

表4 含药血清对乙醇损伤的L-02 细胞中Nrf2和HO-1 mRNA和蛋白表达的影响Table 4. The expression of Nrf2 and HO-1 at mRNA and protein levels in the L-02 liver cells (Mean±SD. n=3)
**P<0.05vscontrol group;##P<0.05vsmodel group;△△P<0.05vs1∶1 group.
4 Western blot结果
与空白对照组相比,模型组TNF-α和IL-6 的蛋白表达均显著上调,Nrf2和HO-1 的蛋白表达均显著下调(P<0.01);与模型组相比,1∶1组、2∶1组、1∶2组TNF-α和IL-6的蛋白表达均显著下调,Nrf2和HO-1的蛋白表达均显著上调(P<0.01),其中1∶1组升高Nrf2蛋白效果最好(P<0.01);凯西莱组的HO-1蛋白与各治疗组间的差异无统计学显著性,见图2、3及表3、4。
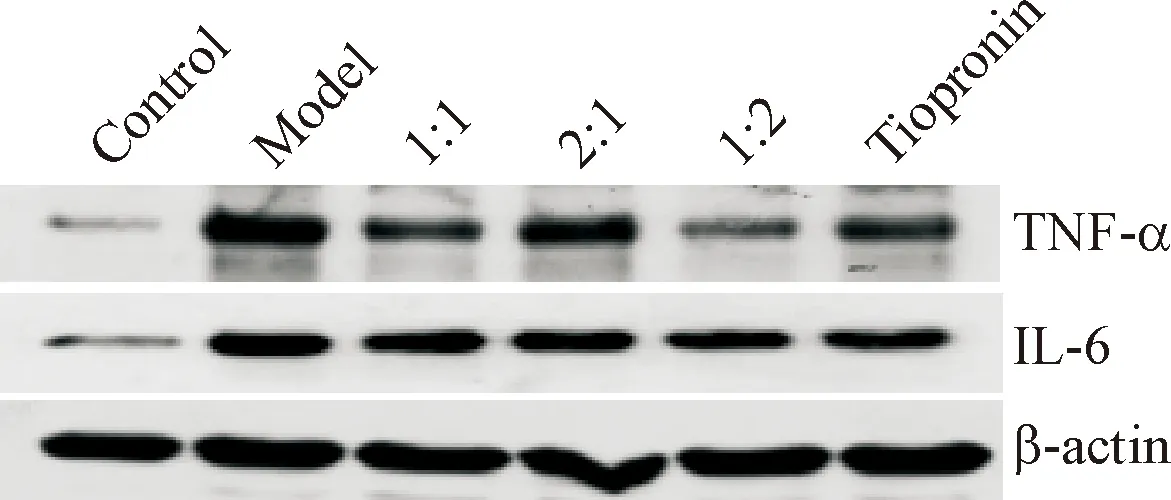
Figure 2. The effects of drug-containing serum on protein expression of TNF-α and IL-6 in the L-02 liver cells induced by ethanol.
图2含药血清对乙醇诱导损伤的L-02细胞中TNF-α和IL-6蛋白表达的影响

Figure 3. The effects of drug-containing serum on protein expression of Nrf2 and HO-1 in the L-02 liver cells induced by ethanol.
图3含药血清对乙醇诱导损伤的L-02细胞中Nrf2和HO-1蛋白表达的影响
讨 论
ALD是一种由于长期酒精摄入而引发的肝脏损伤疾病,伴随着高发病率和死亡率[12]。ALD的发病机理错综复杂,涉及炎症因子及肝脏脂质代谢的调节等多通路、多系统的复杂病理过程,但炎症反应和氧化应激正是 ALD发展和转归的主要环节[13]。目前被广为接受的是以氧化应激和脂质过氧化为中心的“二次打击”学说[14],该学说认为,氧化应激相关的脂质过氧化和炎症细胞因子的释放等形成“二次打击”,诱导肝脏产生炎症反应,最终导致肝细胞变性坏死及肝纤维化和肝硬化[15]。而近来有研究认为,长期摄入酒精使肝细胞发生氧化应激,其产物 4-HNE 作为一种肝细胞致敏因子,诱导酒精性肝损伤[16]。
大量研究表明,炎症介质在酒精性肝病的发病过程中起着重要的作用。主要参与的关键炎症因子为TNF-α和IL-6[3]。TNF-α和IL-6是促炎细胞因子,肝脏是其重要的靶器官,其参与体内的炎症、免疫反应过程[17]。当细胞受到氧化应激或者酒精刺激时,释放大量的细胞因子和炎症介质,如TNF-α、IL-6和IL-1β等。同时,氧化应激对细胞的刺激促使其产生大量的ROS[18],并启动体内调节氧化应激的关键靶点Nrf2信号转导途径。作为目前发现的细胞抗氧化应答的核心途径之一[19],其缺失或激活障碍,可加重氧化应激源的细胞毒性,导致细胞功能障碍、凋亡甚至死亡[20]。其调控的下游目标基因包括HO-1氧化还原平衡蛋白,具降低ROS水平[21]和抗炎的功能。Jung等[22]指出 HO-1 的上调阻止了酒精介导的肝损伤中炎性因子的过量形成而对肝细胞氧化应激损伤起到保护作用。Yeligar等[23]研究发现,诱导HO-1可导致TNF-α水平显著下降。还有研究表明,诱导HO-1的高表达后,发挥了直接的抗炎效应,使与ALI有关的TNF-α和IL-6促炎因子表达水平明显下降,从而缓解了LPS致小鼠的肺组织损害程度[24]。而IL-6是目前已知的可激活HO-1基因转录的细胞因子之一,因此我们可以大胆假设,是否通过调控HO-1导致TNF-α和IL-6炎症因子的上调和下调的表达,构成一个新的抗炎途径参了与酒精性肝病的过程。
本实验发现在酒精诱导的肝损伤细胞模型中,TNF-α、IL-6、ALT、AST和MDA的水平显著上调,而SOD、Nrf2和HO-1的水平显著下调;与模型组相比较,各干预组的TNF-α、IL-6、ALT、AST和MDA水平明显降低,SOD、Nrf2和HO-1的水平上升,各干预组之间的差异大部分无统计学显著性。以上结果表明,赶黄草配伍葛花与临床常用的凯西莱在减轻酒精损伤所致的炎症反应、氧化应激、肝功能异常等方面效果相当;凯西莱用于改善各类急慢性肝炎、酒精肝的肝功能,但有食欲不振、恶心、呕吐、腹痛、腹泻等消化系统症状,赶黄草配伍葛花与之相比,副作用少,疗效确切,其作用机制可能是通过减少炎症反应和氧化应激,下调TNF-α和IL-6 mRNA和蛋白表达水平,上调Nrf2和HO-1的表达水平,进而发挥保护肝脏的作用有关。
本方中的葛花为历来解酒专药,味甘平、微苦,性微寒,治头目眩晕、憎寒壮热,解酒醒脾胃、酒毒酒痢等[25]。赶黄草作为古蔺地区苗族人常用于肝病及醒酒的苗药,具有清热解毒和活血散瘀等功效[26]。根据酒精性肝病临床表现,古代医家将其归于“酒疸”、“酒癖”等范畴,长期无节制嗜酒为致病的主因。禀赋不足,脾胃失健,在此基础上,长期过量饮酒,酒毒湿热之邪作用于人体,导致肝脾功能失调是酒精性肝病发生发展的关键。湿热酒毒瘀滞于体内,日久则见肝络损伤,出现胁痛苔黄等湿热引起的症状,符合湿热瘀滞之病变及赶黄草和葛花的用药指征。因此,通过祛湿热解酒毒改善肝内炎症反应和氧化应激是治疗酒精性肝病的重要途径。二药合用体现了中药的相须原则,共奏解酒护肝的作用。本研究为临床应用赶黄草配伍葛花治疗酒精性肝病提供了新的理论依据。
[参 考 文 献]
[1] Orman ES, Odena G, Bataller R. Alcoholic liver disease: pathogenesis, management, and novel targets for therapy[J]. J Gastroenterol Hepatol, 2013, 28(Suppl 1):77-84.
[2] Dhanda AD, Lee RW, Collins PL, et al. Molecular targets in the treatment of alcoholic hepatitis[J]. World J Gastroenterol, 2012, 18(39):5504-5513.
[3] Wang HJ, Gao B, Zakhari S, et al. Inflammation in alcoholic liver disease[J]. Ann Rev Nutr, 2012, 32:343-368.
[4] Lin HZ, Yang SQ, Zeldin G, et al. Chronic ethanol consumption induces the production of tumor necrosis factor-α and related cytokines in liver and adipose tissue[J]. Alcohol Clin Exp Res, 1998, 22(5 Suppl):231-237.
[5] Zhou R, Lin J, Wu D. Sulforaphane induces Nrf2 and protects against CYP2E1-dependent binge alcohol-induced liver steatosis[J]. Biochim Biophys Acta, 2014, 1840(1):209-218.
[6] Qiu P, Dong Y, Li B, et al. Dihydromyricetin modulates p62 and autophagy crosstalk with the Keap-1/Nrf2 pathway to alleviate ethanol-induced hepatic injury[J]. Toxicol Lett, 2017, 274:31-41.
[7] Del Rio D, Stewart AJ, Pellegrini N. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress[J]. Nutr Metab Cardiovasc Dis, 2005, 15(4):316-328.
[8] Tomofuji T, Sanbe T, Ekuni D, et al. Oxidative damage of rat liver induced by ligature-induced periodontitis and chronic ethanol consumption[J]. Arch Oral Biol, 2008, 53(12):1113-1118.
[9] 郭美仙, 施贵荣, 陈俊雅, 等. 紫茉莉含药血清对乙醇诱导L-02肝细胞损伤的防治作用[J]. 中成药, 2015, 37(9):2035-2037.
[10] 唐 勇, 张 冲, 李国春, 等. 赶黄草乙醇提取物对大鼠酒精性脂肪肝的作用[J]. 中成药, 2016, 38(7):1601-1605.
[11] 雷红伟, 杨伟峰. 葛花对酒精性肝损伤保护作用的研究[J]. 时珍国医国药, 2010, 21(2):489-490.
[12] Saberi B, Dadabhai AS, Jang YY, et al. Current management of alcoholic hepatitis and future therapies[J]. J Clin Transl Hepatol, 2016, 4(2):113-122.
[13] Duleh S, Wang X, Komirenko A, et al. Activation of the Keap1/Nrf2 stress response pathway in autophagic vacuolar myopathies[J]. Acta Neuropathol Commun, 2016, 4(1):115-129.
[14] Savas MC, Koruk M, Pirim I, et al. Serum ubiquitin levels in patients with nonalcoholic steatohepatitis[J]. Hepatogastroenterology, 2003, 50(51):738-741.
[15] Day CP, James OF. Steatohepatitis: a tale of two “hits”?[J]. Gastroenterol, 1998, 114(4):842-845.
[16] 于晨辉, 杜仲燕, 高 佳, 等. 4-HNE通过抑制TNF-α介导的NF-κB活化诱导酒精性肝损伤[J]. 中国病理生理杂志, 2013, 29(6):1046-1052.
[17] Louvet A, Mathurin P. Alcoholic liver disease: mechanisms of injury and targeted treatment[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(4):231-242.
[18] Hu Y, Wang S, Wang A, et al. Antioxidant and hepatoprotective effect ofPenthorumchinensePursh extract againstt-BHP-induced liver damage in L02 cells[J]. Molecules, 2015, 20(4):6443-6453.
[19] 刘 欣. Nrf2蛋白精氨酸甲基化修饰及其在抗氧化过程中的作用和机制研究[D]. 长春: 东北师范大学, 2016.
[20] 林晓萍, 李 雯, 沈华浩. 抗氧化应激转录因子-Nrf2的研究进展[J]. 中国病理生理杂志, 2011, 27(6):1234-1239.
[21] Copple IM. The Keap1-Nrf2 cell defense pathway: a promising therapeutic target?[J]. Adv Pharmacol, 2012, 63:43-79.
[22] Jung KA, Kwak MK. The Nrf2 system as a potential target for the development of indirect antioxidants[J]. Molecules, 2010, 15(10):7266-7291.
[23] Yeligar SM, Machida K, Kalra VK. Ethanol-induced HO-1 and NQO1 are differentially regulated by HIF-1α and Nrf2 to attenuate inflammatory cytokine expression[J]. J Biol Chem, 2010, 285(46):35359-35373.
[24] 戴雨霖, 郑 飞, 黄 鑫, 等. 葛花人参配伍的解酒护肝机制[J]. 中国实验方剂学杂志, 2016, 22(4):45-49.
[25] 国家中医药管理局《中华本草》编委会. 中华本草[M]. 上海: 上海科学技术出版社, 1999:619.
[26] 肖丽萍, 宋洋洋, 周彦希, 等. 赶黄草抗非酒精性脂肪肝的实验研究[J]. 中国实验方剂学杂志, 2014, 20(10):125-129.
