miR-24对肺癌A549细胞化疗敏感性的影响
2018-07-02苏书娟孙义长任金山
苏书娟,樊 涛,孙义长,任金山
(南阳医学高等专科学校第一附属医院放疗科, 河南 南阳 473000)
肺癌是常见的恶性肿瘤,近年来,其发病率及死亡率不断攀升[1]。目前以铂类药物为基础的化疗在肺癌,特别是不宜手术的晚期肺癌的治疗中仍起着无可替代的作用,而临床治疗过程中肿瘤细胞对各类化疗药物产生的耐药现象大幅降低了药物的疗效,给肺癌的治疗带来了极大的阻力[1-3]。因此,探讨肺癌化疗耐药的有效评估指标,寻找潜在的治疗靶点成为改善患者预后和提高临床疗效的重要工作。
肿瘤细胞的多药耐药性多为获得性耐药,产生机制颇为复杂,且大多数涉及几种机制的联合作用[4]。研究显示,肿瘤细胞多药耐药的机制主要包括[4-8]肿瘤细胞中多药耐药相关蛋白(multidrug resistance-associated protein,MRP)等膜蛋白的高表达促进化疗药物的外排/减少化疗药物的摄入,进而导致细胞内药物浓度降低、化疗药物作用靶点的质与量出现改变、酶系统的异常表达致使肿瘤细胞的DNA损伤修复功能和细胞的解毒功能加强、激素受体的减少及抗凋亡基因的表达改变致使肿瘤细胞出现凋亡抑制等。
大量研究显示,微小RNA(microRNA, miR)的异常表达与肺癌的发生发展进程,包括获得耐药性的出现密不可分[9]。miR-24广泛表达于人体的多种组织中,可发挥调节细胞生长发育、增殖及凋亡等功能。有趣的是其在不同的细胞中对增殖及凋亡的调控作用不尽相同[10-13],如在肝癌[11]及舌鳞癌[12]中miR-24可靶向不同的基因促进癌细胞的生长,而Li等[13]的研究则表示miR-24-3p可靶向Prdx-6抑制胃癌细胞N87的生长、侵袭及迁移,促进其凋亡。因此,探讨miR-24对某个特定肿瘤细胞的作用及其作用机制对于相关肿瘤的个性化治疗具有重大的临床意义。早期的研究发现,miR-24在肺癌患者肿瘤组织及血清中呈现高表达,提示miR-24在肺癌中可能发挥癌基因样作用[14],但其与肺癌耐药之间的关系尚不清楚,故而本文通过转染miR-24抑制物序列(miR-24 inhibitor,miR-24-i)下调A549/DDP细胞中的miR-24表达,探究miR-24在肺腺癌细胞A549化疗获得性耐药中的作用及其相关作用机制。
材 料 和 方 法
1 材料与试剂
肺腺癌细胞株A549及肺腺癌耐药细胞株A549/DDP购买于中科院上海细胞库;胎牛血清(fetal bovine serum,FBS)、Opti-MEM培养基及RPMI-1640培养基均购自Gibco;miR-24 inhibitor(5’-CUGUUCCUGCUGAACUGAGCCA-3’)、阴性对照microRNA(miR-negative control,Neg; 5’-UUCUCCGAACGUGUCACGUTT-3’)、SYBR Green I real-time PCR Kit及野生型和突变型p53基因3’UTR-荧光素酶表达载体(WT-3’UTR和Mutant-3’UTR)均购自上海吉玛制药技术有限公司;P53 小分子干扰RNA(P53 siRNA)及其阴性对照RNA(control siRNA)均购自广州锐博生物科技有限公司;Lipofectamine 2000及相关转染试剂购自Invitrogen;CCK-8细胞活力分析试剂盒购自碧云天生物技术研究所;抗P53、Bcl-2、Bax、caspase-3、cleaved caspase-3、caspase-9、cleaved caspase-9、细胞色素C(cytochrome C,Cyt C)、磷酸化细胞外信号调节激酶(extracellular signal regulated kinase,p-ERK)、ERK及 β-actin 单克隆抗体购自Santa Cruz;细胞凋亡检测试剂盒购于南京凯基生物科技发展有限公司;顺铂(cisplatin,CDDP)购于齐鲁制药公司;紫杉醇(paclitaxel,PTX)购于海南海药股份有限公司;ERK特异性抑制剂U0126购于Cell Signaling;其余试剂均为国产市售分析纯。
2 方法
2.1细胞培养及转染 细胞常规培养于含10% FBS的RPMI-1640完全培养基中,其中A549/DDP细胞培养液中间断性加入1 mg/L的顺铂以维持其耐药性。培养箱设置为5% CO2、37 ℃、饱和湿度。首先取对数生长期的细胞接种于6孔板中,待细胞融合至60%~80%时进行转染。将miR-24 inhibitor(10 μmol/L)或等体积miR-negative control溶解于Opti-MEM培养基中,室温孵育5 min,标记为A液;另取Lipofectamine 2000溶解于Opti-MEM培养基中,室温孵育5 min,标记为B液;将A液和B液轻柔混合,室温反应25 min;而后将混合物加入相应组别的细胞中,置于细胞培养箱中孵育6 h后更换为完全培养基继续培养48 h。检测转染效率并进行后续实验分析。
2.2Real-time PCR检测miR-24及P53 mRNA的表达 转染后48 h,参照Trizol一步法操作手册抽提细胞总RNA并定量。取2 μg总RNA经逆转录反应合成cDNA(反应终体积为20 μL),采用SYBR Green real-time PCR试剂盒检测miR-24及P53 mRNA的表达。miR-24的正向引物的序列为5’-TGGCTCAGTTCAGCAGGAACAG-3’,反向引物的序列为5’-AACGCTTCACGAATTTGCGT-3’; U6作为内参照,正向引物的序列为5’-CTCGCTTCGGCAGCACA-3’;反向引物的序列为5’-AACGCTTCACGAATTTGCGT-3’。 P53的正向引物的序列为5’-GACCCAGGTCCAGATGAAGCT-3’,反向引物的序列为5’-ACCGTAGCTGCCCTGGTAGGT-3’;β-actin作为内参照,正向引物的序列为5’-ATCTACGAGGGGTATGCC-3’;反向引物的序列为5’-TAGCTCTTCTCCAGGGAG-3’。反应采用ABI7300 real-time PCR检测系统,先94 ℃孵育5 min变性,然后进行35个PCR循环(94 ℃ 30 s、55 ℃ 30 s、74 ℃ 30 s)。采用2-ΔΔCt法分析基因的相对表达量。
2.3细胞化疗药物体外敏感性的检测 取对数生长期的细胞接种于96孔板中(接种密度为每孔1×104),待细胞贴壁融合至80%~90%时同步化12 h,加入不同浓度的顺铂或紫杉醇(浓度梯度设置为0、0.01、0.1、1、10和100 μmol/L),置于培养箱中继续培养46 h,加入100 μL 的CCK-8试剂继续于培养箱中孵育2 h,采用酶标仪测定450 nm波长处的吸光度(A)值,计算相应药物的IC50并比较转染miR-24 inhibitor后A549/DDP细胞对顺铂敏感性的变化。每组设置3个复孔,取均值。
2.4细胞凋亡的检测 本实验采用Annexin V /PI双染色法检测细胞凋亡情况。细胞分组处理48 h,离心收集各组细胞后用PBS漂洗3次,加入Binding Buffer 重悬细胞。先后向细胞悬液中加入Annexin V-FITC(室温避光孵育10 min)和碘化丙啶(propidium iodide,PI)染液(室温避光染色5 min),采用流式细胞仪检测细胞凋亡情况,检测条件设置为:Ex=488 nm;Em=530 nm。
2.5Western blot检测蛋白表达水平 细胞分组处理48 h,采用RIPA裂解收集各组细胞蛋白并定量,调整各组蛋白上样量至80 μg,加入Loading Buffer(蛋白体积:loading buffer体积=1∶4),98 ℃水浴变性。准备好的蛋白样品上样后行SDS-PAGE,电泳结束后将蛋白电转至PVDF膜(200 mA恒流)。用5%脱脂牛奶室温封闭90 min,依据说明书要求加入相应比例的I 抗,4 ℃孵育过夜,复温后TBST洗涤3次,每次5 min;加入相应的 II 抗,置于摇床上室温孵育2 h,TBST洗涤3次,每次10 min。于暗室中将HRP-ECL发光液洒在PVDF膜的蛋白面上激发荧光,压X片、显影、定影并冲洗胶片。实验结果采用ImageJ灰度分析软件进行蛋白半定量分析。
2.6萤光素酶报告基因检测 从生物学信息数据库TargetScan挑选p53作为候选靶点。依据miR-24和P53 3’UTR可能的结合位点,由上海吉玛制药技术有限公司构建野生型(WT-3’UTR)及突变型(MUT-3’UTR)p53基因萤光素酶报告基因质粒,并将上述质粒和/或miR-24 inhibitor转入细胞中,通过检测萤光素酶的活性来验证p53是否是miRNA-24的作用靶点。转染方法同2.1。实验分组为:空载体(psi-CHEK2)组、野生型p53基因(WT-3’UTR)组和突变型p53基因(MUT-3’UTR)组。依据说明书使用萤光素酶报告基因检测仪检测萤光素酶的活性。实验结果以萤火虫萤光素酶活性与海肾萤光素酶活性的比值来进行统计学分析。
3 统计学处理
将本实验研究涉及数据录入SPSS 15.0标准版统计软件包行数据分析,实验结果以均数±标准差(mean±SD)表示。多组间数据的比较采用单因素方差分析,各组均数间的两两比较用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 miR-24的表达与A549细胞化疗耐药的关系
本实验首先检测了肺腺癌耐药细胞株A549/DDP及其对照亲本细胞株A549对2种化疗药物的IC50,结果证明A549/DDP细胞的化疗耐药性显著强于A549细胞(P<0.05),见表1。同时,real-time PCR的结果显示,A549/DDP细胞中miR-24的表达水平明显高于A549细胞(P<0.05),提示miR-24的表达可能与肺腺癌细胞A549化疗耐药之间存在相关关系,见图1A。
表1肺腺癌细胞A549对化疗药物的敏感性
Table 1. Drug sensitivity (IC50) of human lung adenocarcinoma A549 cells (μmol/L. Mean±SD.n=6)

CellsCDDPPTXA5491.58±0.390.19±0.05A549/DDP 14.17±1.94∗0.63±0.12∗
*P<0.05vsA549 group.

Figure 1. The expression of miR-24. A: the expression of miR-24 in the A549 cells and A549/DDP cells; B: the expression of miR-24 in the A549/DDP cells after transfected with miR-24 inhibitor. Mean±SD.n=6.#P<0.05vsA549 group;*P<0.05vscontrol group.
图1miR-24的表达情况
2 下调miR-24对A549/DDP细胞化疗敏感性的影响
A549/DDP细胞转染miR-24 inhibitor后,细胞中miR-24的表达较对照组明显降低(P<0.05),见图1B。化疗药物敏感性检测结果显示,下调A549/DDP细胞中miR-24的表达后,细胞对顺铂的敏感性明显增加,差异具有统计学意义(P<0.05),见表2。
表2下调miR-24可提高耐药细胞A549/DDP对化疗药物的敏感性
Table 2. Down-regulation of miR-24 increased drug sensitivity (IC50) of A549/DDP cells (μmol/L. Mean±SD.n=6).
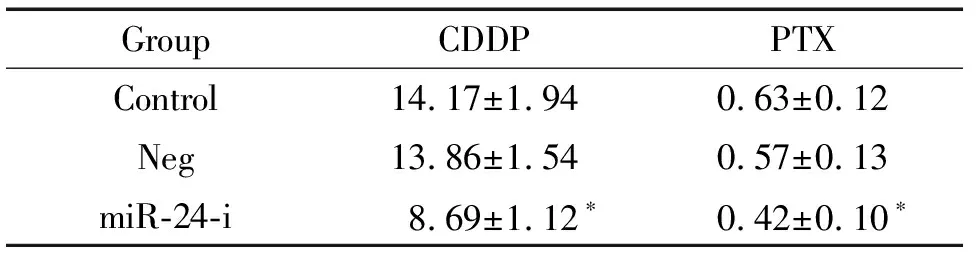
GroupCDDPPTXControl14.17±1.940.63±0.12Neg13.86±1.540.57±0.13miR-24-i8.69±1.12∗0.42±0.10∗
*P<0.05vscontrol group.
3 下调miR-24对A549/DDP细胞凋亡的影响
相较于Neg组细胞,miR-24 inhibitor组细胞的早期凋亡率显著增加(P<0.05);而中晚期细胞凋亡/坏死率变化无显著差异,表明下调miR-24可明显促进耐药细胞A549/DDP的凋亡,见图2。
4 下调miR-24对A549/DDP细胞线粒体途径凋亡相关蛋白表达的影响
Western blot实验的检测结果显示,与Neg组相比,miR-24 inhibitor组的抗凋亡蛋白Bcl-2的表达显著下降,而凋亡蛋白Bax、cleaved caspase-3和cleaved caspase-9的蛋白水平明显增加,Bcl-2/Bax比值显著降低(P<0.05)。此外,下调miR-24后可明显促进Cyt C释放至胞浆,提示线粒体凋亡信号通路被激活,见图3。
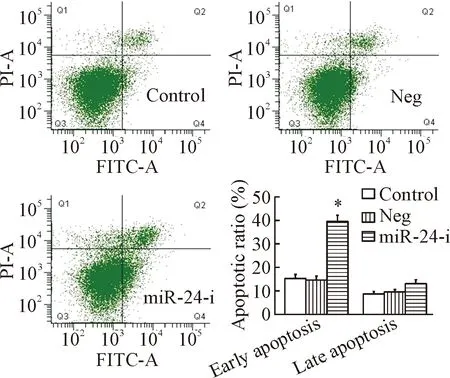
Figure 2. The effect of miR-24 down-regulation on the apoptosis of A549/DDP cells was analyzed by flow cytometry. Mean±SD.n=6.*P<0.05vsNeg group.
图2流式细胞术检测下调miR-24对A549/DDP细胞凋亡的影响
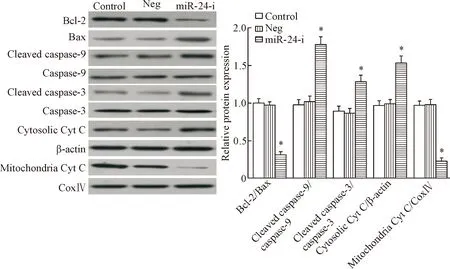
Figure 3. The effects of miR-24 down-regulation on the protein levels of mitochondrial apoptosis pathway related molecules in the A549/DDP cells. Mean±SD.n=6.*P<0.05vscontrol group.
图3下调miR-24对A549/DDP细胞线粒体凋亡信号通路相关分子蛋白水平的影响
5 下调miR-24对ERK/P53信号通路的影响
本实验进一步检测了细胞中调控凋亡的重要信号通路ERK信号通路的磷酸化情况,结果显示,与Neg组相比,miR-24 inhibitor组中p-ERK的蛋白水平显著增加(P<0.05),但是ERK总蛋白的水平并未出现显著变化;同时P53的表达水平显著升高(P<0.05),提示下调miR-24可活化ERK信号通路并提高肿瘤抑制因子P53的表达,见图4A。
此外,本实验还采用了ERK特异性抑制剂U0126来验证miR-24 inhibitor所致ERK信号通路的激活是否与A549/DDP细胞凋亡有关,结果显示预先给予25 μmol/L U0126处理1 h可部分恢复miR-24 inhibitor组的细胞活性,见图4B。

Figure 4. The effects of miR-24 down-regulation on the protein levels of p-ERK and P53 and cell viability in A549/DDP cells. A: the protein levels of p-ERK and P53 after transfected with miR-24 inhibitor in the A549/DDP cells; B: the effect of U0126 incubation on cell viability. Mean±SD.n=6.*P<0.05vsNeg group;△P<0.05vsmiR-24-i group.
图4下调miR-24对A549/DDP细胞ERK/P53信号通路相关分子蛋白水平和细胞活力的影响
6 miR-24靶基因的预测及验证
通过生物信息学的方法,挑选P53作为miR-24的候选靶点,miR-24与P53的结合位点如图5A所示。然后检测miR-24对P53表达的影响,结果显示,miR-24 inhibitor可明显促进P53 mRNA的表达,见图5B。双萤光素酶报告基因检测miR-24与P53的结合情况,结果显示在WT-3’UTR组转入miR-24 inhibitor,萤光素酶的活性较对照组降低(P<0.05);而MUT-3’UTR组转入miR-24 inhibitor,萤光素酶的活性没有显著改变,这一结果表明,miR-24可直接作用于p53基因的3’UTR区域来抑制其表达,见图5C。功能恢复实验显示,共转染miR-24 inhibitor和P53 siRNA之后,P53的表达显著下降,同时A549/DDP的细胞活力部分升高(P<0.05),见图5D、E。
讨 论
miR-24具有调控肿瘤细胞增殖及凋亡的作用,并通过不同的靶基因产生不同的作用。本研究发现,在肺腺癌耐药细胞株A549/DDP中miR-24的表达水平显著高于其亲本细胞株,而转染miR-24 inhibitor下调A549/DDP细胞中miR-24的表达可提高A549/DDP细胞对化疗药物的敏感性,由此推测,miR-24可参与影响肺腺癌A549细胞化疗耐药性的出现。
本实验进一步探讨了miR-24调控肺腺癌A549/DDP细胞化疗敏感性的作用机制。流式细胞术分析结果显示,下调miR-24可明显促进耐药细胞A549/DDP的凋亡,提示下调miR-24提高肺腺癌耐药细胞A549/DDP对化疗药物的敏感性可能与促进细胞的凋亡有关。线粒体途径是细胞的凋亡的重要途径之一,当某些内外源因素致使线粒体外膜通透性增加时,Cyt C从线粒体内膜释放进入胞质中,并与procaspase-9等结合形成凋亡小体,继而顺序激活caspase-9及caspase-3等最终导致细胞凋亡[15-17]。本实验的检测结果显示,下调miR-24可促进A549/DDP细胞中线粒体Cyt C的释放,激活caspase-9及caspase-3。Bcl-2家族是影响线粒体凋亡途径的重要调控因子[18],本实验中,下调miR-24可促进A549/DDP中促凋亡蛋白Bax的表达,抑制抗凋亡蛋白Bcl-2的表达,表明下调miR-24可通过激活线粒体凋亡途径促进A549/DDP细胞的凋亡。ERK信号通路是体内调控细胞分化、增殖和凋亡等过程的关键信号通路[19-20]。在较弱的刺激下,ERK信号通路的活化可促进肿瘤细胞的增殖及生长;但是ERK蛋白的持续激活,不仅可参与P53信号通路诱导细胞的凋亡及自噬,还可加重化疗药物如顺铂等的细胞损伤作用[21-22]。研究显示,在Ras/Raf/ERK信号通路持续激活时,肿瘤抑制因子P53的磷酸化水平升高,进而影响Bcl-2家族蛋白的表达,最终通过线粒体途径诱导细胞大量凋亡[23]。本实验的检测结果表明下调miR-24可活化ERK信号通路并提高肿瘤抑制因子P53的表达;且采用ERK特异性抑制剂U0126预孵A549/DDP细胞可部分恢复miR-24 inhibitor组的细胞活力,但是其中涉及的具体调控机制还需要进一步深入的研究。此外,生物信息学分析显示p53可能是miR-24的靶基因,两者的直接结合进而负调控P53的表达可能也是miR-24 inhibitor诱导细胞凋亡、增加化疗敏感性的一种分子机制。
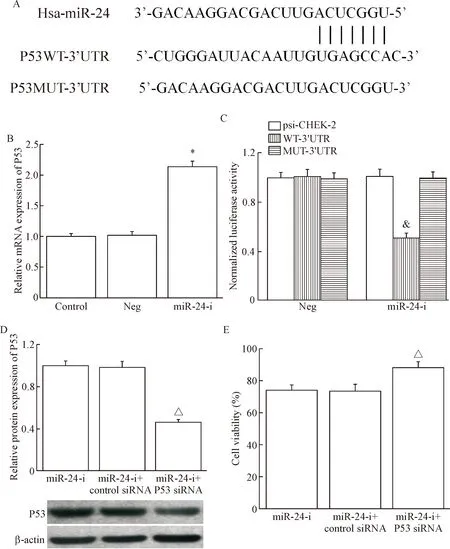
Figure 5.p53 was a potential target gene of miR-24. A: miR-24 seed sequence and its complementary binding site inp53 3’UTR; B: the effect of miR-24 inhibitor on P53 mRNA expression in A549/DDP cells; C: relative luciference intensity in transfected A549/DDP cells; D: the transfection efficiency of P53 siRNA; E: impact of P53 siRNA and miR-24 inhibitor co-transfection on A549/DDP cell viability. Mean±SD.n=6.*P<0.05vscontrol group;&P<0.05vspsi-CHECK2;△P<0.05vsmiR24-i group.
图5p53可能是miR-24的靶基因
综上所述,肺腺癌顺铂耐药细胞A549/DDP中下调miR-24可靶向P53同时激活ERK/P53信号通路,继而启动线粒体途径凋亡,增强细胞对化疗药物的敏感性。
[参 考 文 献]
[1] Chalela R, Curull V, Enríquez C, et al. Lung adenocarcinoma: from molecular basis to genome-guided therapy and immunotherapy[J]. J Thorac Dis, 2017, 9(7):2142-2158.
[2] Albaba H, Lim C, Leighl NB. Economic considerations in the use of novel targeted therapies for lung cancer: review of current literature[J]. Pharmacoeconomics, 2017, 35(12):1195-1209.
[3] Du L, Morgensztern D. Chemotherapy for advanced-stage non-Small cell lung cancer[J]. Cancer J, 2015, 21(5):366-370.
[4] Kim ES. Chemotherapy resistance in lung cancer[J]. Adv Exp Med Biol, 2016, 893:189-209.
[5] Piotrowska Z, Sequist LV. epidermal growth factor receptor-mutant lung cancer: new drugs, new resistancemechanisms, and future treatment options[J]. Cancer J, 2015, 21(5):371-377.
[6] Avril T, Vauléon E, Chevet E. Endoplasmic reticulum stress signaling and chemotherapy resistance in solid cancers[J].Oncogenesis, 2017, 6(8):e373.
[7] Singh MS, Tammam SN, Shetab Boushehri MA, et al. MDR in cancer: Addressing the underlying cellular alterations with the use of nanocarriers[J]. Pharmacol Res, 2017, 126:2-30.
[8] Galun D, Srdic-Rajic T, Bogdanovic A, et al. Targeted therapy and personalized medicine in hepatocellular carcinoma: drug resistance,mechanisms, and treatment strategies[J]. J Hepatocell Carcinoma, 2017, 4:93-103.
[9] Chen Y, Gao Y, Zhang K, et al. micrornas as regulators of cisplatin resistance in lung cancer[J]. Cell Physiol Biochem, 2015, 37(5):1869-1880.
[10] Yu G, Jia Z, Dou Z. miR-24-3p regulates bladder cancer cell proliferation, migration, invasion and autophagy by targeting DEDD[J]. Oncol Rep, 2017, 37(2):1123-1131.
[11] Chen L, Luo L, Chen W, et al. MicroRNA-24 increases hepatocellular carcinoma cell metastasis and invasion by targeting p53: miR-24 targeted p53[J]. Biomed Pharmacother, 2016, 84:1113-1118.
[12] Zhao J, Hu C, Chi J, et al. miR-24 promotes the proliferation, migration and invasion in human tongue squamous cell carcinoma by targeting FBXW7[J]. Oncol Rep, 2016, 36(2):1143-1149.
[13] Li Q, Wang N, Wei H, et al. mir-24-3p regulates progression of gastric mucosal lesions and suppresses proliferation and invasiveness of n87 via peroxiredoxin 6[J]. Dig Dis Sci, 2016, 61(12):3486-3497.
[14] Zhao G, Liu L, Zhao T, et al. Upregulation of miR-24 promotes cell proliferation by targeting NAIF1 in non-small cell lung cancer[J].Tumour Biol, 2015, 36(5):3693-3701.
[15] Nunnari J, Suomalainen A. Mitochondria: in sickness and in health[J]. Cell, 2012, 148(6):1145-1159.
[16] Kaczanowski S. Apoptosis: its origin, history, maintenance and the medical implications for cancer and aging[J]. Phys Biol, 2016, 13(3):031001.
[17] Chao CC, Hou SM, Huang CC, et al. Plumbagin induces apoptosis in human osteosarcoma through ROS generation, endoplasmic reticulum stress and mitochondrial apoptosis pathway[J]. Mol Med Rep, 2017,16(4):5480-5488.
[18] Du L, Fei Z, Song S, et al. Antitumor activity of Lobaplatin against esophageal squamous cell carcinoma through caspase-dependent apoptosis and increasing the Bax/Bcl-2 ratio[J]. Biomed Pharmacother, 2017, 95:447-452.
[19] Serini S, Calviello G. Modulation of Ras/ERK and phosphoinositide signaling by long-chain n-3 PUFA in breast cancer and their potential complementary role in combination with targeted drugs[J]. Nutrients, 2017, 9(3):E185.
[20] Sun Y, Liu WZ, Liu T, et al. Signaling pathway of MAPK/ERK in cell proliferation, differentiation, migration, senescence and apoptosis[J]. J Recept Signal Transduct Res, 2015, 35(6):600-604.
[21] Deschênes-Simard X, Kottakis F, Meloche S, et al. ERKs in cancer: friends or foes?[J]. Cancer Res, 2014, 74(2):412-419.
[22] Zou YR, Zhang J, Wang J, et al. Erythropoietin receptor activation protects the kidney from ischemia/reperfusion-induced apoptosis by activating ERK/p53 signal pathway[J]. Transplant Proc, 2016, 48(1):217-221.
[23] Cagnol S, Chambard JC. ERK and cell death: mechanisms of ERK-induced cell death--apoptosis, autophagy and senescence[J]. FEBS J, 2010, 277(1):2-21.
