黄淮麦区小麦品种和CIMMYT材料的矮秆基因型及其对株高和胚芽鞘的影响
2018-07-02许小宛李小东张传量崔紫霞孙道杰
冯 洁,许小宛,李小东,张传量,崔紫霞,冯 毅,孙道杰
(1.西北农林科技大学农学院,陕西杨凌 712100;2.汉中市汉台区农技中心,陕西汉中 723000)
高产抗逆始终是我国小麦遗传改良的重要目标。小麦矮秆基因可通过降低品种的株高增强群体的抗倒伏能力,以保障小麦产量。国外品种与我国小麦主栽品种有较大的亲缘差异,引进国外优良矮秆品种对拓宽我国小麦遗传基础具有重要意义。
在小麦遗传改良工作中,分子标记辅助选择与常规育种结合是小麦育种的主要发展方向。目前,有关矮秆基因的分子标记已得到鉴定和利用。Ellis等[1-2]开发了可以鉴定 Rht-B1b、 Rht-D1b和其等位基因 Rht-B1a、 Rht-D1a的STS标记; Rht-B1b、 Rht-D1b来自农林10号,对赤霉素不敏感[3-5]。Korzun等[6]发现,SSR分子标记 Xgwm261可以有效地鉴定 Rht8基因, Rht8来源于赤小麦,对赤霉素敏感。许多学者对我国小麦主要矮秆基因进行了研究。唐 娜等[7]利用主要矮秆分子标记分析了我国主要麦区小麦品种中 Rht-B1b、 Rht-D1b和 Rht8的分布;张德强等[8]分析了 Rht-B1b、 Rht-D1b和 Rht8在我国黄淮麦区的分布及其对主要农艺性状的影响。小麦苗期对外源赤霉素的敏感性可以作为小麦品种的生化标记,但需要与相应的矮秆分子标记结合[9]。周 阳等[10]利用分子标记和系谱分析结合赤霉素反应鉴定了我国主栽小麦品种 Rht8的基因分布。胚芽鞘长度是小麦抗旱性评价的一个重要指标[11]。唐 娜等[12]研究发现,矮秆基因 Rht-B1b和 Rht-D1b会降低小麦胚芽鞘长度,对旱地小麦遗传改良不利。CIMMYT小麦具有广适性,丰产性和抗病性好,引进CIMMYT优异的小麦材料,可以拓宽我国小麦品种的遗传基础。已有学者对CIMMYT小麦品种的产量、品质、抗病性等性状进行了深入研究[13-15],但对CIMMYT材料矮秆基因的鉴定及其对株高和胚芽鞘长度的影响未见报道。
本研究以131份黄淮麦区主栽小麦品种和31份CIMMYT小麦材料为研究对象,利用主要矮秆基因分子标记[16],对供试材料进行矮秆基因检测,分析不同矮秆基因组合的降秆作用及对胚芽鞘长度的影响,以期筛选出优良的矮秆基因资源,为合理利用小麦资源提供参考依据。
1 材料与方法
1.1 试验材料
131份黄淮麦区小麦品种,其中,河北15份,陕西29份,山东33份,河南54份。31份CIMMYT小麦材料,其中,6份是小黑麦(CM12、CM13、CM51、CM52、CM53、CM54),以中国春为对照。
1.2 试验方法
1.2.1 田间试验
供试材料于2015-2016年种植于西北农林科技大学试验点,每个试验材料种植2行,行长2.0 m,株距6.67 cm,行距20 cm。在小麦成熟期,每个试验材料随机选择10株测定主茎高度。
1.2.2 赤霉素反应和胚芽鞘长度测定
每个试验材料取20粒种子,分别播入铺有滤纸的、两个直径约10 cm的培养皿中,其中一个培养皿浇适量5 mg·L-1的赤霉素(GA3),另一个培养皿浇同样量的蒸馏水作为对照。24 ℃室温下发芽,7~10 d后根据GA3处理与对照间的幼苗高度差异,确定品种对GA3的反应类型,重复2次。胚芽鞘长度的测定方法参照昝 凯等[9]的方法进行。
1.2.3 主要矮秆基因检测
在小麦苗期,采用CTAB法提取小麦叶片DNA,并将DNA样品稀释至50 ng·μL-1用于后续分析。 Rht-B1a、 Rht-B1b、 Rht-D1a、 Rht-D1b和 Rht8基因采用Ellis等[1]和Korzun[6]设计的引物序列,并参考张德强等[8]的方法,在正向引物5′端均加上M13 for 引物序列(5′-CACGAC GTTGTAAAACGAC-3′),PCR扩增程序参照相应的文献。
1.3 数据处理
采用SPSS 22.0进行差异显著性分析。
2 结果与分析
2.1 供试材料矮秆基因的分布
根据所含矮秆基因对162份供试材料进行分组,结果(表1)发现,17份材料只含有矮秆基因 Rht-B1b(图1),代表材料有石新828、小偃22、鲁麦23、CM27等;20份材料只含有矮秆基因 Rht-D1b(图2),代表材料有烟农18、陕94、周麦18、CM27等;23份材料只含有矮秆基因 Rht8(图3),代表材料有小偃6号、西农1376、石家庄8号、CM13等。中国春也扩增出了 Rht8基因。同时携带 Rht-B1b和 Rht8、 Rht-D1b和 Rht8的材料均有40份。同时携带以上3种矮秆基因的小麦材料有2份,且均是CIMMYT小麦。有16份材料没有检测到矮秆基因。总体来说,黄淮麦区小麦品种大多数含有矮秆基因 Rht-D1b,CIMMYT小麦材料中大多数含有矮秆基因 Rht-B1b。
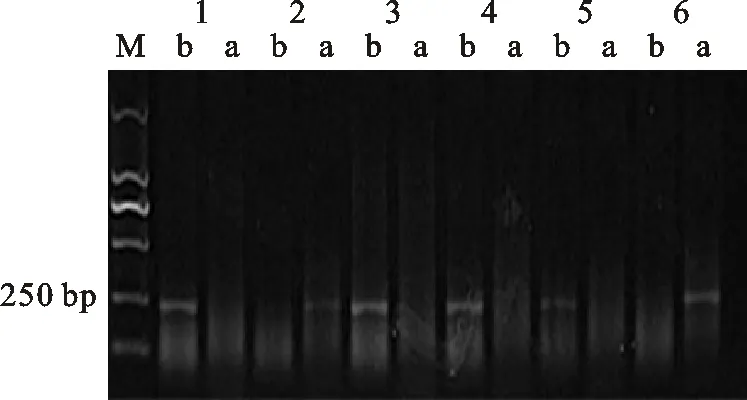
M:DL2000; 1:小偃6号; 2:中国春; 3:CM12; 4:CM27; 5:小偃22; 6:CM51; a: Rht-B1a基因的扩增条带; b: Rht-B1b基因的扩增条带
M:DL2000; 1:Xiaoyan 6; 2:Chinese Spring; 3:CM12; 4:CM27; 5:Xiaoyan 22; 6:CM51; a:Band of Rht-B1a; b:Band of Rht-B1b
图1矮秆基因Rht-B1b的检测
Fig.1DetectionofdwarfinggeneRht-B1b
2.2 供试材料对赤霉素的敏感性
供试材料的赤霉素敏感性结果(表2)表明,110份小麦材料对赤霉素不敏感,占供试材料的67.91%,其中,CIMMYT小麦有19份。52份小麦材料对赤霉素敏感,占供试材料的32.09%。综合分析赤霉素敏感性与小麦矮秆基因携带状况发现,含有矮秆基因 Rht8且对赤霉素敏感的小麦材料占被测材料的19.13%,含有矮秆基因 Rht-B1b和 Rht-D1b且对赤霉素反应不敏感的小麦材料占比分别为33.95%和37.04%。由此可见,绝大多数含有矮秆基因 Rht-B1b和 Rht-D1b的小麦材料对赤霉素不敏感,含有矮秆基因 Rht8的小麦材料对赤霉素敏感;同时含有 Rht-B1b和 Rht8或 Rht-D1b和 Rht8时,多数材料对赤霉素不敏感,个别材料表现对赤霉素敏感,推测其含有其他对赤霉素敏感的矮秆基因。
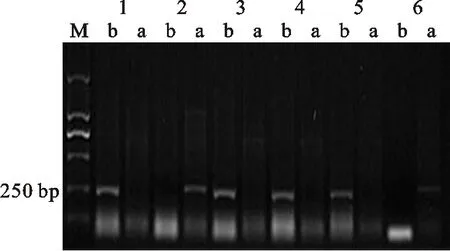
M:DL2000; 1:周麦8425B; 2:中国春; 3:CM27; 4:周麦18; 5:CM4; 6:CM51; a: Rht-D1a基因的扩增条带; b: Rht-D1b基因的扩增条带
M:DL2000; 1:Zhoumai 8425B; 2:Chinese Spring; 3:CM27; 4:Zhoumai 18; 5:CM4; 6:CM51; a:Band of Rht-D1a; b:Band of Rht-D1b
图2矮秆基因Rht-D1b的检测
Fig.2DetectionofdwarfinggeneRht-D1b

M:DL500; 1:小偃6号; 2:中国春; 3:CM13; 4:CM53; 5:CM4; 6:中麦895; 7:CM27; 8:西农979; 9:CM14; 10:CM20。
M:DL500; 1:Xiaoyan 6; 2:Chinese Spring; 3:CM13; 4:CM53; 5:CM4; 6:Zhongmai 895; 7:CM27; 8:Xinong 979; 9:CM14; 10:CM20.
图3矮秆基因Rht8的检测
Fig.3DetectionofdwarfinggeneRht8
2.3 矮秆基因组合及其降秆作用
由表3可知,不同矮秆基因组合对小麦的降秆作用不同,其中,不含所检测矮秆基因的小麦株高显著高于含矮秆基因组合, Rht-D1b和 Rht8的降秆效应较大, Rht-B1b和 Rht-D1b的降秆效应分别是14.69%和17.74%,两者间差异不显著。同时携带矮秆基因 Rht-B1b和 Rht8、 Rht-D1b和 Rht8的小麦材料降秆效应分别是14.80%和21.33%。各基因组合的降秆效应表现为 Rht-D1b+ Rht8> Rht-D1b> Rht-B1b+ Rht8> Rht-B1b> Rht8。由此可见,对赤霉素不敏感的矮秆基因 Rht-B1b和 Rht-D1b降秆效应大于对赤霉素敏感的矮秆基因 Rht8。此外,本研究中,同时含有矮秆基因 Rht-B1b和 Rht-D1b的降秆效应并不明显,其原因可能是供试小麦材料本身株高不是很高。

表1 供试材料中矮秆基因 Rht-B1b、 Rht-D1b和 Rht8的分布Table 1 Materials of dwarfing genes Rht-B1b, Rht-D1b and Rht8 in different regions

表2 供试材料对赤霉素敏感性Table 2 Result of response to GA3 in the tested materials
2.4 矮秆基因组合对胚芽鞘长度的影响
由表3可知,同时含有矮秆基因 Rht-B1b和 Rht-D1b的材料胚芽鞘长度最短,显著低于其他组合,胚芽鞘长度的缩短效应为26.20%。 Rht-B1b)和 Rht-D1b缩短胚芽鞘长度的效应分别是9.27%和10.86%,两者之间没有显著差异。被测矮秆基因缩短胚芽鞘长度的效应表现为 Rht-B1b+ Rht-D1b> Rht-B1b+ Rht-D1b+ Rht8> Rht-D1b> Rht-D1b+ Rht8> Rht-B1b> Rht-B1b+ Rht8> Rht8。由此可见,对赤霉素不敏感的矮秆基因 Rht-B1b和 Rht-D1b对供试小麦材料缩短胚芽鞘长度的效应较强,而对赤霉素敏感的矮秆基因 Rht8对小麦胚芽鞘长度没有显著影响。

表3 不同矮秆基因组合对小麦株高和胚芽鞘的影响Table 3 Effect of dwarfing genes on plant height and coleoptile length of wheat
同列数据后不同字母表示不同基因型在0.05水平差异显著。
Different letters following data in same column mean significant difference among different dwarfing gene groups at 0.05 level.
3 讨 论
在小麦遗传改良中,主要矮秆基因的应用在小麦矮化育种中起着重要作用,株高的降低提高了小麦的抗倒性和收获指数。然而,在小麦育种实践中,核心骨干亲本的反复利用增加了新育成品系的遗传相似性,造成遗传基础狭窄,育成突破性品种难度增大[17],因此,有必要从国内外引进优异种质材料,拓宽遗传基础。CIMMYT小麦品种在株高上与我国冬、春麦区的品种相当[18],因此,了解CIMMYT小麦材料的株高及所含主要矮秆基因类型有助于我国小麦品种株高的遗传改良。本试验中,31份CIMMYT小麦材料含 Rht-B1b基因的频率较高,与梁 丹等[19]的研究结果一致。 Rht-B1b+ Rht-D1b+ Rht8的降秆作用大于 Rht-B1b+ Rht-D1b,与许 琦等[16]的研究结论一致, Rht-B1b+ Rht8降秆作用大于 Rht-D1b+ Rht8,可能与其载体小黑麦株高较高,使其组合中平均株高略高,从而导致降秆作用较小。在CIMMYT材料中,一些材料具有良好的株型(叶片窄小上挺),耗时的春化需求减少,具有光周期不敏感性,如CM4、CM5、CM9等[13],这些材料与国内的主推品种进行组配有助于拓宽国内小麦品种的遗传基础,培育具有广适性的小麦育种中间材料。
小黑麦是向小麦转移黑麦优异基因的桥梁,也是粮饲两用作物,在小麦育种和生产中起重要作用。小麦与黑麦的易位系、代换系中具有许多优良特性,如抗白粉病、锈病,适应性广等[20-21]。六倍体小黑麦具有穗大、小穗数多、抗逆性、适应性强、抗病性强,尤其是对白粉病近乎免疫和赖氨酸含量高等优点,是创制优异小麦材料的优质亲本。本试验中,6个CIMMYT小黑麦品系具有高抗条锈病和白粉病、且具备较好的产量性状,但在CM51、CM52和CM54中没有检测到矮秆基因,通过与黄淮麦区小麦品种的株高比较,这些小黑麦株高较高,但其他农艺性状较好,可以将其与主推品种进行组合,选育抗逆、广适性的品系。
胚芽鞘长度是小麦抗旱性的一个重要评价指标。矮秆基因 Rht-B1b和 Rht-D1b在降低小麦株高的同时也引起胚芽鞘长度的缩短[22],不利于小麦品种抵御干旱胁迫,而赤霉素敏感基因 Rht8能够在降低小麦品种株高的同时不影响胚芽鞘长度,是旱地小麦育种理想的矮秆基因类型。162份供试材料中,有42份只携带矮秆基因 Rht8的材料降低株高的效应为12.02%,但缩短胚芽鞘长度的效应为0,说明这些小麦材料有改良旱地矮秆小麦品种的潜力。其中,CM5仅含有矮秆基因 Rht8,耐热耐旱,株高较中国春降低20%以上,胚芽鞘长度较中国春增加20%以上。CM7虽然不含所检测的3个矮秆基因,但是株高适中,胚芽鞘较长,且抗Ug99,可以适时地加以利用。C3品种广适性好,CM4早熟且配合力好,CM9株型好、高产、耐热耐旱且抗Ug99,人工合成的CM27品种熟相好且抗赤霉病,均同时携带 Rht-B1b和 Rht-D1b矮秆基因,其降秆作用明显,考虑到其对胚芽鞘长度的影响,可通过遗传改良以后作为组配亲本,用于育种实践。
参考文献:
[1] ELLIS M H,SPIELMEYER W,GALE K R,etal.“Perfect” markers for the Rht-B1b and Rht-D1b dwarfing genes in wheat [J].TheoreticalandAppliedGenetics,2002,105(6-7):1039.
[2] ELLIS M H,GEBETZKE G,AZANZA F,etal.Molecular mapping of gibberellin-responsive dwarfing genes in bread wheat [J].TheoreticalandAppliedGenetics,2005,111(3):423.
[3] GALE M D,LAW C N,MARSHALL G A,etal.The genetic control of gibberellic acid insensitivity and coleoptile length in a dwarf wheat [J].Heredity,1975,34(3):395.
[4] 赵 和.小麦矮秆基因研究和利用现状[J].河北农业科学,2004,8(4):96.
ZHAO H.Advances in researches and applications of wheatRhtgenes [J].JournalofHebeiAgriculturalSciences,2008,8(4):96.
[5] 杨松杰,王岩军,李 俊,等.人工合成小麦与普通小麦杂交后代衍生群体的 Rht8基因分析[J].中国农学通报,2007,23(2):50.
YANG S J,WANG Y J,LI J,etal.Genetic performance of dwarfing gene Rht8 in synthetic hexaploid wheat-derived populations [J].ChineseAgriculturalScienceBulletin,2007,23(2):50.
[6] KORZUN V,RÖDER M S,GANAL M W,etal.Genetic analysis of the dwarfing gene( Rht8) in wheat.Part I.Molecular mapping of Rht8 on the short arm of chromosome 2D of bread wheat(TriticumaestivumL.) [J].TheoreticalandAppliedGenetics,1998,96(8):1106-1108.
[7] 唐 娜,李 博,闵 红,等.分子标记检测矮秆基因 Rht-B1b、 Rht-D1b和 Rht8在我国小麦中的分布[J].中国农业大学学报,2012,17(4):24.
TANG N,LI B,MIN H,etal.Distribution of dwarfing genes Rht-B1b, Rht-D1b and Rht8 in Chinese bread wheat cultivars detected by molecular markers [J].JournalofChinaAgriculturalUniversity,2012,17(4):24.
[8] 张德强,宋晓朋,冯 洁,等.黄淮麦区小麦品种矮秆基因 Rht-B1b、 Rht-D1b和 Rht8的检测及其对农艺性状的影响[J].麦类作物学报,2016,36(8):977.
ZHANG D Q,SONGX P,FENG J,etal.Detection of dwarf genes Rht-B1b, Rht-D1b and Rht8 in Huang-Huai valley winter wheat areas and their influences on agronomic characteristics [J].JournalofTriticeaeCrops,2016,36(8):977.
[9] 昝 凯,李春游,敬 樊,等.部分印度小麦品种矮秆基因的检测及其对部分性状的影响[J].麦类作物学报,2015,35(7):911.
ZAN K,LI C Y,JING F,etal.Detection of dwarfing genes in some India wheat cultivars and their influences on partial agronomic characteristics [J].JournalofTriticeaeCrops,2015,35(7):911.
[10] 周 阳,何中虎,张改生,等.用微卫星标记鉴定中国小麦品种中 Rht8矮秆基因的分布[J].作物学报,2003,29(6):814.
ZHOU Y,HE Z H,ZHANG G S,etal. Rht8 dwarf gene distribution in Chinese wheats identified by microsatellite marker [J].ActaAgronomicaSinica,2003,29(6):814.
[11] REBETZKE G J,RICHARDS R A,FETTELL N A,etal.Genotypic increases in coleoptile length improves stand establishment,vigour and grain yield of deep-sown wheat [J].FieldCropsResearch,2007,100(1):11.
[12] 唐 娜,姜 莹,何蓓如,等.赤霉素敏感性不同矮秆基因对小麦胚芽鞘长度和株高的效应[J].中国农业科学,2009,42(11):3783.
TANG N,JIANG Y,HE B R,etal.Effects of dwarfing genes of Rht-B1b, Rht-D1b and Rht8 with different response to GA3on coleoptile length and plant height of wheat [J].ScientiaAgriculturaSinica,2009,42(11):3783.
[13] 孙道杰,王 辉,郝元峰.摈弃“累赘”,保障生长发育的顺畅高效—未来小麦改良模式探讨[J].麦类作物学报,2016,36(3):265.
SUN D J,WANGH,HAOY F.Eliminating redundancy for a better growth and development in common wheat—Discussion on the mode of wheat improvement for future [J].JournalofTriticeaeCrops,2016,36(3):265.
[14] 朱传杰,安旭尧,连俊芳,等.利用CIMMYT资源创制小麦抗病及农艺新种质的研究[J].麦类作物学报,2015,35(3):322.
ZHU C J,AN X Y,LIAN J F,etal.Study on creating new wheat germplasm with disease resistance and good agronomic traits by using CIMMYT resources [J].JournalofTriticeaeCrops,2015,35(3):322.
[15] GBEGBELEGBE S,CAMMARANO D,ASSENG S,etal.Baseline simulation for global wheat production with CIMMYT mega-environment specific cultivars [J].FieldCropsResearch,2017,202:123.
[16] 许 琦,杨 娜,柴永峰,等.中国小麦主要矮秆基因的分布及其对株高的影响[J].西北农业学报,2014,23(5):60.
XU Q,YANG N,CHAI Y F,etal.Distribution and impact on plant height of major wheat dwarfing genes in China [J].ActaAgriculturaeBoreali-occidentalisSinica,2014,23(5):60.
[17] 曹廷杰,谢菁忠,吴秋红,等.河南省近年审定小麦品种基于系谱和SNP标记的遗传多样性分析[J].作物学报,2015,41(2):198.
CAO T J,XIE J Z,WU Q H,etal.Genetic diversity of registered wheat varieties in Henan Province based on pedigree and single-nucleotide polymorphism [J].ActaAgronomicaSinica,2015,41(2):198.
[18] 杨芳萍,夏先春,张 勇,等.春化、光周期和矮秆基因在不同国家小麦品种中的分布及其效应[J].作物学报,2012,38(7):1163.
YANG F P,XIA X C,ZHANG Y,etal.Distribution of allelic variation for vernalization,photoperiod,and dwarfing genes and their effects on growth period and plant height among cultivars from major wheat producing countries [J].ActaAgronomicaSinica,2012,38(7):1163.
[19] 梁 丹,杨芳萍,何中虎,等.利用STS标记检测CIMMYT小麦品种(系)中 Lr34/Yr18、 Rht-B1b和 Rht-D1b基因的分布[J].中国农业科学,2009,42(1):26.
LIANGD,YANG F P,HE Z H,etal.Characterization of Lr34/Yr18, Rht-B1b, Rht-D1b genes in CIMMYT wheat cultivars and advanced lines using STS markers [J].ScientiaAgriculturaSinica,2009,42(1):26.
[20] FRIEBE B,HATCHETT J H,SEARS R G,etal.Transfer of Hessian fly resistance from ‘Chaupon’ rye to hexaploid wheat via a 2BS/2RL wheat-rye chromosome translocation [J].TheoreticalandAppliedGenetics,1990,79(3):385.
[21] KIM W,JOHNSON J W,GRAYBOSCH R A,etal.The effect of T1DL·1RS wheat-rye chromosomal translocation on agronomic performance and end-use quality of soft wheat [J].CerealResearchCommunications,2003,31:301.
[22] ELLIS M H,REBETZKE G J,CHANDLER P,etal.The effect of different height reducing genes on the early growth of wheat [J].FunctionalPlantBiology,2004,31(6):588.
