1个新的小麦矮秆突变体的遗传效应
2019-04-16潘文秋乔朋放侯炳旭张浩彬郝佳敏陈晓杰胡银岗
潘文秋,乔朋放,侯炳旭,张浩彬,游 银,郝佳敏,陈晓杰,胡银岗,3,陈 亮,3
(1.西北农林科技大学 农学院,陕西杨凌 712100;2.河南省科学院 同位素研究所有限责任公司/河南省核农学重点实验室,郑州 450015;3.旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
株高是影响小麦产量的重要因素,矮秆基因的利用,为小麦单产的不断提升做出巨大贡献。目前,已推广的小麦品种中应用的矮秆基因主要是Rht-B1b、Rht-D1b和Rht8,存在矮源单一化问题,加强研究和改良现有矮源,寻找和发掘新矮源,对小麦高产育种具有重要意义[1]。20世纪60年代,小麦矮秆基因Rht-B1b和Rht-D1b的应用引发农业生产的“绿色革命”[2],揭开小麦、水稻等作物的矮化育种序幕,同时也为育种家提供新的育种思路。小麦作为中国主要粮食作物,在其生产中引入矮秆基因,可显著提高小麦的抗倒伏性和收获指数,同时其耐高肥水能力也有明显提高,使小麦的产量大幅度增加[3]。目前,已经报道并命名的主效矮秆基因有25 个[4],但生产上推广的主要小麦品种,携带Rht-B1b或Rht-D1b基因的至少占70%[5]。杨芳萍等[6]对来自14 个国家的100 份代表性小麦品种的矮秆基因分析表明,Rht-B1b和Rht-D1b基因的分布频率分别为43.0%和35.0%。许琦等[7]对中国冬麦区210个小麦品种的矮秆基因分析表明,携带Rht-B1b、Rht-D1b和Rht8基因的品种比例分别为24.3%、19.0%和44.8%。张德强等[8]对黄淮麦区20世纪及近年来新育成的129份小麦品种所含矮秆基因分析表明,含Rht-B1b、Rht-D1b和Rht8基因的比例分别为28.7%、56.6%和69.0%,仅有4.7%的品种不含有上述3 种基因。孙树贵等[9]对美国的67份小麦品种以及唐娜等[10]对中国主麦区小麦品种的检测结果也表明小麦矮秆基因应用较为单一。因此,小麦矮秆基因在生产中的应用单一化,使遗传背景较为狭窄,导致育成品种的遗传多样性降低,可能会成为小麦产量继续提升的瓶颈,不利于小麦生产的可持续发展[11]。因此,要提高小麦产量,实现矮化、抗倒伏育种的新突破,就必须要发现或创造新的矮源,并进一步加强对已知矮秆基因的研究及利用[12]。本研究以小麦品种‘邯6172’和‘邯6172’矮秆突变体为材料,对株高、分蘖数、小穗数、穗粒数、千粒质量、产量等相关农艺性状进行测定,以明确‘邯6172’矮秆突变体的矮化效应。同时,对‘邯6172’和‘邯6172’矮秆突变体进行小麦35 K SNP芯片筛查,分析其突变位点及效应。以期为‘邯6172’矮秆突变体的育种应用及致矮机制解析提供参考。
1 材料与方法
1.1 试验材料
以小麦品种‘邯6172’和‘邯6172’矮秆突变体(“实践八号”太空搭载选育,由河南省科学院同位素研究所提供)为试验材料。田间试验在陕西杨凌西北农林科技大学旱区节水农业研究院试验农场进行。
1.2 赤霉酸(GA3)反应
参照唐娜等[13]的测定方法,‘邯6172’和‘邯6172’矮秆突变体各取 40 粒大小一致的种子,分别播入 2 个铺有滤纸直径 10 cm的培养皿中(各 20 粒),其中一个培养皿浇 5 mg/L的外源GA3溶液,另一个培养皿浇相同数量的蒸馏水作为对照。保持湿润,在 24 ℃ 室温下暗室培养,待第 1 叶完全展开时,用直尺测量各品系的胚芽鞘及第 1 叶长度(精确到 1 mm),取平均值并进行方差分析,以确定‘邯6172’矮秆突变体对外源GA3的反应类型。
1.3 ‘邯6172’矮秆突变体的主要农艺性状鉴定
2016年10月和2017年10月,将小麦品种邯‘6172’和‘邯6172’矮秆突变体的种子按行距 20 cm 、株距 6 cm 播种,生育期间进行田间主要农艺性状的观察与统计,成熟后按单株收获,并进行差异显著性分析。根据小麦生长发育进程,在灌浆后期测量各单株的株高、茎节长度、分蘖数、小穗数和穗粒数等主要农艺性状;在收获后,测定单株产量、千粒质量、生物量和收获指数。
1.4 SNP芯片分析
利用小麦 35 K SNP芯片(Axioma Wheat Breeder Genotyping Array)对‘邯6172’和‘邯6172’矮秆突变体进行差异SNP分析,以分析突变频率及突变位点,并为后续初步定位矮秆相关基因或其他优异基因提供参考。
2 结果与分析
2.1 ‘邯6172’矮秆突变体的赤霉酸(GA3)反应
用外源GA3分别对小麦品种‘邯6172’和‘邯6172’矮秆突变体进行外源GA3反应鉴定。结果表明(表1):外源GA3处理后,‘邯6172’及‘邯6172’矮秆突变体的胚芽鞘长度和第1叶长度均有增加,但都未达到显著水平;不施加外源GA3时,‘邯6172’矮秆突变体的胚芽鞘长度较‘邯6172’缩短11.4%,外源GA3处理后,‘邯6172’矮秆突变体的胚芽鞘长度较‘邯6172’没有显著差异;不施加外源GA3时,‘邯6172’矮秆突变体的第 1 叶长较‘邯6172’缩短24.0%,外源GA3处理后,第 1 叶长较‘邯6172’缩短20.0%。虽然‘邯6172’矮秆突变体对外源GA3敏感性不显著,但GA3处理不同程度地恢复‘邯6172’矮秆突变体的野生型表型,与‘邯6172’的差异缩小。‘邯6172’矮秆突变体对外源GA3敏感性较弱,应为GA3迟钝型矮化类型,其矮化可能不是由内源GA3合成代谢缺陷导致的。同时,在不施加外源GA3时,‘邯6172’突变体的胚芽鞘长度和第 1 叶长度均较‘邯6172’显著缩短,可能会影响‘邯6172’突变体的苗期活力。
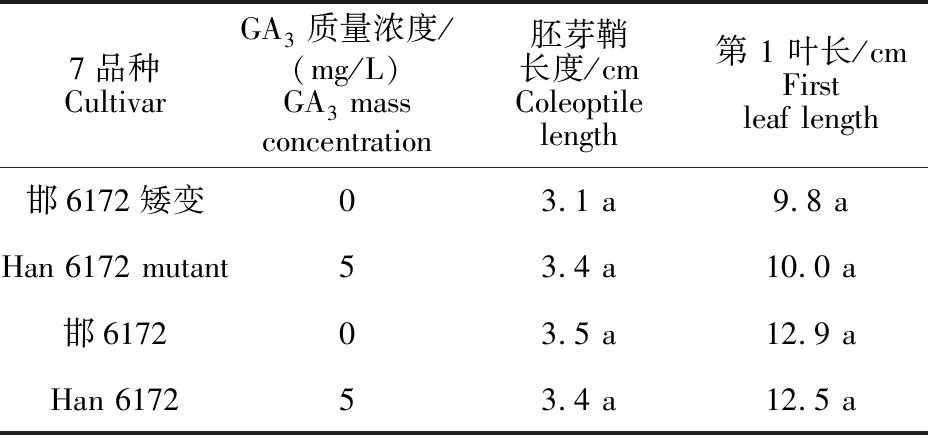
表1 GA3对‘邯6172’矮秆突变体及‘邯6172’胚芽鞘及第1叶长度的效应Table 1 Effect of gibberellic acid treatment on length coleoptile and first leaf of wheat lines‘Han 6172’ and ‘Han 6172 mutant’
注:不同小写字母表示差异显著(P<0.05)。下同。
Note:Different lowercase letters within columns indicate statistically significant differences(P<0.05).The same below.
2.2 矮化效应对株高及相关性状的影响
田间试验结果发现:‘邯6172’矮秆突变体的株高较‘邯6172’显著降低,2 a 试验株高分别降低 12.3 cm(15.3%)和12.5 cm(14.6%),但矮化效应并没有减少茎节个数,而是通过减少各茎节的长度来降低株高(表2)。‘邯6172’矮秆突变体第1茎长度较‘邯6172’分别降低 2.3 cm(46.0%)和2.1 cm(33.8%);第 2 茎长度分别降低 1.8 cm(18.9%)和1.7 cm(17.5%),第 3 茎长度分别降低 0.7 cm(4.6%)和1.2 cm(7.8%),第 4 茎长度分别降低 4.2 cm(25.6%)和4.2 cm(24.6%),穗下茎长度分别降低 3.1 cm(11.8%)和2.5 cm(10.1%);各茎节长度降幅表明植株矮化的主要原因是第 4 茎及穂下茎长度降低。‘邯6172’矮秆突变体的穗长、旗叶长宽和旗叶面积相比于‘邯6172’没有负面效应。但是,矮秆突变体在降低株高的同时,推迟抽穗期和开花期,矮秆材料的抽穗期比高秆材料晚3 d,开花期推迟3 d(表3),在育种应用时应注意生育期变化对小麦生长发育及最终产量的影响。

表2 ‘邯6172’矮秆突变体和‘邯6172’的株高及相关性状Table 2 Plant height and related traits of wheat lines ‘Han 6172’ and ‘Han 6172’ mutant

表3 ‘邯6172’矮秆突变体及‘邯6172’的发育进程Table 3 Heading and flowering growth stages of wheat lines ‘Han 6172’and ‘Han 6172’ mutant
2.3 ‘邯6172’矮秆突变体产量性状鉴定
研究发现,与‘邯6172’相比,‘邯6172’矮秆突变体的小穗数和穗粒数没有显著变化,‘邯6172’矮秆突变体的有效分蘖数和千粒质量显著降低,有效分蘖数分别降低 1 个(14.3%)和 1 个(11.1%),千粒质量分别降低 3.3 g(6.7%)和 2.1 g(4.5%),从而使其单株产量显著降低;由于‘邯6172’矮秆突变体的生物量显著降低,分别降低 6.8 g(14.7%)和 8.4 g(18.8%),使其收获指数较‘邯6172’显著增加,分别增加12.2%和12.8%(表4)。
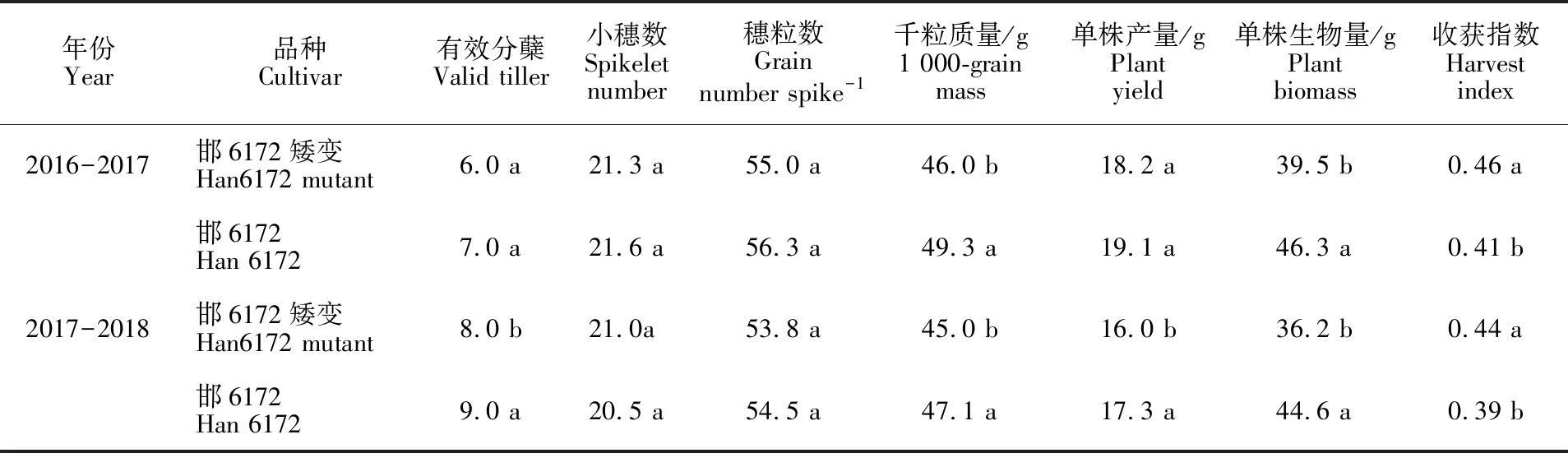
表4 ‘邯6172’矮秆突变体及‘邯6172’产量组成性状Table 4 Yield composition traits of wheat lines ‘Han 6172’and ‘Han6172’ mutant
2.4 ‘邯6172’和‘邯6172’矮秆突变体的SNP差异分析
通过 35 K 芯片扫描分析,在‘邯6172’与‘邯6172’突变体中共发现 3 613 个纯合差异SNP,变异丰富,平均 4.1 Mb就有1个突变。其中2B、2D、5B和6B染色体上的差异SNP最多,4B、4D和7A染色体上的差异SNP最少,另外有 14 个SNP未定位到已知的染色体(图1)。
3 讨 论
株高对小麦产量有着重要影响,矮秆基因的发现和利用引发第一次绿色革命并大幅度提高小麦产量,然而,目前生产上广泛应用的矮秆基因较为单一,主要是Rht-B1b和Rht-D1b,不利于拓宽遗传基础以及产量、品质的持续提升;除此之外,Rht-B1b和Rht-D1b会缩短胚芽鞘长度,影响苗期活力,尤其在干旱半干旱地区会影响出苗和幼苗群体的建成。因此,发掘新的矮源,促进其合理利用,对于小麦矮化、抗倒伏育种具有重要的理论和实践意义。
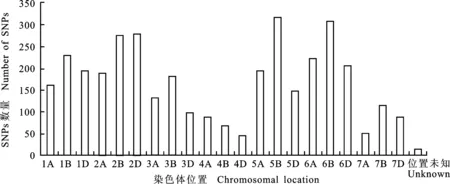
图1 各染色体SNP数量Fig.1 Number of SNPs per chromosome
本研究利用‘邯6172’和‘邯6172’矮秆突变体为材料,进行遗传特性分析,发现该矮秆突变体对外源赤霉酸敏感性较弱,且对胚芽鞘长度和苗期第 1 叶有负面效应,可能会不利于苗期活力和幼苗形态建成,育种应用时应考虑改良该效应。同时,‘邯6172’矮秆突变体的降秆效应为15.0%,表现出很强的抗倒伏性,且对旗叶长宽和旗叶面积没有负面影响。刘秉华等[14]和Ellis等[15]研究表明,Rht-B1b和Rht-D1b的降秆强度约为20%,Rht-B1b+Rht-D1b的降秆强度则较强,可达48%。Ellis等[16]和Bonnett等[17]报道,Rht-B1b和Rht-D1b具有显著降低小麦株高的能力,降秆效应约为20%~30%,而Rht8的降秆效应仅为10%。可见‘邯6172’矮秆突变体的降秆效应要比Rht-B1b和Rht-D1b低一些,但是高于Rht8的降秆强度。另外,降秆效应较强的矮秆基因还有Rht12、Rht10、Rht5和Rht13,其降秆效应分别为45%、69%、55%和34%[18],但是这些矮秆基因的遗传效应和致矮机制还不清楚,应用价值尚不明确,在生产上应用并不广泛。Rht13由于通常会延迟抽穗时间约1周左右,不利于籽粒的生长发育;Rht10也会大幅度地延迟抽穗时间,从而对产量产生不利影响[11, 19]。本研究中矮秆材料的抽穗期比高秆材料晚3 d,开花期推迟3 d,在一定程度上减少倒春寒的危害,但这种晚熟特性也可能缩短最佳的灌浆时间,导致矮秆材料千粒质量降低。矮秆材料的小穗数和穗粒数较高秆材料没有明显变化,但由于其有效穗数和千粒质量减小,导致单株产量降低。在生产上,可以通过增加基本苗数,弥补有效分蘖不足对穗数的影响。由于矮秆材料的生物量显著减少,导致其收获指数显著增加。育种中可通过回交或与其他优良品种杂交,进一步改良‘邯6172’矮秆突变体的开花期、千粒质量等农艺性状,为其育种利用奠定基础。
小麦 35 K 芯片检测发现,该突变体突变位点较多,株高降低可能是多个位点突变的综合效应,而非简单的单基因突变。也表明太空诱变效应较强,可获得丰富的变异。本研究将构建该突变体的定位群体,为挖掘主效株高调控位点提供材料。
