人源与动物源大肠埃希菌的同源性分析
2018-07-02夏鹏程张志军赵书平
赵 珂, 夏鹏程, 张志军, 赵书平
(1泰山医学院, 山东 泰安 271016; 2泰安市中心医院, 山东 泰安 271000)
大肠埃希菌是人类和动物肠道中的正常定植菌,具有条件致病性和非条件致病性等多样性特点。在临床上,大肠埃希菌是最常见的条件致病菌,感染部位广泛,且耐药机制复杂,在世界范围内广泛流行[1]。大肠埃希菌也是一类常见的人畜共患病原菌,是动物和人类各种疾病中常分离的病原菌[2]。近几十年来,随着养禽业的发展,在病毒性疾病使用有效疫苗加以控制后,大肠埃希菌病原菌可以感染不同生长阶段的鸭,其感染已经增加社会的经济和健康负担,引起了多次疫情的暴发与流行[3-6]。全世界普遍关注的食品安全问题中大肠埃希菌感染是一个主要的全球公共卫生问题之一,大肠埃希菌是食品污染监测的主要指标菌,近年来关于人畜共患大肠埃希菌感染的报道越来越多,发病率增高,流行范围广,某些类型病死率高,给养殖业造成极大损失,而且由此引发的动物源性食品安全问题也严重威胁着人类健康[5-6]。本文主要研究大肠埃希菌导致的人畜共患病是否具有同源性。
1 材料与方法
1.1 样本来源 2015年7月—2016年7月从泰安地区大规模养殖场病鸭肺组织采样分离到的4株耐多粘菌素非重复大肠埃希菌,编号D1、D2、D3、D4;2014年7月—2015年12月在泰安市中心医院临床患者分离的12株耐碳青霉烯类非重复大肠埃希菌,编号H1、H2、H3……H12,其中4株来自重症监护病房(ICU)患者的尿,3株来自患者的痰(内分泌科、急诊科、神经外科ICU各1株),2株来自ICU患者的血,2株来自患者的穿刺液(儿外科、普外科东区各1株),1株来自ICU患者的脑脊液;药敏质控菌株:大肠埃希菌ATCC 25922;脉冲场凝胶电泳参考菌株:沙门菌H9812。
1.2 仪器与试剂 仪器:Microscan WalkAway 96 PLUS型全自动细菌鉴定分析仪(德国西门子公司);PCR分析仪、琼脂糖凝胶电泳仪、凝胶成像系统、CHEF Mapper脉冲场凝胶电泳仪、Gel Doc成像仪(美国BIO-Rad公司)。试剂:E-Test条(法国梅里埃公司,bioMerieux, France);XbaI[(限制性内切酶)Thermo Scientific公司];药敏纸片[(10 μg)英国OXOID公司];NC61鉴定药敏板(德国西门子公司);SeaKem gold agarose (美国BD公司);PCR试剂(上海派森诺生物公司)。
1.3 细菌培养与药敏试验 培养方法:按细菌检验操作规程执行。鉴定与药敏:菌株经Microscan WalkAway 96 PLUS型全自动细菌鉴定仪鉴定 NC50复合板鉴定和药敏试验。并根据美国临床实验室标准化协会(CLSI)修正药敏结果。
1.4 耐药基因比对 细菌DNA提取采用煮沸法。聚合酶链式反应(PCR)扩增耐药基因、引物[7]。sunnybio公司测序,对测序结果进行比对。PCR反应条件:95℃预变性持续1 min→95℃变性持续45 s→57℃退火复性持续45 s→72℃延伸45 s(需要35个循环)→72℃延伸10 min结束。
1.5 多位点序列分型(multilocus sequenee typing, MLST) 管家基因位点选择均参照英国沃里克大学数据库(http://mlst.warwick.ac.uk /mlst /dbs /Ecoli)所提供的大肠埃希菌MLST方案(见表1)。选择管家基因的ST亚型,再将每株菌株的7个管家基因亚型号输入等位基因比对框,得到每株细菌的序列分型(ST)号。PCR扩增产物结果阳性者全部送检测序;测序结果通过BLAST进行比对[8]。
表1大肠埃希菌MLST扩增管家基因的引物序列
Table1Primer sequences for MLST amplification of housekeeping genes ofE.coli

管家基因引物(5'→3')片段长度(bp)退火温度(℃)adkATTCTGCTTGGCGCTCCGGG 58354CCGTCAACTTTCGCGTATTTfumCTCACAGGTCGCCAGCGCTTC 80654GTACGCAGCGAAAAAGATTC gyrBTCGGCGACACGGATGACGGC 91160GTCCATGTAGGCGTTCAGGGicdATGGAAAGTAAAGTAGTTGTTCCGGCACA 87854GGACGCAGCAGGATCTGTTmdhATGAAAGTCGCAGTCCTCGGCGCTGCTGGCGG 93260TTAACGAACTCCTGCCCCAGAGCGATATCTTTCTTpurACGCGCTGATGAAAGAGATGA81654CATACGGTAAGCCACGCAGA recAACCTTTGTAGCTGTACCACG 78058TCGTCGAAATCTACGGACCGGA
1.6 脉冲场凝胶电泳(PFGE) 将耐药菌株进行接种,18 h后配菌悬液,调节菌液浊度至4.5~5.0,1.5 mL的离心管中加入400 μL菌悬液和20 μL蛋白酶 K,然后与56℃预热的SeaKemGold Agarose 400 μL混合后注模。将胶块放入5 mL含25 μL蛋白酶K 的细胞裂解液中,54℃水浴摇床裂解2 h。将水和TE预热于50℃水浴箱中,10~15 mL 50℃的水清洗2次,10~15 mL 50℃的TE清洗3次,每次10~15 min。洗好的胶块浸于TE,4℃保存。切取胶块2 mm,浸入含XbaⅠ酶3 μL的200 μL酶切体系中,37℃水浴至少2 h。酶切后的胶块置于梳齿,Marker位于1、5、10、15泳道,其余泳道放试验菌株。倒入冷却至50℃ 1%的琼脂糖,冷却15 min,放入电泳仪电泳。电泳条件:电压 6 V,脉冲参数:初始切换时间为2.2 s,最终切换时间为54.4 s,电泳温度14℃,电泳时间18 h左右。电泳结束后取出胶块,1∶10 000的溴化乙锭溶液染色20~30 min,纯水脱色 30 min。用Gel Doc成像[9]。
2 结果
2.2 耐药基因比对 使用通用引物对耐药基因进行筛选,对电泳阳性的耐药基因进行测序。人源大肠埃希菌NDM-1均阳性,鸭源大肠埃希菌NDM-1均阴性;CTT阳性菌株为D1、D2、D3、H3、H10;SHV阳性菌株为H7;TEM阳性菌株为H3、H5、H10、H11;CTX-M1阳性菌株为D4、H4、H8、H9、H10、H11、H12;CTX-M3阳性菌株为H2、H3、H4、H5、H6、H7、H8、H9、H11、H12;ARMA阳性菌株为H6、H8、H9、H11、H12;mcr-1阳性菌株为D1、D2、D3、D4。见表3。
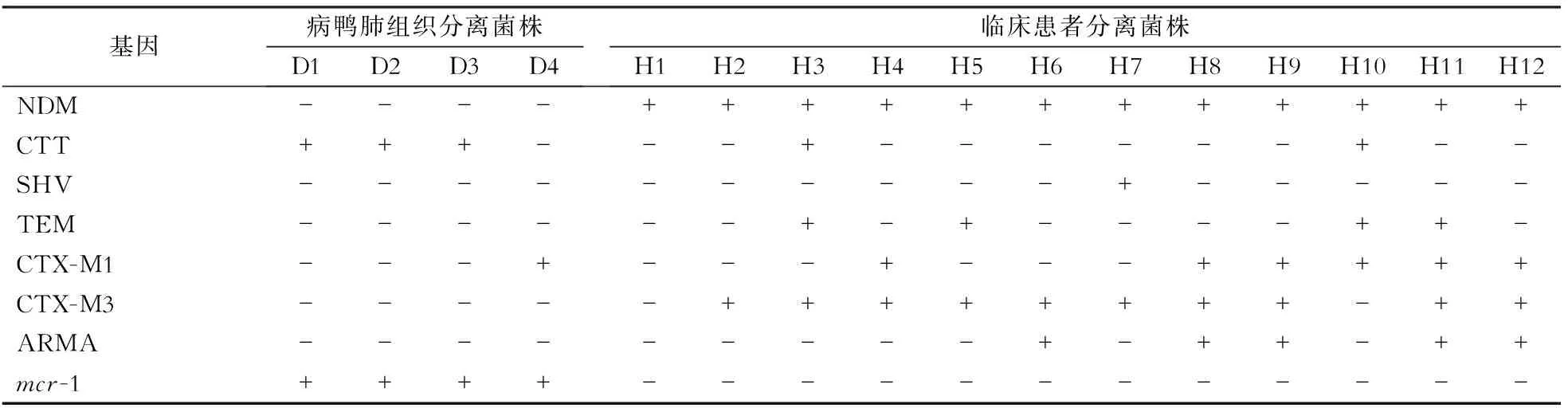
表3 鸭源和人源大肠埃希菌耐药基因比对
+:阳性;-:阴性
2.3 MLST比对结果 根据MLST结果发现鸭中D2号和D3号ST相同,为5912,鸭中D1号和临床分离的H5号ST相同,为10。见表4。
2.4 PFGE 将ST相同的鸭源大肠埃希菌和临床患者分离的大肠埃希菌2株编号,进行PFGE;沙门Braenderup血清型H9812作为参考菌株,经XbaI酶切作为分子量标准,即Marker。大肠埃希菌经限制性内切酶XbaⅠ酶切后的PFGE图,将PFGE图谱,输入Bionumeric软件聚类分析,2株菌株相似度为64.7%。见图1。
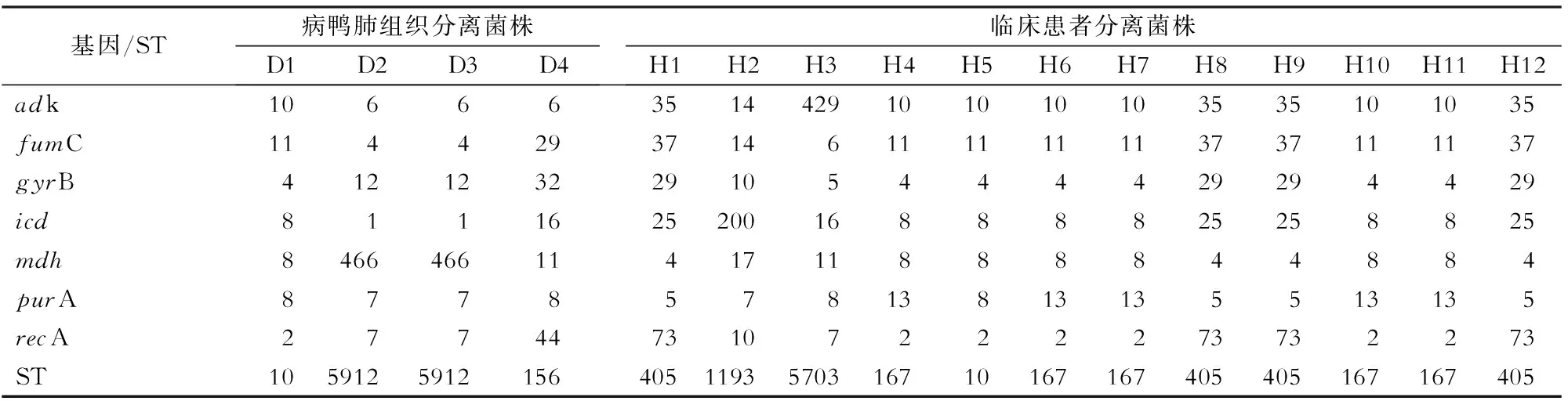
表4 鸭源和人源大肠埃希菌MLST比对结果
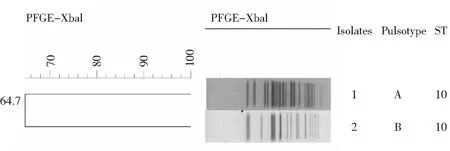
图1 D1和H5大肠埃希菌PFGE电泳聚类分析图
3 讨论
MLST和PFGE是近年发展起来的基于分子水平的分型技术。MLST技术是建立在管家基因测序基础上的分型技术,通过分析多个管家基因位点的核酸序列获得等位基因编码和ST型。PFGE在细菌分型上得以应用,以其分辨力强、重复性好、结果稳定、易于标准化、鉴别力高而被誉为细菌分子生物学分型技术的“金标准”[14],并且广泛应用于众多细菌的分子流行病学调查,分析菌株的相关性,描述感染的传播途径并追踪溯源[15-17]。本次研究发现人源5号和鸭源1号大肠埃希菌ST相同,为ST10,与Xu Y等[8]报道的在腹泻患者、健康携带者、动物和生肉中分离到的大肠埃希菌ST相同。也有文献[18-20]表明畜禽中广泛流行的序列型ST10及其复合体在本地区居民中多见,可初步证明耐药性有从畜禽向人类传播的趋势。其他鸭源中2株ST5912,1株ST156,临床分离的大肠埃希菌分别为1株ST405,1株ST1193,1株ST5703,1株ST167。 我们进而对来源不同但ST相同的大肠埃希菌进行PFGE,发现分为不同谱型,PFGE带型相似度只有64.7%,以往报道中也出现过这种现象。原因可能是MLST方法是选用序列具有高度保守性的管家基因进行序列分析,造成其可能对同一血清型别的菌株的分型能力较弱,刘慧玲等[15]研究表明, 对于同一血清型的菌株,PFGE分辨力更高。总之,PFGE的分型能力高于MLST,MLST结果与血清型相关性较高[21]。我们仍需要扩大标本量进行更全面的研究。
虽然本研究结果表明泰安地区人源与鸭源大肠埃希菌同源性并不是很高;但是,大肠埃希菌具有很高的人畜共患潜力,对公众构成重大健康威胁。越来越多的证据表明,大部分亚洲人群具有人畜共患潜力,致病性大肠埃希菌向人类传播的途径是通过消费动物来源的食物,特别是零售家禽产品传播[3]。我们仍应重视,对人畜共患大肠埃希菌病防治应根据其流行特征,一方面要选用敏感药物,合理使用抗菌药物,从而防止产生多重耐药大肠埃希菌;另一方面要提高群众的防病意识,注重养殖环境卫生。预防为主、人病畜防、建立健全人畜共患病防控体系,变被动应付为主动预防,把人畜共患病的危害降到最低,必须增强以人为本的理念,建立健全科学有效的人畜共患病防控体制和机制。
[参考文献]
[1] 杨妮娜, 张翠英, 鹿亚昆.大肠埃希菌临床分布及耐药趋势分析[J].长治医学院学报, 2015, 29(4):299-301.
[2] 吕殿红, 周秀蓉.携带耶尔森强毒力岛的大肠埃希菌耐药性及其对雏鸭的致病性试验[J].动物医学进展, 2011, 32(1):50-54.
[3] Cunha MPV, Saidenberg AB, Moreno AM, et al. Pandemic extra-intestinal pathogenicEscherichiacoli(ExPEC) clonal group O6-B2-ST73 as a cause of avian colibacillosis in Brazil[J]. PloS One, 2017, 12(6): e0178970.
[4] Li R, Li N, Zhang J, et al. Expression of immune-related genes of ducks infected with avian pathogenicEscherichiacoli(APEC)[J]. Front Microbiol, 2016, 7: 637.
[5] Johura FT, Parveen R, Islam A, et al. Occurrence of hybridEscherichiacolistrains carrying Shiga toxin and heat-stable toxin in livestock of Bangladesh[J]. Front Public Health, 2017, 4: 287.
[6] Dong HJ, Lee S, Kim W, et al. Prevalence, virulence potential, and pulsed-field gel electrophoresis profiling of Shiga toxin-producingEscherichiacolistrains from cattle[J]. Gut Pathog, 2017, 9: 22.
[7] Timmons C, Trees E, Ribot EM, et al. Multiple-locus variable-number tandem repeat analysis for strain discrimination of non-O157 Shiga toxin-producingEscherichiacoli[J]. J Microbiol Methods, 2016, 125: 70-80.
[8] Xu Y, Bai X, Jin Y, et al. High prevalence of virulence genes in specific genotypes of atypical enteropathogenicEscherichiacoli[J]. Front Cell Infect Microbiol, 2017, 7: 109.
[9] Ahmed S, Olsen JE, Herrero-Fresno A. The genetic diversity of commensalEscherichiacolistrains isolated from non-antimicrobial treated pigs varies according to age group[J]. PLoS One, 2017, 12(5): e0178623.
[10] Cabal A, Vicente J, Alvarez J, et al. Human influence and biotic homogenization drive the distribution ofEscherichiacolivirulence genes in natural habitats[J]. Microbiologyopen, 2017, 6(3), doi: 10.1002/mbo3.445.
[11] Bai X, Wang H, Xin Y, et al. Prevalence and characteristics of Shiga toxin-producingEscherichiacoliisolated from retail raw meats in China[J]. Int J Food Microbiol, 2015, 200: 31-38.
[12] Zhu Y, Dong W, Ma J, et al. Characterization and virulence clustering analysis of extraintestinal pathogenicEscherichiacoliisolated from swine in China[J]. BMC Vet Res, 2017, 13(1): 94.
[13] 孙丽, 郭燕, 杨洋, 等. 肠杆菌科细菌对多黏菌素的敏感性分析[J].中国感染与化疗杂志, 2016, 16(3):373-376.
[14] 李庆雷, 柴同杰, 刘巍. ERIC-PCR和PFGE对大肠埃希菌由舍内向舍外传播的鉴定及两种方法的比较[J].动物医学进展, 2010, 31(S1):112-117.
[15] 刘慧玲, 万志刚, 洪小柳, 等. 进出口食品中不同血清型沙门氏菌PFGE和MLST分型比较研究[J].食品安全质量检测学报, 2014, 5(11):3454-3461.
[16] 盛跃颖, 庄源, 陈洪友, 等.上海地区分离的大肠埃希菌O157的分子分型研究[J].中国卫生检验杂志, 2016, 26(7):917-920.
[17] 郑伟, 汪皓秋, 张蔚, 等.多位点序列分型和脉冲场凝胶电泳技术在肠炎沙门菌暴发事件病原学鉴定中的应用[J].中国预防医学杂志, 2015, 16(4):292-295.
[18] Chen CM, Ke SC, Li CR, et al. High diversity of antimicrobial resistance genes, class 1 integrons, and genotypes of multidrug-resistantEscherichiacoliin beef carcasses[J]. Microb Drug Resist, 2017, 23(7): 915-924.
[19] 王苗苗.山东某生猪养殖县农村居民产ESBL大肠埃希菌流行现状及分子分型研究[D].山东:山东大学, 2017.
[20] 孙磐.家庭式猪养殖地区产ESBL大肠埃希菌耐药性及其向周边环境传播的研究[D].山东:山东大学, 2017.
[21] 邵纯纯.不同来源产志贺毒素大肠埃希菌的分子流行病学研究[D].山东:山东大学, 2017.
