乙型肝炎病毒X蛋白在促进肝细胞衰老中的作用
2018-07-02熊莹晖傅永明周鹏程王晓芳黄泽炳胡兴旺范学工
熊莹晖, 傅永明, 周鹏程, 王晓芳, 黄泽炳, 全 俊, 胡兴旺, 范学工
(中南大学湘雅医院 病毒性肝炎湖南省重点实验室, 湖南 长沙 410008)
慢性肝炎持续较长时间可逐渐发展为肝纤维化、肝硬化及肝癌。慢性肝炎患者的基本病理特征为持续性肝细胞损伤,且肝细胞损伤在疾病的发展过程中发挥重要作用。损伤的肝细胞可以根据受损伤程度的不同而分别进入衰老、凋亡或坏死状态[1-2]。衰老肝细胞表现为细胞形态改变、细胞周期阻滞(分子水平表现为细胞周期阻滞相关蛋白p53/p21、p16/p-Rb等表达量升高)、β-半乳糖苷酶(可以区分衰老细胞、衰老前细胞和分化细胞)表达、衰老相关异染色体灶及DNA损伤灶在核内聚集等[3]。衰老肝细胞可分泌大量的细胞因子(衰老相关分泌表型)[4-7],细胞因子可促进炎症发生,从而清除衰老、坏死细胞及恶变细胞,发挥修复机体损伤的作用[8-9]。肝细胞长期受损将导致衰老细胞积聚,衰老细胞在组织器官内可持续存活数年,从而引起组织器官微环境改变及稳态失衡[10-12]。有研究[13]表明,氧化应激、DNA损伤及癌基因的活化等可诱导细胞衰老,导致细胞周期阻滞、抗凋亡、表观遗传改变及衰老相关分泌表型等的发生。丙型肝炎病毒感染持续时间是导致肝纤维化进展的一个主要危险因素,病史越长肝纤维化进展的可能性越大[14-16]。乙型肝炎、丙型肝炎、酒精性脂肪肝及非酒精性脂肪肝患者进行肝组织活检时发现肝细胞衰老与肝纤维化程度呈正相关[17-20]。肝脏存在铁沉积的遗传性血色素沉着症患者及肝硬化患者的肝组织标本研究显示存在肝细胞衰老,且研究者认为衰老肝细胞参与了肝纤维化及肝硬化发展[21-22]。
在我国,乙型肝炎病毒(HBV)感染是引起慢性肝病的首要病因,约有90%的肝细胞癌是由慢性肝病发展而来[23]。因此,研究慢性乙型肝炎疾病发展的诱因和机制具有重要的临床指导意义。有研究[17]发现HBV慢性感染可诱发肝细胞衰老,但HBV诱发肝细胞衰老的机制尚不清楚。有研究[24]表明HBV编码的X蛋白(HBx)可促进外泌体分泌,并可通过外泌体或肝星状细胞上调纤维化重要标志物α-平滑肌肌动蛋白的表达。另外,在过表达HBx的HepG2细胞皮下成瘤的动物中发现,肿瘤组织中胶原纤维Ⅰ和Ⅳ的含量上升,因此,研究者认为HBx参与了肝纤维化的发展[25]。HBx已经被确认属于癌基因,癌基因的激活可诱导肝细胞衰老[13]。基于以上研究,我们推测HBx可能参与HBV诱导肝细胞衰老的过程,并通过相关实验证实HBx参与HBV诱导肝细胞衰老,具体结果阐述如下。
1 材料与方法
1.1 研究细胞和试剂 HepG2.2.15 细胞购于中南大学湘雅医学院细胞库,HepG2 细胞和293T细胞购于上海细胞库;抗体p21(2947s)和p16(14256)购于Cell Signaling Technology公司;抗体p53(sc-53395)购于Santa Cruz Biotechnology公司;Senescence β-Galactosidase Staining Kit(货号:C0602)购于碧云天公司;DharmaFECT 1 Transfection Reagent(T-2001-03)购于Dharmacon公司;pLV-EF1α-MCS-IRES-Bsd(cDNA-pLV03)购于Biosettia公司;HBx si-RNA(正义链5’-UCACCUCUGCACGUAGCAUTT-3’,反义链5’-AUGCUACGUGCAGAGGUGATT-3’)购于上海吉玛制药技术公司,BCA Protein Assay Kit(1859078)以及ECL(34095)购于Thermo Scientific Pierce Protein Biology公司。
1.2 研究方法
1.2.1 构建HBx过表达慢病毒 将293T细胞接种于6孔细胞培养板中,在细胞融合度达到90%左右时,将PLVX-HBx过表达质粒和慢病毒包装质粒(pMDLg/pRRE,pRSV-REV,pCMV-VSV-G)混合于500 μL无血清DMEM中(混合比例为pLVXsh∶pMDLg/pRRE∶pRSV-REV∶pCMV-VSV-G=1.5∶1∶0.75∶0.3∶0.45);另外,取7.5 μL lipofectamine 2000 加入500 μL无血清DMEM后混匀,静置5 min;然后将两种DMEM混合物合并混匀,静置15 min。将混合后的DMEM加入无抗生素完全培养基培养的293T细胞中,转染12 h后换液,然后继续培养48 h后收集培养液上清,在1 300 rmp下离心5 min去除细胞碎片,获得含慢病毒的培养液上清。对照组为未进行HBx过表达慢病毒,采用相同的操作方法获对照组未进行HBx过表达慢病毒上清培养液。
1.2.2 构建稳定表达HBx的HepG2细胞系(HepG2-HBx)及其对照组细胞系(HepG2-HBx-con) 将HepG2细胞接种于6孔细胞培养板中,在细胞融合度为20%~30%左右时,吸去培养基,加入2 mL含有200 μL HBx过表达慢病毒液和4 μg/mL的polybrane无抗生素完全培养基,然后加入慢病毒液感染HepG2细胞,在1 000 g下离心1 h。HepG2细胞感染24 h后换新鲜完全培养基,培养72 h后用含杀稻瘟菌素(6 μg/μL)的DMEM完全培养基进行筛选,筛选一个月左右得到稳定过表达HBx的HepG2细胞系(HepG2-HBx)。同时用未进行HBx过表达慢病毒采用相同的操作方法获得对照组细胞系(HepG2-HBx-con)。
1.2.3 构建瞬时沉默HBx蛋白的HepG2.2.15细胞(HepG2.2.15-HBx-si)及其对照组细胞(HepG2.2.15-HBx-nc) 将HepG 2.2.15细胞接种于6孔细胞培养板中,在细胞融合度达到40%左右时,将5 μmol HBx si-RNA或5 μmol HBx nc si-RNA混于500 μL无血清DMEM中;另外,取5 μL DharmaFECT 1 Transfection Reagent与500 μL无血清DMEM进行混匀,静置5 min;然后将两种DMEM混合物合并混匀,静置15 min;取DMEM混合物加入无抗生素完全培养基的HepG2.2.15细胞中,构建HepG2.2.15-HBx-si 和HepG2.2.15-HBx-nc。72 h后可提取细胞蛋白。
1.2.4 衰老细胞β-半乳糖苷酶染色 衰老细胞内表达β-半乳糖苷酶在pH6.0时具有高酶活性,在经Senescence β-Galactosidase Staining Kit处理的衰老细胞中,该酶可催化试剂底物产生一种深蓝色物质,使细胞在光学显微镜下呈现深蓝色。首先接种1.0×105/孔的细胞于12孔细胞培养板,经过24 h培养后细胞贴壁,吸去细胞培养液,用1 mL PBS洗1次,加入0.5 mL β-半乳糖苷酶染色固定,室温静置15 min;吸去固定液后用1 mL PBS洗3次,每次洗3 min;吸去PBS后每孔加入0.5 mL染色工作液(染色工作液配方:A液5 μL、B液5 μL、C液465 μL),37 ℃孵育过夜;采用PBS洗1次后于显微镜下观察染色状态,并进行拍照;每组实验重复3次。
1.2.5 Western Blot检测衰老相关蛋白 应用Western Blot检测细胞衰老相关分子p21、p16等的表达量。首先提取经过处理的细胞总蛋白,用BCA Protein Assay Kit测量蛋白浓度后,采用12% SDS-聚丙烯酰胺凝胶电泳,然后湿法转印至PVDF膜,5%脱脂牛奶封闭1 h后用TBST缓冲液洗3次,每次5 min;随后加一抗(1∶1 000 TBST稀释)4℃孵育过夜,TBST缓冲液洗3遍,每次5 min。加入对应二抗(1∶2 000 TBST稀释)室温孵育1 h,TBST缓冲液洗3遍,每次10 min,加ECL发光液后观察结果,每组实验重复3次。
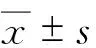
2 结果
2.1 HepG2.2.15细胞衰老β-半乳糖苷酶染色 HepG2.2.15(含有HBV全基因组的转基因细胞系)中的β-半乳糖苷酶着色较HepG2细胞明显增强,见图1。每个组选取多个不重复独立视野,进行染色阳性细胞计数,结果显示β-半乳糖苷酶染色阳性细胞所占比例HepG2.2.15组(0.480±0.096)高于HepG2组(0.016±0.005),且两组间差异有统计学意义(P<0.001),见图2。

HepG2 HepG2.2.15
图1HepG2衰老细胞(n=3)和HepG2.2.15衰老细胞(n=3)β-半乳糖苷酶染色图
Figure1Senescence β-galactosidase staining of HepG2 (n=3) and HepG2.2.15 (n=3)

图2HepG2衰老细胞(n=3)和 HepG2.2.15衰老细胞(n=3)β-半乳糖苷酶染色比较
Figure2Comparison of senescence β-galactosidase staining between HepG2 (n=3) and HepG2.2.15 (n=3)
2.2 HepG2.2.15细胞衰老相关蛋白p53与p21表达情况 采用细胞蛋白tublin作为内参进行比较,HepG2.2.15细胞内调控细胞周期阻滞的蛋白p53和p21的表达水平高于HepG2组,HepG2.2.15细胞衰老相关蛋白p53与p21表达量较HepG2显著上调,HBx在HepG2.2.15细胞内表达,而在HepG2内无表达。见图3。
图3 HepG2.2.15细胞衰老相关蛋白表达(n=3)
Figure3Expression level of senescence-associated protein in HepG2.2.15 (n=3)
2.3 HBx沉默的HepG2.2.15细胞衰老β-半乳糖苷酶染色 HepG2.2.15-HBx-si组β-半乳糖苷酶染色阳性细胞比例较其对照组(HepG2.2.15-HBx-nc)有所下降。HBx沉默后HepG2.2.15行β-半乳糖苷酶染色后发现β-半乳糖苷酶染色阳性细胞HepG2.2.15-HBx-si比例为(0.278±0.065),对照组HepG2.2.15-HBx-nc为(0.329±0.044),两组间比较差异无统计学意义(P=0.092)。见图4、图5。

HepG2.2.15-HBx-nc HepG2.2.15-HBx-si
图4HBx沉默(n=3)和HBx未沉默(n=3)HepG2.2.15细胞衰老β-半乳糖苷酶染色图
Figure4Senescence β-galactosidase staining in HepG2.2.15-HBx-si (n=3) and HepG2.2.15-HBx-nc (n=3)
2.4 HepG2.2.15细胞衰老相关蛋白表达情况 采用细胞蛋白tublin作为内参进行比较,HBx沉默处理后的HepG2.2.15细胞内HBx蛋白水平较其对照组HepG2.2.15-HBx-nc下降,HBx沉默的HepG2.2.15细胞衰老相关蛋白p53与p21表达量较HepG2.2.15下调。见图6。
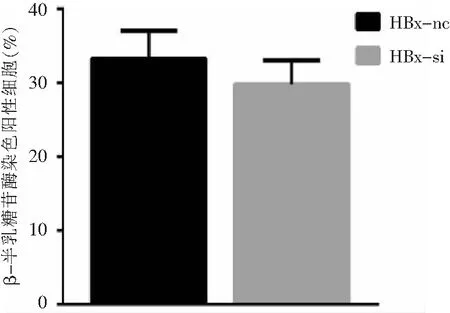
图5HBx沉默(n=3)与HBx未沉默(n=3)的HepG2.2.15细胞衰老β-半乳糖苷酶染色比较
Figure5Comparison of senescence β-galactosidase staining between HepG2.2.15-HBx-si(n=3) and HepG2.2.15-HBx-nc(n=3)
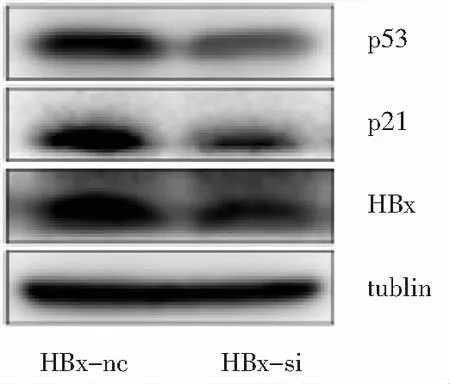
图6 HepG2.2.15细胞衰老相关蛋白表达量(n=3)
Figure6Expression level of senescence-associated protein in HepG2.2.15 (n=3)
2.5 HBx过表达的HepG2细胞衰老β-半乳糖苷酶染色 β-半乳糖苷酶染色阳性细胞比例HepG2-HBx组为(0.319±0.033),对照组HepG2-HBx-con为(0.064±0.012),两组之间比较差异有统计学意义(P<0.001);HepG2-HBx β-半乳糖苷酶染色阳性细胞比例高于对照组。见图7、图8。

HepG2-HBx-con HepG2-HBx
图7HBx过表达对照组和HBx过表达组HepG2衰老细胞β-半乳糖苷酶染色图
Figure7Senescence β-galactosidase staining of HepG2-HBx-con and HepG2-HBx
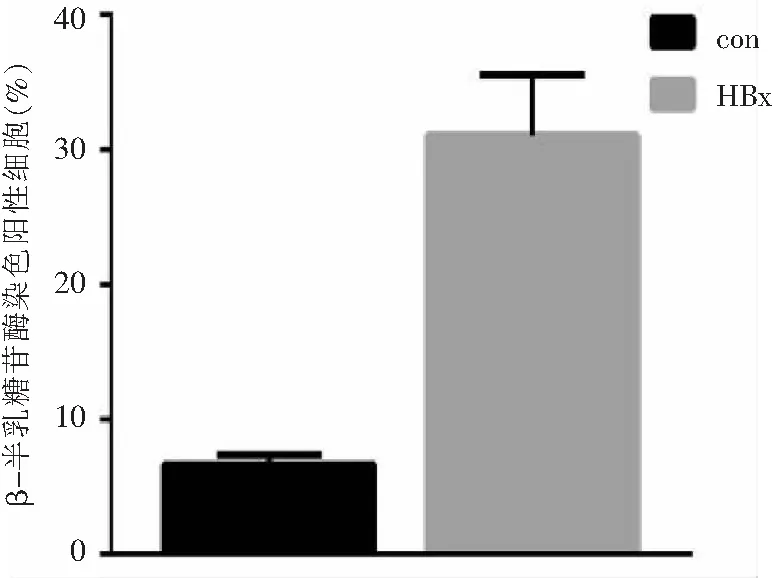
图8HBx过表达对照组(n=3)和HBx过表达组(n=3)HepG2衰老细胞β-半乳糖苷酶染色比较
Figure8Comparison of senescence β-galactosidase staining between HepG2-HBx-con and HepG2-HBx
2.6 HBx过表达HepG2细胞衰老相关蛋白分子表达情况 采用细胞蛋白tublin作为内参进行比较,HBx在HepG2-HBx细胞中表达,而HepG2-HBx-con内无表达;HBx过表达HepG2-HBx细胞内周期阻滞相关蛋白p53和p21的表达量高于不表达HBx的HepG2-HBx-con细胞。见图9。
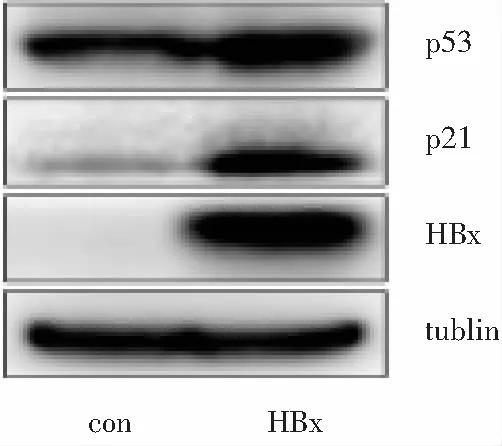
图9HBx过表达HepG2衰老细胞相关蛋白分子表达量(n=3)
Figure9Expression level of senescence-associated protein in HepG2-HBx (n=3)
3 讨论
HBV感染是一个世界性公共卫生问题,全世界范围内约有3.5亿慢性感染患者[26]。我国HBV感染的情况更为严重,2006年全国乙型肝炎流行病学调查表明,乙型肝炎表面抗原(HBsAg)携带率为7.18%,每年因HBV所致的肝硬化、肝癌死亡病例约有30万[27]。因此,乙型肝炎发病机制研究具有重要意义。
慢性乙型肝炎患者肝脏活检研究显示,HBV感染患者肝细胞存在衰老现象,衰老细胞将出现细胞周期阻滞[17, 28]。本研究结果显示稳转HBV全基因组的HepG2.2.15细胞中的衰老细胞β-半乳糖苷酶染色阳性细胞的比例高于对照组HepG2细胞,且在衰老细胞周期阻滞中起重要调控作用的p53蛋白及其下游分子p21表达量也较HepG2细胞高,说明HepG2.2.15细胞中衰老相关蛋白激活,HBV诱发了肝细胞衰老。
查阅相关文献进一步探讨HBV通过何种方式促使肝细胞衰老,发现 HBx在慢性乙型肝炎的疾病发展中发挥重要作用[24-25],但是,具体机制尚不清楚。因此,我们猜想HBV可以通过其编码的HBx诱导肝细胞衰老。本研究通过在HepG2.2.15细胞内沉默HBx后行β-半乳糖苷酶染色,发现虽然衰老细胞比例的差异不具有统计学意义,但整体而言在沉默HBx后衰老细胞减少,且周期阻滞蛋白p53和p21的表达水平下降,说明细胞周期阻滞减弱,提示HBx在HBV诱导肝细胞衰老中起到调控作用,可促进肝细胞衰老。本研究在HepG2细胞内过表达HBx,发现衰老细胞染色明显增强,p53和p21蛋白表达量亦上调,表明在HepG2内过表达HBx可激活细胞内衰老相关蛋白。以上研究验证了HBV可通过HBx促进肝细胞衰老。
衰老细胞可分泌大量细胞因子,如IL-1、IL-6、IL-8等,这些炎症因子可激活肝星状细胞,促进肝脏的损伤修复[6,29]。但是,长期持续性损伤可导致衰老细胞长期存在,不断释放细胞因子引起肝纤维化,甚至可进展为肝硬化。在我国慢性肝病患者中,HBV感染引起肝持续性损伤的慢性肝炎最为常见。慢性乙型肝炎可以进展为肝纤维化、肝硬化,最后或可发展为肝癌。HBV通过HBx诱导的肝细胞衰老可能在整个疾病的发展过程中发挥了重要作用,为我们认识乙型肝炎相关性肝疾病的发生发展机制提供了新的思路,或可为将来慢性肝病的治疗提供新的方向。
[参考文献]
[1] Childs BG, Baker DJ, Kirkland JL, et al. Senescence and apoptosis: dueling or complementary cell fates?[J]. EMBO Rep, 2014, 15(11): 1139-1153.
[2] Campisi J, d'Adda di Fagagna F. Cellular senescence: when bad things happen to good cells[J]. Nat Rev Mol Cell Biol, 2007, 8(9): 729-740.
[3] Aravinthan AD, Alexander GJM. Senescence in chronic liver disease: Is the future in aging?[J]. J Hepatol, 2016, 65(4): 825-834.
[4] Coppé JP, Patil CK, Rodier F, et al. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor[J]. PLoS Biol, 2008, 6(12): 2853-2868.
[5] Kuilman T, Peeper DS. Senescence-messaging secretome: SMS-ing cellular stress[J]. Nat Rev Cancer, 2009, 9(2): 81-94.
[6] Davalos AR, Coppe JP, Campisi J, et al. Senescent cells as a source of inflammatory factors for tumor progression[J]. Cancer Metastasis Rev, 2010, 29(2): 273-283.
[7] Coppé JP, Desprez PY, Krtolica A, et al. The senescence-associated secretory phenotype: the dark side of tumor suppression[J]. Annu Rev Pathol, 2010, 5: 99-118.
[8] Collado M, Blasco MA, Serrano M. Cellular senescence in can-cer and aging[J]. Cell, 2007, 130(2): 223-233.
[9] Krizhanovsky V, Yon M, Dickins RA, et al. Senescence of activated stellate cells limits liver fibrosis[J]. Cell, 2008, 134(4): 657-667.
[10] Jeyapalan JC, Ferreira M, Sedivy JM, et al. Accumulation of senescent cells in mitotic tissue of aging primates[J]. Mech Ageing Dev, 2007, 128(1): 36-44.
[11] Campisi J. Senescent cells, tumor suppression, and organismal aging: good citizens, bad neighbors [J]. Cell, 2005, 120(4): 513-522.
[12] Michaloglou C, Vredeveld LC, Soengas MS, et al. BRAFE600-associated senescence-like cell cycle arrest of human naevi[J]. Nature, 2005, 436(7051): 720-724.
[13] Poynard T, Bedossa P, Opolon P. Natural history of liver fibrosis progression in patients with chronic hepatitis C. The OBSVIRC, METAVIR, CLINIVIR, and DOSVIRC groups[J]. Lancet, 1997, 349(9055): 825-832.
[14] Hoare M, Das T, Alexander G. Ageing, telomeres, senescence, and liver injury[J]. J Hepatol, 2010, 53(5): 950-961.
[15] Wong V, Caronia S, Wight D, et al. Importance of age in chronic hepatitis C infection[J]. J Viral Hepat, 1997, 4(4): 255-264.
[16] Poynard T, Ratziu V, Charlotte F, et al. Rates and risk factors of liver fibrosis progression in patients with chronic hepatitis C[J]. J Hepatol, 2001, 34(5): 730-739.
[17] Tachtatzis PM, Marshall A, Arvinthan A, et al. Chronic hepatitis B virus infection: the relation between hepatitis B antigen expression, telomere length, senescence, inflammation and fibrosis[J]. PloS One, 2015, 10(5): e0127511.
[18] Marshall A, Rushbrook S, Davies SE, et al. Relation between hepatocyte G1 arrest, impaired hepatic regeneration, and fibrosis in chronic hepatitis C virus infection[J]. Gastroenterology, 2005, 128(1): 33-42.
[19] Aravinthan A, Pietrosi G, Hoare M, et al. Hepatocyte expression of the senescence marker p21 is linked to fibrosis and an adverse liver-related outcome in alcohol-related liver disease[J]. PloS One, 2013, 8(9): e72904.
[20] Aravinthan A, Scarpini C, Tachtatzis P, et al. Hepatocyte senescence predicts progression in non-alcohol-related fatty liver disease[J]. J Hepatol, 2013, 58(3): 549-556.
[21] Wood MJ, Gadd VL, Powell LW, et al. Ductular reaction in hereditary hemochromatosis: the link between hepatocyte senescence and fibrosis progression[J]. Hepatology, 2014, 59(3): 848-857.
[22] Wiemann SU, Satyanarayana A, Tsahuridu M, et al. Hepatocyte telomere shortening and senescence are general markers of human liver cirrhosis[J]. FASEB J, 2002, 16(9): 935-942.
[23] Ringelhan M, Heikenwalder M, Protzer U. Direct effects of hepatitis B virus-encoded proteins and chronic infection in liver cancer development[J]. Dig Dis, 2013, 31(1): 138-151.
[24] Kapoor NR, Chadha R, Kumar S, et al. The HBx gene of hepatitis B virus can influence hepatic microenvironment via exosomes by transferring its mRNA and protein[J]. Virus Res, 2017, 240: 166-174.
[25] Feng GX, Li J, Yang Z, et al. Hepatitis B virus X protein promotes the development of liver fibrosis and hepatoma through downregulation of miR-30e targeting P4HA2 mRNA[J]. Oncogene, 2017, 36(50): 6895-6905.
[26] 斯崇文.慢性乙型肝炎的现状和问题[J].临床药物治疗杂志, 2006, 4(4):1-2.
[27] 庄辉.乙型肝炎流行病学进展[C]//中华医学会第十二次全国病毒性肝炎及肝病学术会议论文汇编. 北京, 2005.
[28] Campisi J. Replicative senescence: an old lives' tale?[J]. Cell, 1996, 84(4): 497-500.
[29] 林羡屏, 王小众.肝纤维化相关因子及其作用[J].世界华人消化杂志, 2006, 14(11):1037-1043.
