分子检测与常规培养在中重度皮肤软组织感染病原学诊断中的比较
2018-07-02李湘燕朱赛楠
谢 昆, 李湘燕, 朱赛楠, 齐 心, 郑 波
(北京大学第一医院,北京 100034)
中重度皮肤软组织感染(skin and soft tissue infection,SSTI)早期使用敏感抗菌药物,对控制病情、缩短病程都有重要的临床意义[1]。目前SSTI治疗方案的制定主要根据常规细菌培养结果,但是常规培养结果相对滞后、阳性率低,导致患者可能错失抗感染治疗的黄金时期,因此,病原学的早期诊断,对实现早期抗菌药物目标性治疗,改善患者预后有重要意义[2]。分子诊断技术是应用分子生物学方法检测患者体内遗传物质而做出诊断的技术,检测靶标包括DNA、RNA,是当前医学发展的重要前沿领域之一。分子诊断技术的主要手段包括聚合酶链式反应技术、基因芯片技术及DNA测序等。聚合酶链反应技术(polymerase chain reaction, PCR)作为分子生物学方法中一种常用的方法,以其敏感、特异、简便、快速的特点,可用于感染早期快速检测,并明确病原体[3]。然而目前分子病原学诊断多用于创面分泌物的检测,缺乏SSTI病变组织的研究。本研究旨在评估中重度SSTI组织样本中分子生物学检测方法的价值。
1 对象与方法
1.1 研究对象 按照连续采样方法,收集2016年1—10月北京大学第一医院整形烧伤外科收治的中重度SSTI病例。入组标准:符合美国感染病学会(Infectious Diseases Society of America)中重度SSTI的分级标准[4]。入组患者50例,其中糖尿病足并感染患者22例,手术部位感染患者15例,脓肿患者8例,坏死性筋膜炎患者5例。
1.2 标本留取及处理 创面彻底清创后,使用4 mm 环钻取深部组织共3块,加入30 mL生理盐水,研磨后,制成悬浊液后平均分为3份。第1份注入带有培养基的需氧及厌氧培养瓶内,常规细菌培养。第2份行细菌涂片检查,细菌涂片及培养由北京大学第一医院检验科细菌室完成。第3份使用DNA提取试剂盒提取DNA。
1.3 主要试剂及仪器 细菌基因组DNA提取试剂盒(DP302)购自天根生化科技(北京)有限公司;引物由生工生物工程(上海)股份有限公司合成;TaKaRa Taq Hot Start Version、2.5 mmol dNTP Mixture、10×PCR Buffer均购自宝生物工程(大连)有限公司;亲和素碱性磷酸酶购自Vector公司;牛血清白蛋白、BCIP、NBT购自Amresco公司;Biotin-11-dUTP购自红惠新医药公司;其他生化试剂购自北京化工厂;硝酸纤维素膜购自GE公司。PCR仪为美国赛默飞世尔公司的ABI 9700 I 型PCR仪;AH-8100生物芯片杂交仪、AH-8200生物芯片杂交仪、AA-9100生物芯片分析仪为和利时公司产品。
1.4 引物设计 以金黄色葡萄球菌、表皮葡萄球菌、铜绿假单胞菌、屎肠球菌、粪肠球菌、大肠埃希菌、阴沟肠杆菌、肺炎克雷伯菌和鲍曼不动杆菌等九种常见细菌基因组保守区为靶序列,自行设计特异性引物及试剂盒,对标本的DNA行PCR检测,引物序列见表1。
1.5 分子检测 PCR扩增:PCR反应体系1为:1×PCR Buffer,2 μmol dNTP,4 μmol Biotin-11-dUTP,2 mmol MgCl2,金黄色葡萄球菌、表皮葡萄球菌、铜绿假单胞菌、屎肠球菌、粪肠球菌上下游引物各400 nmol ,2 U Taq酶,0.4 U JNG酶,模板2 μL,水加至60 μL;PCR反应体系2为:1×PCR Buffer,2 μmol dNTP,4 μmol Biotin-11-dUTP,2 mmol MgCl2,大肠埃希菌、阴沟肠杆菌、肺炎克雷伯菌、鲍曼不动杆菌上下游引物各400 nmol ,2 U Taq酶,0.4 U JNG酶,模板2 μL,水加至60 μL。反应条件:37℃消化10 min;94℃预变性4 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,40个循环;72℃延伸10 min。 探针标记及杂交:将9条特异性探针标记于硝酸纤维素膜上,每条探针标记3个点。将PCR扩增后的反应管置于PCR扩增仪中99℃,10 min,然后快速置于冰水浴中。设置杂交程序按照仪器说明书[5]。将杂交反应后的芯片放入生物芯片分析仪中进行数据分析,判读结果。
1.6 统计方法 应用SPSS 16.0进行统计分析,采用描述性统计方法。
2 结果
2.1 革兰染色结果 革兰染色方法阳性率为16.0%(8/50),其中革兰阳性球菌4份,革兰阴性杆菌1份,阴性杆菌合并阳性球菌2份,阴性杆菌合并阳性杆菌1份。

表1 各菌种的特异性引物序列及特异性探针序列
2.2 常规细菌培养与分子生物学检测结果 常规细菌培养方法阳性率为76.0%(38/50),其中单一菌种35份,多菌种3份,分别为大肠埃希菌合并粪肠球菌2份,金黄色葡萄球菌合并粪肠球菌1份。其中有2份培养阳性标本考虑为非致病菌,菌种分别为藤黄微球菌及痤疮丙酸杆菌。分子检测阳性率56.0%(28/50),单一菌种22份,多菌种6份。详见表2、表3。

表2 常规培养与分子生物学检测结果(n=50)
表3常规培养及分子检测结果菌种分布(株)
Table3Distribution of strain species of routine culture and molecular detection results (No. of isolates)
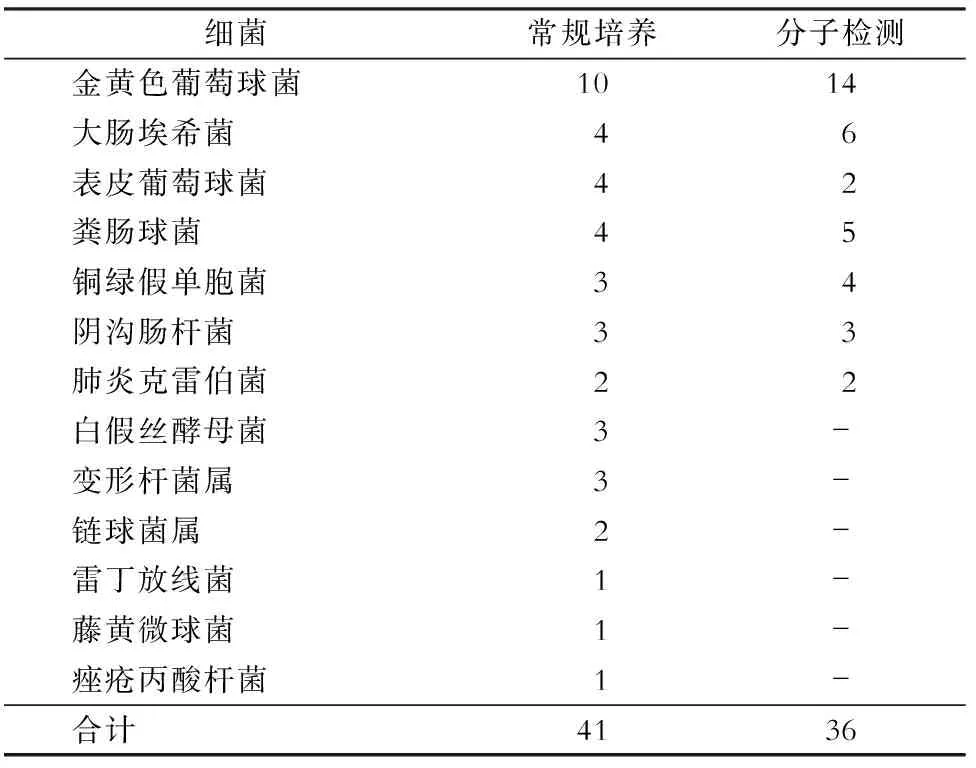
细菌常规培养分子检测金黄色葡萄球菌1014大肠埃希菌46表皮葡萄球菌42粪肠球菌45铜绿假单胞菌34阴沟肠杆菌33肺炎克雷伯菌22白假丝酵母菌3-变形杆菌属3-链球菌属2-雷丁放线菌1-藤黄微球菌1-痤疮丙酸杆菌1-合计4136
2.3 培养法和分子检测法检测结果比较 除去常规培养结果不在选取的9种细菌范围内的标本11份,纳入统计的共 39份标本。其中细菌涂片阳性者8份,阳性率为20.5%;常规培养及分子检测结果阳性率均为69.2 %(27/39)。常规培养及分子检测结果完全符合率为82.1%(32/39):二者结果均为阴性占25.6%(10/39);二者结果均为阳性且完全符合占56.4%(22/39)。常规培养及分子检测结果不符合率为17.9%(7/39),分子检测结果为多种细菌,而培养结果为单一细菌者占7.7%(3/39);分子检测结果为阳性而培养结果为阴性者占5.1%(2/39)。详见表4。
表4常规培养法和分子检测法结果比较(份)
Table4Comparison of routine culture and molecular detection results (No. of specimens)
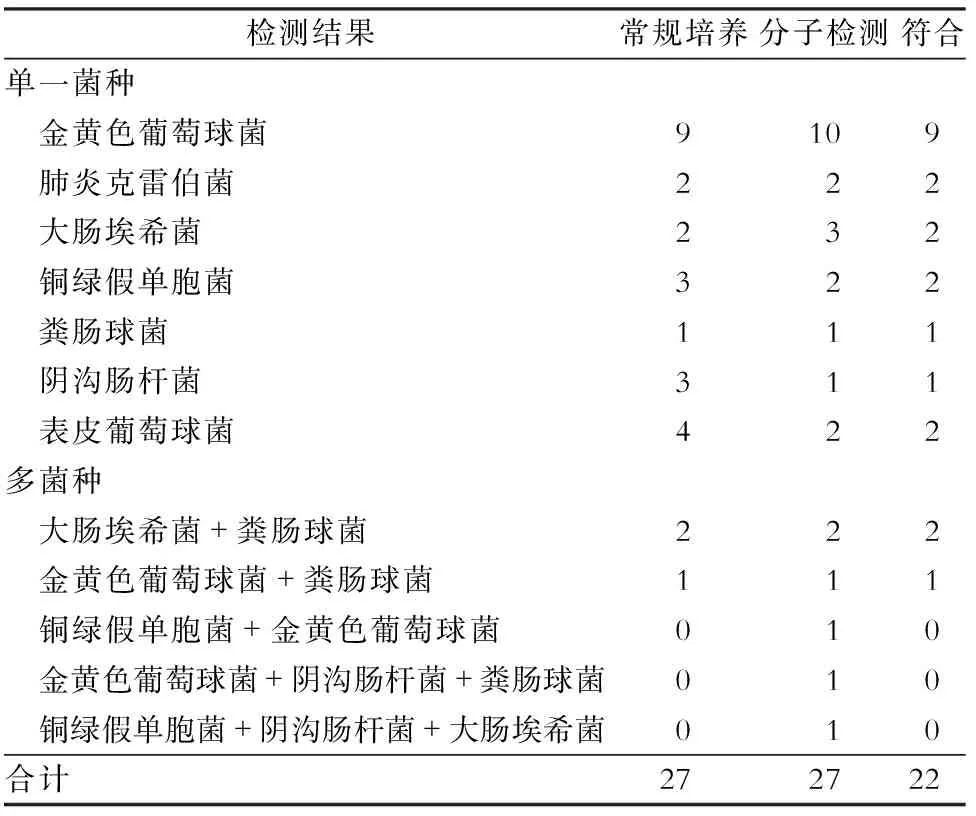
检测结果常规培养分子检测符合单一菌种 金黄色葡萄球菌9109 肺炎克雷伯菌222 大肠埃希菌232 铜绿假单胞菌322 粪肠球菌111 阴沟肠杆菌311 表皮葡萄球菌422多菌种 大肠埃希菌+粪肠球菌222 金黄色葡萄球菌+粪肠球菌111 铜绿假单胞菌+金黄色葡萄球菌010 金黄色葡萄球菌+阴沟肠杆菌+粪肠球菌010 铜绿假单胞菌+阴沟肠杆菌+大肠埃希菌010合计272722
3 讨论
中重度SSTI,尤其是有脓毒症的患者,早期使用敏感的抗菌药物控制感染,对控制病情、缩短病程都有重要的临床意义[6]。早期病原学的诊断有助于在感染早期实现目标性治疗,避免抗菌药物的滥用,以达到进行个性化精准治疗的目的[7-8]。分子检测技术可以通过在分子生物学水平上研究生物大分子,特别是核酸结构及其组成部分检测无法培养或难以鉴定的病原性微生物[9-10]。对于单一致病菌导致的感染检测有着非常好的效果,已经广泛应用于HIV、HCV等多种病毒感染以及衣原体及分枝杆菌感染的检测中[11-13]。目前已有报道称多重PCR-基因芯片杂交技术可用于耐药菌感染的病原学早期诊断和耐药基因的同步检测[14-15]。但目前尚无分子诊断方法用于中重度SSTI的快速检测产品问世,急需开展相关研究。
根据我院近5年来软组织感染的细菌谱,并结合其他学者的研究发现,金黄色葡萄球菌、表皮葡萄球菌、铜绿假单胞菌、屎肠球菌、粪肠球菌、大肠埃希菌、阴沟肠杆菌、肺炎克雷伯菌和鲍曼不动杆菌等9种细菌是临床软组织感染最常见的病原体,合计占全部病原体的90%以上[16]。故我们在实验中选取这9种细菌,展开相关分子病原学研究。我们选取的50例患者中,常规培养阳性共38例,而这9种细菌共27例,仅占71.1%,说明这9种细菌虽然可以覆盖大部分的常见致病菌,但仍存在覆盖不足的问题,后期研究应扩大分子病原学研究的菌种范围。
涂片的敏感性较低,低于常规培养及分子检测,不宜作为早期病原体鉴定的可靠检查方法,仅可以作为补充检测手段。虽然目前常规培养是感染诊断的金标准,但其本身仍具有很大的缺陷,包括标本采集情况、培养条件的选择及不同种细菌直接的互相影响等,并不总能真实的反映感染病原体的情况。在实验中为了提高阳性率,虽然我们采用了取组织块研磨培养等方法,但是总体的培养阳性率并不高,仅为76.0%,可能还需要进一步改善取材方法及检验方法。最终入组进行对比研究的39例患者中,分子检测与常规培养的阳性率大致相当,二者的完全符合率为82.1%,具有较高的符合程度。部分符合率7.7%,均为分子检测结果为多种细菌感染,而培养结果仅为单一细菌,说明对于复杂的复合菌感染的病原学诊断,分子检测手段具有一定的优势。
比较实验中常规培养及分子检测两种检测方法结果的差异,主要有三类情况:首先,分子检测结果为多种细菌感染,而培养结果仅为单一细菌者 3 例。其原因可能为在复合菌感染的情况下,常规培养时,不同细菌相互之间有抑制作用,不能形成优势菌群生长,而分子检测并不受这种因素的影响,只要标本中存在细菌核酸,即能检测出对应细菌。其次,分子检测结果为阳性而培养结果为阴性者 2 例,细菌分别为大肠埃希菌及金黄色葡萄球菌,以上两种差异体现了分子检测方法对常见致病菌和复合菌感染敏感性高于普通细菌培养。第三,分子检测结果为阴性而培养结果为阳性者 2 例,细菌均为表皮葡萄球菌,因为表皮葡萄球菌为正常定植菌,广泛存在于自然界中,不除外取材或转移过程中有污染可能,从而导致的假阳性出现,但也不能除外是由本研究中分子检测手段的缺陷导致的假阴性可能,需要增加样本量后进一步评估。
综上所述,本研究显示分子检测技术与常规培养等方法相比较具有很高的一致性,在复合菌感染检出方面有一定的优势。
[参考文献]
[1] McClain SL, Bohan JG, Stevens DL. Advances in the medical management of skin and soft tissue infections[J]. BMJ, 2016, 355: i6004.
[2] Walsh TL, Chan L, Konopka CI, et al. Appropriateness of antibiotic management of uncomplicated skin and soft tissue infections in hospitalized adult patients[J]. BMC Infect Dis, 2016, 16(1): 721.
[3] Tuttle MS, Mostow E, Mukherjee P, et al. Characterization of bacterial communities in venous insufficiency wounds by use of conventional culture and molecular diagnostic methods[J]. J Clin Microbiol, 2011, 49(11): 3812-3819.
[4] Stevens DL, Bisno AL, Chambers HF, et al. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2014, 59(2): e10-e52.
[5] Singh A, Goering RV, Simiee S. Application of molecular techniques to the study of hospital infection[J].Clin Microbiol Rev, 2006, l9(3): 512-530.
[6] Stevens DL, Bisno AL, Chambers HF, et al. Practice guidelines for the diagnosis and management of skin and soft-tissue infections[J]. Clin Infect Dis, 2005, 41(10): 1373-1406.
[7] Burnham JP, Kirby JP, Kollef MH. Diagnosis and management of skin and soft tissue infections in the intensive care unit: a review[J]. Intensive Care Med, 2016, 42(12): 1899-1911.
[8] Putnam LR, Richards MK, Sandvall BK, et al. Laboratory evaluation for pediatric patients with suspected necrotizing soft tissue infections: a case-control study[J]. J Pediatr Surg, 2016, 51(6): 1022-1025.
[9] Pruesse E, Quast C, Knittel K, et al. SILVA: a comprehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB[J]. Nucleic Acids Res, 2007, 35(21): 7188-7196.
[10] Gallo PH, Melton-Kreft R, Nistico L, et al. Demonstration ofBacilluscereusin orthopaedic-implant-related infection with use of a multi-primer polymerase chain reaction-mass spectrometric assay: report of two cases[J]. J Bone Joint Surg Am, 2011, 93(15): e85.
[11] Assih M, Feteke L, Bisseye C, et al. Molecular diagnosis of the human immunodeficiency, hepatitis B and C viruses among blood donors in Lomé (Togo) by multiplex real time PCR[J]. Pan Afr Med J, 2016, 25: 242.
[12] Yang L, Li M, Du F, et al. A Novel Colorimetric PCR-based biosensor for detection and quantification of hepatitis B virus[J]. Methods Mol Biol, 2017, 1571: 357-369.
[13] Rudkjøbing VB, Thomsen TR, Xu Y, et al. Comparing culture and molecular methods for the identification of microorganisms involved in necrotizing soft tissue infections[J]. BMC Infect Dis, 2016, 16(1): 652.
[14] Rhoads DD, Wolcott RD, Sun Y, et al. Comparison of culture and molecular identification of bacteria in chronic wounds[J]. Int J Mol Sci, 2012, 13(3): 2535-2550.
[15] Rudkjøbing VB, Aanaes K, Wolff TY, et al. An exploratory study of microbial diversity in sinus infections of cystic fibrosis patients by molecular methods[J]. J Cyst Fibros, 2014, 13(6): 645-652.
[16] 侯芳, 李耘, 李湘燕.卫生部全国细菌耐药监测网2010年门诊来源细菌耐药监测[J].中国临床药理学杂志, 2011, 27(12):899-904, 912.
