右旋雷贝拉唑钠的制备工艺改进
2018-07-02张春来罗宏军李国贤顾国庆
张春来,罗宏军*,姜 琦,李国贤,顾国庆,张 杰
(1扬子江药业集团有限公司,泰州 225321;2江苏海慈生物药业有限公司,泰州 225321)
右旋雷贝拉唑钠(dexrabeprazole sodium,1),化学名R-(+)-2-[[[4-(3-甲氧基丙氧基)-3-甲基-2-吡啶基]甲基]亚硫酰基]-1H-苯并咪唑钠盐,是一种质子泵抑制剂(PPI),由印度Emcure公司研发,于2007年在印度上市。PPI在治疗胃溃疡、十二指肠溃疡、反流性食管炎、幽门螺旋杆菌感染等与胃酸分泌失调有关的疾病效果最显著[1-2]。雷贝拉唑钠作为第二代PPI,是亲脂性的弱碱性化合物,其pKa在目前所知PPI中最高,并且雷贝拉唑钠具有多个结合靶点,因此,雷贝拉唑钠具有起效快、药效持久、安全性高等特点,比其他PPIs抑制胃酸起效更快[3-4]。右旋雷贝拉唑钠为雷贝拉唑钠右旋体,与消旋体及左旋雷贝拉唑钠相比,具有使用剂量小、受体选择性和生物利用度好、作用效果强、血浆蛋白结合率高及不良反应低等特点[5-6]。
目前制备右旋雷贝拉唑钠的方法有两种:一是采用手性拆分试剂对消旋体雷贝拉唑进行手性拆分[7-9],此方法难以获得高纯度的光学异构体,并且会浪费一半以上的雷贝拉唑原料;二是采用不对称氧化的方法,即使用手性氧化试剂或者手性催化剂不对称氧化制备单一雷贝拉唑的光学对映体。例如使用10-樟脑氧氮杂环丙烷(DBU)作为手性氧化试剂可以选择性氧化硫醚化物为手性亚砜化物,具有很高的反应性和对映选择性[10],但所得到最终产物ee值并不高;使用钛酸四异丙酯和L-酒石酸二乙酯作为手性催化剂对硫醚不对称氧化是目前制备右旋雷贝拉唑最常用的方法[11-14],但是该方法常用氨水后处理,制备工艺繁琐复杂,消耗大量物料,成本代价大,生产周期长。
本研究采用手性催化剂不对称氧化的合成方法,对文献中的工艺进行改进,针对上述问题优化反应条件和处理工艺,简化操作步骤,更改成盐工艺,提高产品收率和纯度,产品质量满足药物申报要求,工艺符合工业化生产要求。本研究以市售的2-[[[4-(3-甲氧基丙氧基)-3-甲基吡啶-2-基]甲基]硫代]-1H-苯并咪唑(3)为起始原料,钛酸四异丙酯、L-酒石酸二乙酯为手性配位催化剂,加入N,N-二异丙基乙胺、过氧化氢异丙苯对其进行不对称氧化,得到右旋雷贝拉唑(2),后经精制合格后与氢氧化钠成盐得到右旋雷贝拉唑钠(1),整个工艺共3步,总收率79%,产品经HPLC检测[15],纯度99.5%以上,工艺路线如图1所示。
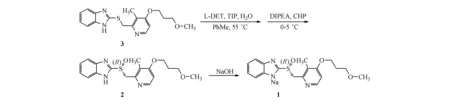
Figure1Synthetic route of compound dexrabeprazole sodium (1)
1 实验部分
1.1 仪器与试剂
熔点使用MP90型数字熔点仪(瑞士MettlerToledo公司);HPLC纯度使用Agilent 1260型高效液相色谱仪(美国Agilent公司);质谱使用LC-IT-TOF-MS型液相色谱串联质谱仪(日本Shimadzu公司);核磁共振谱使用AV-300型超导核磁共振仪(德国Bruker公司)。
2-[[[4-(3-甲氧基丙氧基)-3-甲基吡啶-2-基]甲基]硫代]-1H-苯并咪唑(3)(盐城浩华有机化工有限公司,含量:99.58%,批号:LBSHW-20140701H);钛酸四异丙酯(南京品宁偶联剂有限公司,批号:20140927)、L-酒石酸二乙酯(成都丽凯手性技术有限公司,含量:99.62%,ee:99.96%,批号:1310001);N,N-二异丙基乙胺(南京奇可医药化工有限公司,含量:99.6%,批号:140507);过氧化氢异丙苯(泰兴市润源化工材料有限公司,含量:83.3%,批号:20141225);其他所用溶剂和试剂均为市售分析纯。
1.2 工艺改进
1.2.1 右旋雷贝拉唑(2)的合成 2-[[[4-(3-甲氧基丙氧基)-3-甲基吡啶-2-基]甲基]硫代]-1H-苯并咪唑(137.4 g,0.4 mol)悬浮于甲苯1 500 mL中,加入L-酒石酸二乙酯(49.6 g,0.24 mol),钛酸四异丙酯(34.0 g,0.12 mol),纯化水(0.92 g,0.05 mol),升温至50~55 ℃,保温搅拌1 h成酒红色透明溶液。停止加热降温至30 ℃,加入N,N-二异丙基乙胺(15.5 g,0.12 mol),继续降温至0 ℃,析出大量白色固体,缓慢滴加过氧化氢异丙苯(88.1 g,0.48 mol),(0±3)℃保温反应12 h,TLC监控反应无原料(展开剂:甲醇-二氯甲烷,1∶10)。向反应体系中加入5%氢氧化钠水溶液1 500 mL,搅拌30 min,静置,过滤出不溶物,分出水相。水相用甲苯(300 mL×3)洗涤后,过滤出水相中少量不溶物,降温至15 ℃以下,补加纯化水1 500 mL,用冰醋酸约40 mL调节水相pH至7~8,析出大量白色固体,体系呈黏稠浆状,在此温度下析晶2 h,抽滤,滤饼用纯化水(200 mL×3)洗涤,抽干得到湿重白色右旋雷贝拉唑(2)354.4 g,HPLC纯度:95.8%。
1.2.2 右旋雷贝拉唑(2)的精制 将上述得到的固体室温下溶解于丙酮550 mL中,溶液呈黄色透明状,向体系中加入氢氧化钠0.2 g,降温至15 ℃左右,在此温度下滴加纯化水1 600 mL,体系析出大量白色固体,析晶4 h,抽滤,得到白色右旋雷贝拉唑精品316.3 g,mp:98~101 ℃(文献mp:98~101 ℃[16]),HPLC纯度检测99.6%。
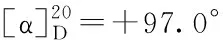
2 结果与讨论
在不对称氧化过程中,通过对反应温度、时间、氧化剂过氧化氢异丙苯用量进行优化,可以控制反应过程中两种主要杂质氧化杂质砜和起始物料硫醚的含量在2%以下。当氧化温度为-3~3 ℃时,砜杂质含量可控制在最低值。文献报道氧化温度在20 ℃以上[12-14],虽然缩短反应时间,但是砜杂质含量大大升高,在此温度下反应12 h,硫醚和砜的含量改变不大。氧化剂用量经过优化后发现为起始物料的1.2倍时可使硫醚反应完全,并且砜杂质的含量控制在2%以下。
氧化反应后处理过程中,文献报道均采用氨水萃取3次[11-12],本工艺使用5%氢氧化钠溶液与反应液等体积淬灭后,萃取1次即可,HPLC对甲苯相进行检测发现含有少量产品和原料,且容易分层,并没有出现大量絮状沉淀影响分层的现象发生,仅有少量钛盐沉淀生成,对反应液过滤处理即可很好分层。水相用冰醋酸调节pH为7~8即会析出大量白色雷贝拉唑,产品性状好、含量较高。此步骤避免了氨水的大量使用,节省生产成本,降低对环境的损害,省去使用有机溶剂对水相二次萃取过程,大大减少了产品氧化的可能性。
目前右旋雷贝拉唑粗品的精制方法鲜有报道[12],且精制方法复杂,使用了氨水萃取和乙酸调节pH等操作。本工艺仅在丙酮-水体系下即可完成精制,且可将杂质砜含量降至0.1%以下。
文献中右旋雷贝拉唑制备工艺均进行干燥处理[11-14],但右旋雷贝拉唑不稳定,在室温以上环境中放置时各个杂质含量均增大,右旋雷贝拉唑含量大大降低,且性状由白色固体变成黑色油状物。本工艺在右旋雷贝拉唑制备和精制过程中无需进一步干燥,直接投入下一步反应。
右旋雷贝拉唑在丙酮体系中成盐,在此均相体系中成盐完全,加入甲基叔丁基醚后析出钠盐。文献[12]在成盐时采用高沸点溶剂甲基异丁基酮和乙腈,烘干时不易去除;文献[13-14]皆在非均相体系中成盐,致使成盐不完全,文献[17-19]均为晶型制备专利,在成盐过程中需要加热处理,而杂质砜在加热时含量升高,使得产品不稳定。本工艺在均相体系下室温成盐,10 ℃以下析晶得到产品,工艺稳定,可有效控制最终产品的纯度。
总之,本研究对右旋雷贝拉唑钠合成工艺进行优化,产品收率79%,文献报道的收率为53.4%,经HPLC检测纯度99.6%,符合药品申报要求,产品经NMR、IR、元素分析、LC-MS确证其结构。改进后的工艺稳定,反应容易控制,操作步骤简单,大大降低生产成本,适合工业化生产。
参 考 文 献
[1] Tytgal GNJ.Shortcomings of the first-generation proton pump inhibitors[J].EurJGasttroenterolHapatol,2001,13(S1):29-33.
[2] Kawakami Y,Akahane T,Yamaguchi M,et al.Invitroactivities of rebeprazole,a novel proton pump inhibitor and its thioether derivative alone and combination with other antimicrobials against recent clinical isolates of helicobacter pylori[J].AntimicrobAgentsChemother,2000,44(2):458-461.
[3] Robinson M.Review article:pH,healing and symptom relief with rabeprazole treatment in acid-related disorders[J].AlimentPharmacolTher,2004,20(S6):30-37.
[4] Carswell CI,Goa KL.Rabeprazole:an update of its use in acid-related disorders[J].Drugs,2001,61(15):2327-2356.
[5] Pai V,Pai N.Randomized,double-blind,comparative study of dexrabeprazole 10 mg versus rabeprazole 20 mg in the treatment of gastroesophageal reflux disease[J].WorldJGastroenterol,2007,13(30):4100-4102.
[6] Zhang HT,Qi X.Micronucleus test of the right-handed rabeprazole sodium in mice[J].JPharmRes(药学研究),2014,33(7):384-385.
[7] Lennart LP,Sverker VU.Optically pure salts of pyridinylmethyl sulfinyl-1H- benzimidazole compounds:CA,2139653[P].1994-12-08.
[8] Su XX.Preparation method for optical pure rebeprazole:CN,101343266A[P].2009-01-14.
[9] Erik LM,Jan SU,Henrik S,etal.Process for synthesis of substtuted sulphoxides:WO,9602535[P].1996-02-01.
[10] Mahale RD,Rajput MR,Maikap GC,etal.Davis oxaziridine-mediated asymmetric synthesis of proton pump inhibitors using dbu salt of prochiral sulfide[J].OrgProcessResDev,2010,14(14):1264-1268.
[11] Rao DR,Kankan RN,Pathi SL,etal.Salts and polymorphs of dexrabeprazole:WO,2011161421[P].2011-12-29.
[12] Qin Y,Zhao W,Jin C,etal.Preparation methods of optically pure rabeprazole and sodium salt thereof:CN,104418841A[P].2015-03-18.
[13] Tan SZ,Li PJ,Liu XY.Preparation method of right-handed rabeprazole sodium monohydrate crystal:CN,104327049A[P].2015-02-04.
[14] Cai H,Liu AM,Yi SY,etal.Method for synthesizing rabeprazole sodium:CN,104311540A[P].2015-01-28.
[15] Song L,Yu GX.Dexrabeprazole sodium monohydrate crystal form and preparation method thereof:CN,104031030A[P].2014-09-10.
[16] Liu L.The synthesis study ofR-(+)-rabeprazol sodium salt(右旋雷贝拉唑钠的合成研究)[D].Changsha:Hunan University of Chinese Medicine,2013.
[17] Zhang Y,Chen P,Tan SZ.Determination of the content ofR-rabeprazole sodium by high performance liquid chromatography[J].GuangdongChemInd(广东化工),2015,42(2):122-123.
[18] Liu FW,Li W,Yu XF,etal.Dexrabeprazole sodium monohydrate crystal form and preparation method thereof:CN,102924434A[P].2013-02-13.
[19] Xu ZZ,Li DG,Zhao YH,etal.Novel crystal form ofR-rabeprazole sodium hydrate,preparation method and application thereof:CN,103113350A[P].2013-05-22.
