中药有效成分防治骨性关节炎的研究进展
2018-07-02张媛媛陈正东薛漓轩余伯阳寇俊萍
韩 晗,张媛媛,潘 立,陈正东,薛漓轩,余伯阳,寇俊萍*
(中国药科大学 1江苏省中药评价与转化重点实验室;2中药学院,南京 211198)
骨性关节炎(osteoarthritis,OA)是一种慢性退行性骨关节疾病,其主要病理特征包括关节软骨破坏、滑膜炎症、骨赘形成、软骨下骨增厚及软骨细胞凋亡[1]。OA的病因涉及多种因素,年龄增加、机械负荷、遗传、肥胖、性激素等多方面因素均可能参与[2]。随着社会人口老龄化的加剧,OA已成为中老年群体中最常见的关节疾病,其致残率高达53%,严重影响中老年人的健康和生活质量。目前临床上用于OA治疗的药物主要有非甾体类抗炎药(NSAIDs)和镇痛药等。这些药物虽可以改善OA症状,但不能逆转OA的发展并伴有不可忽视的不良反应,如长期服用NSAIDs会引发卒中、上消化道溃疡出血,以及破坏软骨细胞等[3]。尤其是对于老年患者,更是增加了心血管和胃肠道的双重风险。近年来,中药有效成分在防治OA的研究方面取得了很多进展,现就近五年中药有效成分防治OA的作用机制研究进展予以综述,以期为OA的新药研发提供一定的参考依据和线索。
1 中药抑制炎症相关因子的分泌
炎症细胞因子如白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)在OA的发病机制中起关键作用。在病理状态下,炎症细胞因子可以激活NF-κB等信号通路,诱导细胞分泌过量的基质金属蛋白酶(matrix metalloproteinase,MMPs),造成软骨细胞外基质的过度降解,使关节软骨逐渐出现软化、剥脱、缺失等一系列退行性病变[4]。
许多中药有效成分可以下调OA模型中炎症细胞因子的水平,延缓软骨退变,是潜在的OA治疗药物。研究表明,迷迭香酸(50,100 μmol/L)、桃叶珊瑚苷(1,10,20,50 μmol/L)、白花丹素(2,5,10 μmol/L)及和厚朴酚(2.5,5,10 μmol/L)可以通过抑制NF-kB信号通路的激活,下调MMPs、一氧化氮合酶(iNOS)、一氧化氮(NO)和前列腺素E2(PGE2)等生成,抑制IL-1β刺激下软骨细胞外基质降解,发挥抗炎作用[5-8]。人参皂苷Rg1(1,10 μg/mL)通过抑制IL-1β诱导的人OA软骨细胞中炎症介质环氧合酶-2(COX-2)和PGE2的分泌发挥抗炎作用,并且连续灌胃给予Rg1(30,60 mg/kg)8周可以阻止前交叉韧带切除术(ACLT)诱导的OA大鼠中Ⅱ型胶原和聚集蛋白聚糖降解[9]。
远志皂苷元在2,4,8 μmol/L浓度时通过下调PI3K/Akt/NF-κB信号通路减轻IL-1β介导的人OA软骨细胞中NO、PGE2和MMPs的释放,抑制炎症反应的进行[10]。龙胆苦苷(50,500,1 500 μg/mL)及黄芩素(5,25,50 μmol/L)通过下调MAPK信号通路抑制IL-1β刺激的软骨细胞中MMPs的释放。此外,通过关节腔内注射黄芩素(5,25,50 μmol/L)也可以改善ACLT诱导的兔OA模型的软骨损伤[11-12]。体外给予隐丹参酮(5,10,20 μmol/L)和黄芪苷(20,40,80 μg/mL)可以通过下调NF-κB及MAPK信号通路抑制IL-1β刺激下人OA软骨细胞炎症介质的释放,除此之外,黄芪苷还能够通过激活过氧化物酶体增殖物激活受体(PPAR-γ)延缓OA进程[13-14]。
天然的多酚类化合物白藜芦醇(12.5,100 μmol/L)通过抑制TLR4/MyD88/NF-кB信号通路的活化对IL-1β诱导的人OA软骨细胞发挥抗炎作用[15]。腹腔注射25 mg/kg表没食子儿茶素没食子酸酯(EGCG)可降低半月板切除术(DMM)诱导的OA小鼠中IL-1β、TNF-α及MMPs的分泌,并上调MMPs的抑制基因Cbp/p300相互作用反式激活因子2(Cited2)的表达[16]。体外给予淫羊藿苷(20 μmol/L)及关节腔注射淫羊藿苷(20 μmol/L)可通过抑制MAPK及Wnt/β-catenin信号通路降低MMP-13的上调,发挥抗软骨退变的作用[17]。在IL-1β刺激的大鼠软骨细胞中,花姜酮(4 μmol/L)可抑制COX-2、MMP-13的表达,同时经口给予5 mg/kg 花姜酮1周可减轻碘乙酸钠(MIA)诱导的OA大鼠膝关节肿胀,说明其具有潜在的软骨保护活性[18]。
2 中药改善软骨基质合成及分解代谢失衡
关节软骨细胞外基质(extracellular matrix,ECM)在调节软骨细胞代谢和功能中起着至关重要的作用。ECM主要由Ⅱ型胶原和蛋白聚糖(Aggrecan 为主)组成,其形成了保护并支持软骨细胞的细胞外纤维网架,当ECM成分及结构变化时会导致软骨基质微环境的改变,从而推动了软骨基质代谢不平衡,最终导致软骨破坏[19]。研究表明鹰嘴豆芽素A(5,15,25,50 μmol/L)通过抑制p65的核转位可有效的减少IL-1β刺激下大鼠软骨细胞中MMPs表达增加,同时膝关节腔注射鹰嘴豆芽素A(5,50 μmol/L)可减轻ACLT诱导的兔OA模型中软骨降解,改善软骨基质的分解代谢失衡[20-21]。甘草查耳酮A(5,10 μmol/L)通过调节NF-κB和Wnt/β-catenin信号通路抑制IL-1β刺激引起的大鼠软骨细胞中MMPs、ADAMTS的表达,同时促进ECM中Ⅱ型胶原的合成,对OA有潜在的治疗意义[22]。α-倒捻子素(2.5,5 μg/mL)同样通过抑制NF-κB信号通路的激活降低MMPs的上调,同时腹腔注射α-倒捻子素(10 mg/kg)可促进DMM大鼠软骨基质中Ⅱ型胶原和蛋白聚糖的合成,发挥抗软骨代谢失衡的作用[23]。体外给予小檗碱(50 μmol/L)或膝关节腔注射小檗碱(14 μg/kg)可通过激活Akt/p70S6K/S6通路上调Ⅱ型胶原和蛋白聚糖的表达水平,对软骨具有保护作用[24]。人参皂苷Rb1通过下调Notch信号通路干预MMP-13表达,促进Ⅱ型胶原的分泌,从而调节基质的合成分解代谢失衡[25]。
补骨脂甲素(5,10 μmol/L)、水晶兰苷(50,100 μg/mL)、蛇床子素(6.25,12.5,25 μmol/L)可通过上调大鼠软骨细胞中Ⅱ型胶原和蛋白聚糖的表达来促进细胞外基质合成,同时抑制MMPs的表达以减少基质降解,其有效的促合成性质可能在防治OA疾病中发挥重要作用[26-28]。在TNF-α刺激的人软骨细胞中,松属素(10,20,50 μmol/L)通过抑制p65的核转位及IκBα降解,下调MMPs的表达,从而抑制软骨基质降解,发挥软骨保护作用[29]。
3 中药抑制氧自由基损伤及软骨细胞凋亡
氧化应激损伤导致软骨细胞凋亡与OA发病机制密切相关。在病理情况下,OA患者的关节滑液可产生过量的活性氧(ROS),在诱发细胞凋亡的同时加速软骨基质的降解,可引起关节软骨变薄,关节下骨增厚最终导致软骨损伤[30]。因此,抑制氧自由基损伤及软骨细胞凋亡,是防治OA的关键途径之一。许多中药的有效成分可延缓软骨细胞的凋亡,发挥软骨保护作用。汉黄芩素(10,25,50 μmol/L)、6-姜酚(2,5,10 μmol/L)不仅可以抑制人OA软骨细胞中炎症介质NO、PGE2等的表达,还通过激活Nrf2信号通路,诱导Nrf2核转位与抗氧化反应元件(ARE)结合,发挥抗氧化作用[31-32]。续断皂苷(50,100 μg/L)可抑制兔OA软骨细胞中促凋亡蛋白Bax、caspase-3、caspase-9活力,促进抑凋亡蛋白Bcl-2表达从而抑制细胞凋亡[33]。人参皂苷Ro(50,100,200 μmol/L),Rg1(10 μg/mL)通过抑制凋亡相关蛋白Bax 、Bad水平及caspase-3活力,抑制IL-1β诱导的大鼠软骨细胞凋亡,其中Rg1主要是通过激活PI3K/Akt信号通路发挥抗凋亡作用[34-35]。
研究表明,NO供体硝普钠(SNP)所衍生的ROS可以通过内源性凋亡途径参与软骨细胞凋亡。白藜芦醇(100 μmol/L)已被证明能够清除SNP诱导的ROS产生,抑制兔软骨细胞凋亡[36]。使用原子力显微镜(AFM)观察可得,白藜芦醇(100 μmol/L)能够有效地抑制SNP诱导的兔软骨细胞变化,包括收缩、变圆、板状伪足收缩和细胞骨架聚集,细胞间黏附减少,细胞骨架蛋白如F-actin和α-tubulin的表达降低等,从而抑制细胞凋亡[37]。另有研究证明,白藜芦醇(10 μmol/L)可以通过激活Sirt1的表达,降低Bax和procaspase-3表达水平,从而抑制人OA软骨细胞凋亡[38]。小檗碱(25,75 μmol/L)通过激活AMPK和抑制p38 MAPK信号通路,下调iNOS和caspase-3的表达,增加Bcl-2/Bax比率,从而逆转SNP诱导的大鼠细胞骨架重塑和软骨细胞凋亡[39]。
在细胞因子、机械刺激等诱导下,关节软骨会产生过量的ROS,而过氧化氢(H2O2)作为ROS的主要成分,能自由穿过细胞膜引起一系列损伤,诱发软骨细胞的凋亡。研究表明,黄芩苷(100 μmol/L),桃叶珊瑚苷(100 μmol/L)可以显著降低Bax,caspase-3水平,从而抑制H2O2介导的大鼠终板软骨细胞及猪软骨细胞凋亡,发挥软骨保护作用[40-41]。芦丁(10 μg/mL)通过激活Sirt1抑制H2O2介导的大鼠软骨细胞中MAPK,NF-κB信号通路的上调,抑制ROS、LDH、iNOS、COX-2、PGE2等表达,发挥抗炎,抗氧化作用[42]。体外实验表明当归多糖(5,25,125 μg/mL)可以显著抑制MDA水平以及IL-1β、TNF-α的表达,保护H2O2诱导的大鼠软骨细胞氧化应激损伤[43]。
4 中药促进软骨细胞增殖
在OA的发病进程中,软骨细胞增殖缓慢也可能是加速OA进展的重要因素。因此,促进软骨细胞增殖也是防治OA的机制之一,许多中药的有效单体成分可促进软骨细胞增殖。多糖类中药有效成分牛膝多糖(100,200 μg/mL)、狗脊多糖(100,200,400 μg/mL)通过促进G1/S细胞周期转变,上调细胞周期蛋白依赖性激酶4(CDK4)、细胞周期蛋白D1(Cyclin D1)以及Ⅱ型胶原等的表达,促进大鼠软骨细胞的增殖[44-45]。
SOX9是在软骨形成中发挥重要作用的一个早期转录因子,对于关节软骨的维持和修复都是不可或缺的,在OA的发病进程中,SOX9的下调会抑制软骨的形成。原儿茶酸(62.5,125,250 μmol/L)、补骨脂素(1,10,100 μmol/L)可以促进Ⅱ型胶原、蛋白聚糖和SOX9的表达,以维持细胞表型并促进软骨细胞增殖[46-47]。同时,补骨脂素(1,10,100 μmol/L)还可以通过激活Wnt/β-catenin信号通路,上调Wnt-4、Frizzled-2、β-catenin、Cyclin D1的表达,促进软骨细胞的增殖,其可能在OA的治疗中发挥重要作用[48]。
5 中药上调雌激素水平
近些年的研究表明,绝经后的妇女,其OA发病率显著高于男性,且程度也更为严重。鉴于雌激素受体主要表达在骨组织中且雌激素在骨骼发育中有着重要作用,不难推测内源性的雌激素减少可能是OA的发病因素之一。目前一些中药有效成分被证明具有雌激素样作用,其可以通过调节体内雌激素水平从而对OA有治疗作用。雌激素类似物β-蜕皮甾酮(50,100,200 μmol/L)通过抑制NF-κB通路的激活减少caspase-3、Bax、p53磷酸化水平,并促进Bcl-xL的表达,下调MMP-3、MMP-9、COX-2的水平以阻止IL-1β诱导的大鼠软骨细胞凋亡和炎症反应[49]。植物类雌激素香豆雌酚(10 μmol/L)可以抑制IL-1β诱导的大鼠软骨细胞中MMPs的上调以及COX-2、PGE2等炎症介质的表达,发挥抗炎,抗分解代谢作用[50]。
6 结语和展望
以上研究表明,运用中药有效成分治疗OA具有一定的科学依据,其在动物实验及细胞实验中已得到证实:中药有效成分能通过调节多条与OA相关的信号通路和受体抑制炎症相关因子分泌、改善软骨基质合成及分解代谢失衡、抑制软骨细胞凋亡并促进细胞增殖、上调雌激素水平等发挥防治OA的作用,其相关作用途径及机制归纳如图1和表1所示。
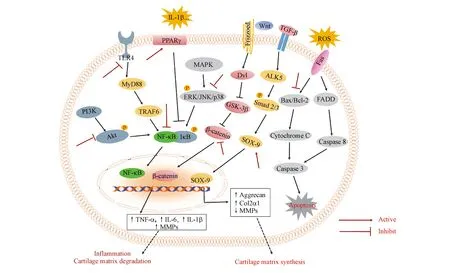
图1中药有效成分防治OA作用机制示意图
表1 中药有效成分防治OA作用机制

类别 成分 动物/细胞系作用机制文献黄酮类黄芩素人OA软骨细胞/ACLT兔↓p38/ERK,↓MMPs[12]黄芪苷人OA软骨细胞↓NF-κB/MAPK,↑PPAR-γ[14]淫羊藿苷人软骨瘤细胞/ACLT大鼠↓MAPK,↓Wnt/β-catenin[17]鹰嘴豆芽素A大鼠软骨细胞/ACLT兔↓MMPs,↓ADAMTS5,↑TIMP-1[20-21]甘草查耳酮A大鼠软骨细胞↓PGE2,↓COX-2,↓NF-κB[22]

(续表)
目前中药有效成分可通过调节MAPK、NF-κB、Wnt/β-catenin、PI3K/Akt等信号通路以及PPAR-γ等受体延缓OA进程。其中以黄酮类、萜类、皂苷类、醌类、多酚类、多糖类、香豆素类、生物碱类、甾体类成分居多。黄酮类、萜类、醌类中药有效成分主要通过抑制MAPK/NF-κB信号通路,抑制炎症介质的分泌和MMPs/TIMPs的相对失衡,并提高Ⅱ型胶原和蛋白聚糖的合成,从而发挥抗炎、抗ECM合成及分解代谢失衡的作用,其中黄酮类化合物还可以通过激活PPAR-γ受体进一步抑制炎症因子的产生。皂苷类、生物碱类化合物主要通过调节PI3K/Akt等信号通路,上调Bcl-2/Bax比率发挥抗软骨细胞凋亡的作用。多酚类化合物可以通过抑制MAPK和TLR4/MyD88/NF-κB信号通路抑制炎症介质的表达,同时还可抑制ROS的产生,发挥抗炎、抗氧化的药理活性。多糖类、香豆素类化合物主要通过激活Wnt/β-catenin信号通路促进G1/S细胞周期转变,上调CDK4、Cyclin D1等的表达,发挥促进软骨细胞增殖的作用。本课题组前期研究表明,从中药提取得到的皂苷类有效成分可通过抑制MAPK/NF-κB等信号通路的激活,抑制H2O2介导的软骨细胞凋亡和ECM降解,同时体内研究证实了皂苷类有效成分可通过减轻OA大鼠关节内的炎症反应,改善软骨组织病理状态等发挥一定的软骨保护效应,本研究也为今后进一步研制开发抗OA的中药有效成分提供基础。
综上所述,中药有效成分防治OA的作用机制研究渐趋明朗,但目前仍存在一些问题:某些治疗OA的中药其安全性和有效性仍然存在矛盾和不确定性,需要临床进一步确证;某些中药有效成分的机制探索重复试验较多,指标水平不高,研究方法也仅仅停留在通过Western blot技术考察相关蛋白的表达,研究不够深入;基因表达谱技术在中药对OA的调控作用研究中得到越来越多的应用,但很多差异表达基因尚不明确;一些传统的中药复方成分复杂,中药有效成分之间存在复杂的相互作用,不利于进一步临床应用等。因此,今后在OA的研究中如何更好地将中医药理论与现代医学结合起来,结合实验研究和临床观察研究,并充分利用网络药理学、基因组学、蛋白组学等新兴药理研究方法,尽可能地进行定性、定量、客观研究,以指导临床用药,这些都是今后进一步开展中药有效成分防治OA的作用机制研究需要思考的问题。
参 考 文 献
[1] Loeser RF,Goldring SR,Scanzello CR,etal.Osteoarthritis:a disease of the joint as an organ[J].ArthritisRheum,2012,64(6):1697-1707.
[2] Blagojevic M,Jinks C,Jeffery A,etal.Risk factors for onset of osteoarthritis of the knee in older adults:a systematic review and meta-analysis[J].OsteoarthritisCartilage,2010,18(1):24-33.
[3] Mobasheri A.The future of osteoarthritis therapeutics:targeted pharmacological therapy[J].CurrRheumatolRep,2013,15(10):1-13.
[4] Troeberg L,Nagase H.Proteases involved in cartilage matrix degradation in osteoarthritis[J].BiochimBiophysActa,2012,1824(1):133-145.
[5] Chen WP,Jin GJ,Xiong Y,etal.Rosmarinic acid down-regulates NO and PGE2 expression via MAPK pathway in rat chondrocytes[J].JCellMolMed,2017,22(1):346-353.
[6] Wang SN,Xie GP,Qin CH,etal.Aucubin prevents interleukin-1 beta induced inflammation and cartilage matrix degradation via inhibition of NF-κB signaling pathway in rat articular chondrocytes[J].IntImmunopharmacol,2015,24(2):408-415.
[7] Zheng W,Tao Z,Chen C,etal.Plumbagin prevents IL-1β-induced inflammatory response in human osteoarthritis chondrocytes and prevents the progression of osteoarthritis in mice[J].Inflammation,2017,40(3):849-860.
[8] Chen YJ,Tsai KS,Chan DC,etal.Honokiol,a low molecular weight natural product,prevents inflammatory response and cartilage matrix degradation in human osteoarthritis chondrocytes[J].JOrthopRes,2014,32(4):573-580.
[9] Cheng W,Jing J,Wang Z,etal.Chondroprotective effects of ginsenoside Rg1 in human osteoarthritis chondrocytes and a rat model of anterior cruciate ligament transection[J].Nutrients,2017,9(3):263.
[10] Wang C,Zeng L,Zhang T,etal.Tenuigenin prevents IL-1β-induced inflammation in human osteoarthritis chondrocytes by suppressing PI3K/AKT/NF-κB signaling pathway[J].Inflammation,2016,39(2):807-812.
[11] Zhao L,Ye J,Wu GT,etal.Gentiopicroside prevents interleukin-1 beta induced inflammation response in rat articular chondrocyte[J].JEthnopharmacol,2015,172:100-107.
[12] Chen WP,Xiong Y,Hu PF,etal.Baicalein inhibits MMPs expression via a MAPK-dependent mechanism in chondrocytes[J].CellPhysiolBiochem,2015,36(1):325-333.
[13] Feng Z,Zheng W,Li X,etal.Cryptotanshinone protects against IL-1β-induced inflammation in human osteoarthritis chondrocytes and ameliorates the progression of osteoarthritis in mice[J].IntImmunopharmacol,2017,50:161-167.
[14] Ma Z,Piao T,Wang Y,etal.Astragalin inhibits IL-1β-induced inflammatory mediators production in human osteoarthritis chondrocyte by inhibiting NF-κB and MAPK activation[J].IntImmunopharmacol,2015,25(1):83-87.
[15] Liu L,Gu H,Liu H,etal.Protective effect of resveratrol against IL-1β-induced inflammatory response on human osteoarthritic chondrocytes partly via the TLR4/MyD88/NF-κB signaling pathway:an “invitrostudy”[J].IntJMolSci,2014,15(4):6925-6940.
[16] Leong DJ,Choudhury M,Hanstein R,etal.Green tea polyphenol treatment is chondroprotective,anti-inflammatory and palliative in a mouse posttraumatic osteoarthritis model[J].ArthritisResTher,2014,16(6):508.
[17] Zeng L,Wang W,Rong XF,etal.Chondroprotective effects and multi-target mechanisms of Icariin in IL-1 beta-induced human SW 1353 chondrosarcoma cells and a rat osteoarthritis model[J].IntImmunopharmacol,2014,18(1):175-181.
[18] Chien TY,Huang KH,Lee CJ,etal.Antinociceptive and anti-inflammatory effects of zerumbone against mono-iodoacetate-induced arthritis[J].IntJMolSci,2016,17(2):249.
[19] Gao Y,Liu S,Huang J,etal.The ECM-cell interaction of cartilage extracellular matrix on chondrocytes[J].BiomedResInt,2014,2014(2):648459.
[20] Wu DQ,Zhong HM,Ding QH,etal.Protective effects of biochanin A on articular cartilage:invitroandinvivostudies[J].BMCComplementAlternMed,2014,14(1):1-10.
[21] Oh JS,Cho IA,Kang KR,etal.Biochanin-A antagonizes the interleukin-1β-induced catabolic inflammation through the modulation of NF-κB cellular signaling in primary rat chondrocytes[J].BiochemBiophysResCommun,2016,477(4):723-730.
[22] Chen WP,Hu ZN,Jin LB,etal.Licochalcone A inhibits MMPs and ADAMTSs via the NF-κB and Wnt/β-catenin signaling pathways in rat chondrocytes[J].CellPhysiolBiochem,2017,43(3):937-944.
[23] Pan T,Wu D,Cai N,etal.Alpha-Mangostin protects rat articular chondrocytes against IL-1β-induced inflammation and slows the progression of osteoarthritis in a rat model[J].IntImmunopharmacol,2017,52:34-43.
[24] Zhao H,Zhang T,Xia C,etal.Berberine ameliorates cartilage degeneration in interleukin-1β-stimulated rat chondrocytes and in a rat model of osteoarthritis via Akt signalling[J].JCellMolMed,2014,18(2):283-292.
[25] Wang W,Zeng L,Wang ZM,etal.Ginsenoside Rb1 inhibits matrix metalloproteinase 13 through down-regulating Notch signaling pathway in osteoarthritis[J].ExpBiolMed,2015,240(12):1614-1621.
[26] Lee GJ,Cho IA,Kang KR,etal.Biological effects of the herbal plant-derived phytoestrogen bavachin in primary rat chondrocytes[J].BiolPharmBull,2015,38(8):1199-1207.
[27] Wang F,Wu L,Li L,etal.Monotropein exerts protective effects against IL-1β-induced apoptosis and catabolic responses on osteoarthritis chondrocytes[J].IntImmunopharmacol,2014,23(2):575-580.
[28] Du G,Song Y,Wei L,etal.Osthole inhibits proliferation and induces catabolism in rat chondrocytes and cartilage tissue[J].CellPhysiolBiochem,2015,36(6):2480-2493.
[29] Zhang D,Huang B,Xiong C,etal.Pinocembrin inhibits matrix metalloproteinase expression in chondrocytes[J].IUBMBLife,2015,67(1):36-41.
[30] Lepetsos P,Papavassiliou AG.ROS/oxidative stress signaling in osteoarthritis[J].BiochimBiophysActa,2016,1862(4):576-591.
[31] Khan NM,Haseeb A,Ansari MY,etal.Wogonin,a plant derived small molecule,exerts potent anti-inflammatory and chondroprotective effects through the activation of ROS/ERK/Nrf2 signaling pathways in human osteoarthritis chondrocytes[J].FreeRadicBiolMed,2017,106:288-301.
[32] Abusarah J,Benabdoun HA,Shi Q,etal.Elucidating the role of protandim and 6-gingerol in protection against osteoarthritis[J].JCellBiochem,2017,118(5):1003-1013.
[33] Li XR,Li J,Ren Q,etal.The molecular mechanism of treating osteoarthritis with dipsacus saponins by inhibiting chondrocyte apoptosis[J].ExpTherMed,2017,14(5):4527-4532.
[34] Zhang XH,Xu XX,Xu T.Ginsenoside Ro suppresses interleukin-1β-induced apoptosis and inflammation in rat chondrocytes by inhibiting NF-κB[J].ChinJNatMed(中国天然药物),2015,13(4):283-289.
[35] Huang Y,Wu D,Fan W.Protection of ginsenoside Rg1 on chondrocyte from IL-1β-induced mitochondria-activated apoptosis through PI3K/Akt signaling[J].MolCellBiochem,2014,392(1/2):249-257.
[36] Liang Q,Wang XP,Chen TS.Resveratrol protects rabbit articular chondrocyte against sodium nitroprusside-induced apoptosis via scavenging ROS[J].Apoptosis,2014,19(9):1354-1363.
[37] Jin H,Liang Q,Chen T,etal.Resveratrol protects chondrocytes from apoptosis via altering the ultrastructural and biomechanical properties:an AFM study[J].PLoSOne,2014,9(3):e91611.
[38] Liu S,Yang H,Hu B,etal.Sirt1 regulates apoptosis and extracellular matrix degradation in resveratrol-treated osteoarthritis chondrocytes via the Wnt/β-catenin signaling pathways[J].ExpTherMed,2017,14(5):5057-5062.
[39] Zhou Y,Liu SQ,Yu L,etal.Berberine prevents nitric oxide-induced rat chondrocyte apoptosis and cartilage degeneration in a rat osteoarthritis model via AMPK and p38 MAPK signaling[J].Apoptosis,2015,20(9):1187-1199.
[40] Pan Y,Chen D,Lu Q,etal.Baicalin prevents the apoptosis of endplate chondrocytes by inhibiting the oxidative stress induced by H2O2[J].MolMedRep,2017,16(3):2985-2991.
[41] Young IC,Chuang ST,Hsu CH,etal.Protective effects of aucubin on osteoarthritic chondrocyte model induced by hydrogen peroxide and mechanical stimulus[J].BMCComplementAlternMed,2017,17(1):91.
[42] Na JY,Song K,Kim S,etal.Rutin protects rat articular chondrocytes against oxidative stress induced by hydrogen peroxide through SIRT1 activation[J].BiochemBiophysResCommun,2016,473(4):1301-1308.
[43] Zhuang C,Xu NW,Gao GM,etal.Polysaccharide from angelica sinensis protects chondrocytes from H2O2-induced apoptosis through its antioxidant effects in vitro[J].IntJBiolMacromol,2016,87:322-328.
[44] Weng X,Lin P,Liu F,etal.Achyranthes bidentata polysaccharides activate the Wnt/β-catenin signaling pathway to promote chondrocyte proliferation[J].IntJMolMed,2014,34(4):1045-1050.
[45] Fu C,Zheng C,Lin J,etal.Cibotium barometz polysaccharides stimulate chondrocyte proliferationinvitroby promoting G1/S cell cycle transition[J].MolMedRep,2017,15(5):3027-3034.
[46] Luo L,Wei Q,Liu L,etal.Protocatechuic acid benefits proliferation and phenotypic maintenance of rabbit articular chondrocytes:aninvitrostudy[J].ExpTherMed,2015,9(5):1865-1870.
[47] Xu K,Pan X,Sun Y,etal.Psoralen activates cartilaginous cellular functions of rat chondrocytesinvitro[J].PharmBiol,2015,53(7):1010-1015.
[48] Zheng W,Lin P,Ma Y,etal.Psoralen promotes the expression of cyclin D1 in chondrocytes via the Wnt/β-catenin signaling pathway[J].IntJMolMed,2017,40(5):1377-1384.
[49] Zhang X,Xu X,Xu T,etal.β-Ecdysterone suppresses interleukin-1β-induced apoptosis and inflammation in rat chondrocytes via inhibition of NF-κB signaling pathway[J].DrugDevRes,2014,75(3):195-201.
[50] You JS,Cho IA,Kang KR,etal.Coumestrol counteracts interleukin-1β-induced catabolic effects by suppressing inflammation in primary rat chondrocytes[J].Inflammation,2017,40(1):79-91.
