肺动脉高压患者右心室-肺动脉耦合模型构建的研究
2018-07-02张长东田军尚小珂卢蓉柳梅刘义华王斌陈澍吴杰孙永峰李庚董念国
张长东 田军 尚小珂 卢蓉 柳梅 刘义华 王斌 陈澍 吴杰 孙永峰李庚 董念国
肺动脉高压(pulmonary arterial hypertension,PAH)与肺动脉系统压力升高有关,或起因于特发性病因,亦可能由其他情况所致。长期PAH导致右心室功能、结构及形态发生变化。若不及时加以治疗,最终会导致代偿失调的右心室功能衰竭,甚至死亡。近期以来,PAH的预后效果仍不理想,现有治疗措施一年内死亡率约为15%[1]。
虽然右心室功能是确定心肺功能的重要因素,但与左心室相比,右心室研究相对较少。具体而言,与左心室相比,右心室的力学性能尚未明确,唯一报道右心室力学数据的研究基于健康犬类[2–4]、牛类[5]和鼠类[6]等动物模型的离体实验。就PAH而言,目前仅有一项鼠类的肺动脉环缩术研究论述了右心室因形态重构而发生的力学与结构变化[7]。中国目前尚未有体内研究可以确定PAH对人右心室总体力学的影响。为增强对PAH的理解,本研究的总体目标在于量化体内研究的心室力学总体变化,探讨其与人体PAH的相关性。本研究利用病患计算模型实现此目标,所采用的患者数据包括34例PAH患者和5例对照组患者的左、右心室磁共振成像(magnatic resonance imaging,MRI)及侵入性压力数据。MRI数据涵盖心室畸形,适用于本研究。
1 对象与方法
1.1 研究对象
纳入2015年1月至2015年12月武汉亚洲心脏病医院160例疑似PAH患者。经过临床评估及心导管检查后,126例患者被排除,最终入选34例PAH患者。入选标准:根据2015年欧洲心脏病学会(ESC)PAH诊断与治疗指南,选择安静状态下右心导管检查测量肺动脉平均压≥25 mmHg(1 mmHg=0.133 kPa)的患者[1]。排除标准:合并冠心病、妊娠、不能行MRI以及纽约心脏病协会(NYHA)心功能Ⅳ级的患者。5例对照组为武汉亚洲心脏病医院招募的拟行卵圆孔未闭(patent foramen ovale,PFO)或者房间隔缺损(atrial septal defect,ASD,直径小于5 mm)患者,因反常栓塞需要行经皮导管介入封堵术,其心脏血流动力学与健康人相当。所有患者通过右心导管检查,根据肺动脉平均压分为三组:对照组(5例),肺动脉平均压<25 mmHg,即PFO或ASD患者;A组(9例),25 mmHg≤肺动脉平均压<50 mmHg;B组(25例),肺动脉平均压≥ 50 mmHg。
本研究是一项前瞻性注册研究,注册号为ChiCTR-COC-15006723通过武汉亚洲心脏病医院伦理委员会批准。所有患者或监护人(患者年龄<18岁)签署知情同意书。
1.2 数据采集
局麻或者全麻下经右侧股动、静脉入径穿刺,送入5 F造影导管在肺动脉、右心室、右心房、腔静脉、肺小动脉、左心室、降主动脉等处分别检测压力,并在每一处抽血2 ml监测血氧饱和度,根据Fick公式计算全肺阻力、心输出量等。记录右心室和左心室压力曲线时,导管的前端需要悬浮在心室腔中部,将右心室压力图存储于WITT系统中,用于后续分析及半自动重新数字化处理(使用Metlab的定制程序)。
1.3 左、右心室MRI
心导管检查后48 h内实施MRI。共振扫描在Siemens Magnetom Avanto 1.5T上完成,主磁场最大梯度场强45 mT/m,最大梯度切换率为200 mT/(m·ms)。患者仰卧位,胸前置放体部相控阵线圈,心电门控R波触发成像。扫描参数,重复时间420.60 ms,恢复时间1.16 ms,翻转角80°,矩阵 =166×256,靶场400 mm×400 mm,层厚6 mm,层间隔0.6 mm。图像分析采用Argus心功能分析软件包(西门子,德国)。采用标准切片容积总和技术衡量右心室功能,这项技术已被用于测量左心室容积。用手动方式测算右心室每个切面的腔内边界,追踪收缩末期和舒张末期从顶点到三尖瓣平面的边界。舒张末期容积(enddiastolic volumes,EDV)和收缩末期容积(end-systolic volumes, ESV)采用辛普森规则计算。左心室和右心室每搏输出量(stroke volume,SV)和射血分数(ejection fraction,EF)采用以下公式计算:SV=EDV-ESV,EF=SV/EDV×100%。
1.4 压力-容积环数据
本研究通过GetData软件将压力进行数字化处理,通过CMRtools 3D导出一个完整心动周期下的右心室容积曲线,同步结合一个心动周期下的右心室容积曲线,再将其压力和容积数据进行整合,以容积变化为横坐标,压力变化为纵坐标,绘制成右心室的压力-容积环。进一步计算右心室的收缩末期弹性(elasticity of end systolic,Ees),一般认为即是右心室的最大弹性(Emax),简化的计算公式为Ees=收缩末期压力(ESP)/ESV;实际上常常通过右心室压力曲线中收缩和舒张早期的非线性推导方法,计算出心室等容收缩末期时右心室所能产生的理论最大压力(Pmax),然后再计算 Ees,即 Ees=(Pmax-ESP)/右心室SV,该方法为单次心跳法;动脉弹性(Ea)近似等于ESP/SV;依此计算Ees/Ea即为心室-肺动脉耦合效率[8]。
1.5 统计学分析
所有数据采用SPSS19.0软件进行处理。分类变量采用例数(比)表示,连续变量服从正态分布者用均数±标准差表示,三组间比较采用单因素方差分析,组间两两比较如方差齐性良好采用LSD或Tamhane’s T2检测;连续变量为非正态分布者,采用中位数(最小值,最大值)表示,采用多组秩和检验,组间两两比较采用bonferroni方法调整检验水准。以P<0.05为差异有统计学意义。
2 结果
2.1 患者基线资料比较(表1)
三组患者年龄、身高、体重、体表面积、体重指数等比较,差异均无统计学意义(均P>0.05);B组患者NYHA心功能Ⅱ级、Ⅲ级比例及N末端B型脑利钠肽前体(NT-proBNP)水平显著高于对照组和A组,差异均有统计学意义(均P<0.05)。
2.2 导管测量参数及MRI数据情况比较(表2)
三组患者右心房压力、心输出量、心脏指数、右心室EDV、右心室ESV、右心室每搏输出量、右心室EF、左心室EDV、左心室ESV、左心室每搏输出量、左心室EF比较,差异均无统计学意义(均P>0.05)。B组患者肺动脉平均压显著高于对照组[(67.36±11.19)mmHg 比(17.60±5.22)mmHg,P<0.05]和 A 组[(67.36±11.19)mmHg比(40.67±7.23)mmHg,P<0.05],而 A 组患者显著高于对照组[(40.67±7.23)mmHg比(17.60±5.22)mmHg,P<0.05],差异均有统计学意义;B组患者全肺阻力显著高于对照组[(1175.4±599.19)dyn · s · cm-5比(159.60±127.12)dyn·s·cm-5,P < 0.05] 和 A 组[(1175.4±599.19)dyn·s·cm-5比(683.11±371.86)dyn·s·cm-5,P< 0.05],差异均有统计学意义。

表1 三组患者基线资料情况比较
表2 导管测量参数及MRI数据()
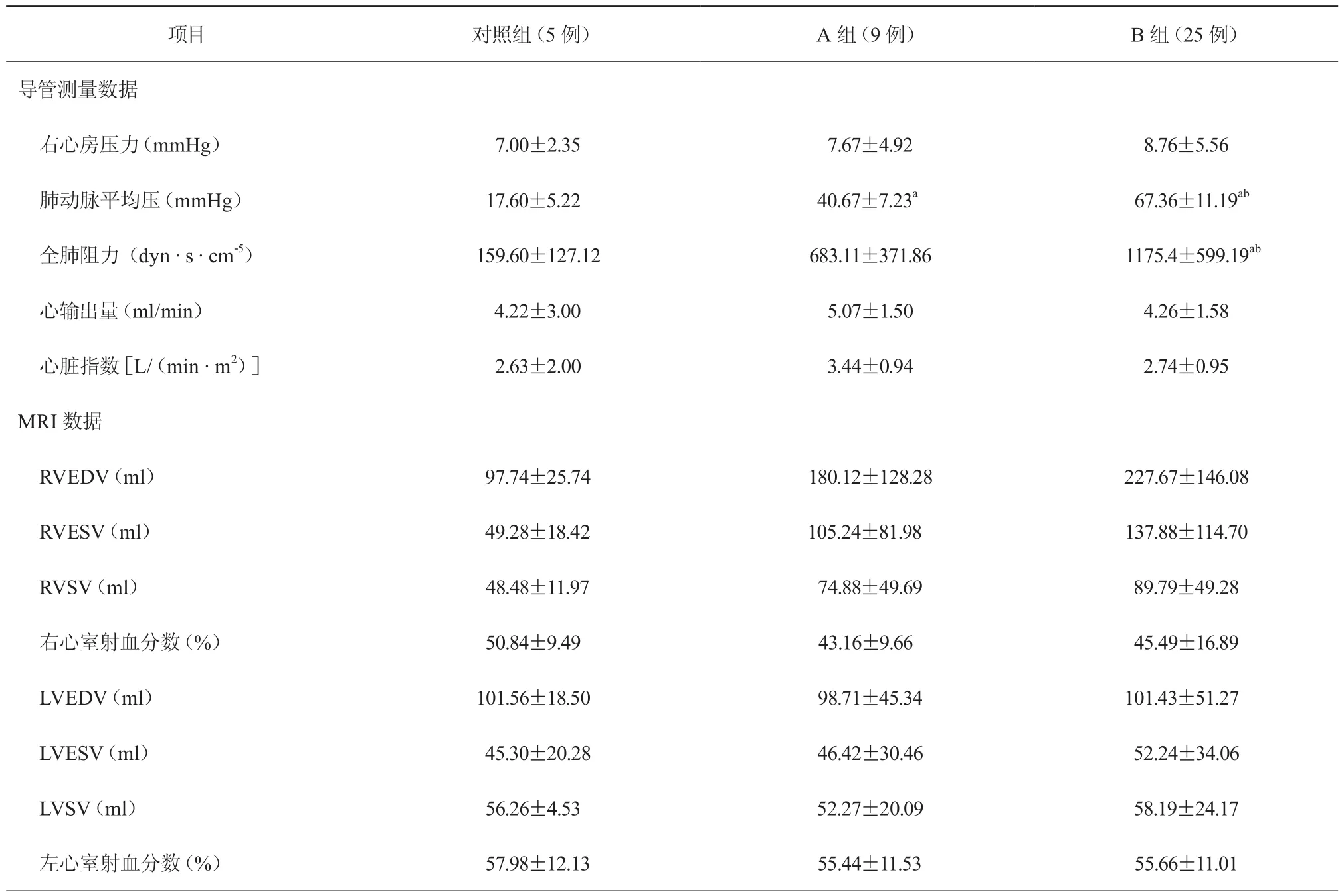
表2 导管测量参数及MRI数据()
注:对照组,肺动脉平均压<25 mmHg(1 mmHg=0.133 kPa);A组,25 mmHg≤肺动脉平均压<50 mmHg;B组,肺动脉平均压≥50 mmHg;MRI,磁共振成像; RV,右心室;EDV,舒张末期容积;ESV,收缩末期容积;SV,每搏输出量;LV,左心室;a,与对照组比较,P<0.05;b,与A组比较,P<0.05
项目 对照组(5例) A组(9例) B组(25例)导管测量数据右心房压力(mmHg) 7.00±2.35 7.67±4.92 8.76±5.56肺动脉平均压(mmHg) 17.60±5.22 40.67±7.23a 67.36±11.19ab全肺阻力 (dyn · s · cm-5) 159.60±127.12 683.11±371.86 1175.4±599.19ab心输出量(ml/min) 4.22±3.00 5.07±1.50 4.26±1.58心脏指数[L/(min · m2)] 2.63±2.00 3.44±0.94 2.74±0.95 MRI数据RVEDV(ml) 97.74±25.74 180.12±128.28 227.67±146.08 RVESV(ml) 49.28±18.42 105.24±81.98 137.88±114.70 RVSV(ml) 48.48±11.97 74.88±49.69 89.79±49.28右心室射血分数(%) 50.84±9.49 43.16±9.66 45.49±16.89 LVEDV(ml) 101.56±18.50 98.71±45.34 101.43±51.27 LVESV(ml) 45.30±20.28 46.42±30.46 52.24±34.06 LVSV(ml) 56.26±4.53 52.27±20.09 58.19±24.17左心室射血分数(%) 57.98±12.13 55.44±11.53 55.66±11.01
2.3 压力-容积环的绘制
通过GetData软件将压力进行数字化处理,通过CMRtools 3D右心室重构导出右心室容积数据,构建压力-容积环并获得参数,以对照组1例患者和B组1例患者为例(图1)。
2.4 压力-容积环参数
B组患者右心室Pmax显著高于对照组[(207.88±65.67)mmHg 比(53.05±12.87)mmHg,P < 0.05]、A 组[(207.88±65.67)mmHg 比(134.73±26.38)mmHg,P<0.05],A 组显著高于对照组[(134.73±26.38)mmHg比(53.05±12.87)mmHg,P<0.05],差异均有统计学意义。A组Ees较对照组[(1.39±0.91)比(0.60±0.28),P> 0.05]有上升趋势,但差异无统计学意义;而B组Ees显著高于对照组[(1.53±0.97)比(0.60±0.28),P<0.05],差异有统计学意义。B组Ea显著高于对照组[(1.34±0.74)比(0.39±0.15),P<0.05],而 Ees/Ea显 著 低 于 对 照 组[(1.12±0.47)比(1.62 ±0.51),P<0.05],差异均有统计学意义(表3)。
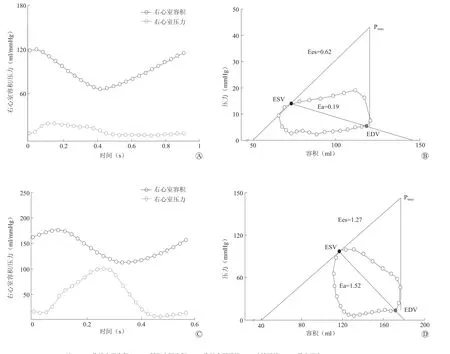
图1 1例对照组患者与1例肺动脉高压患者比较 A.在同一时间坐标下,对照组1例患者的压力曲线及容积曲线;B.GetData构建对照组1例患者压力-容积环;C.在同一时间坐标下,B组1例患者的压力曲线及容积曲线;D.GetData构建B组1例患者压力-容积环
3 讨论
PAH是由肺动脉循环系统血管阻力增加所致的复杂性紊乱,从而导致肺动脉压力和右心室压力升高。与系统性高血压不同的是,PAH难以监测,目前诊断PAH的金标准是侵入性右心导管检查[9]。由于PAH难以监测,目前估算的患病率很可能偏低(每百万人共有15~50例患者),大多数患者在PAH发展至极晚期时才得以诊断[10]。尚无有效治疗PAH的措施,当前的治疗仅可以缓解患者症状,减弱疾病发展进程[11-12]。右心室负荷长期升高,逐渐使得右心室结构形态发生变化,导致右心室功能障碍,最终导致代偿失调的心力衰竭和死亡。

表3 压力-容积环参数(x-±s)
心肌收缩力对于确定PAH患者的临床预后极为重要[13]。具体而言,右心室针对后负荷增加的反应做出补偿或适应取决于右心室收缩力增强并维持心输出量的能力[13]。然而,后负荷长期增加致使右心室收缩功能障碍,最终导致右心衰竭[14]。临床上确定右心室心肌收缩力的“金标准”是右心室Ees[15]。然而,右心室压力-容积关系的相关研究较少。有一种解释是由于右心室的结构较为复杂,因此难以准确测量右心室容积,但仍有人尝试测量。虽然有人通过基于面积-长度偏离和几何模型的方法准确测量了右心室铸型的容量,但这些方法并不适用于测量整个心脏循环过程中的右心室容积,因为室腔形状和空间方向会随着心脏收缩和舒张不断变化,在慢性压力或容积超负荷的异常情况下,单个几何模型不可能适用于所有条件。
本研究通过对比5例PFO或ASD患者(对照组)和34例PAH患者的数据,绘制右心室-压力容积环。通过GetData软件将压力进行数字化处理,通过CMRtools 3D右心室重构导出右心室容积数据。根据压力和容积数据,采用单次心跳法测量心室Ees,以及其他与心脏收缩力相关指数间的关联性。本研究发现,与正常人相比,肺动脉平均压力升高时右心室理论数值Pmax不断增大,在平均压力值不超过50 mmHg时,Pmax达到正常人的2.53倍;当压力超过50 mmHg时,Pmax进一步增加到3.91倍。Ea代表右心室的后负荷,需要指出的是,Ea并非我们理解的肺动脉阻力,而是融合了整个心室后负荷的主要元素,包括末梢阻力、动脉顺应性、特性阻抗等[16-17]。本研究测得肺动脉压力正常时Ea为(0.39±0.15),当肺动脉压力升高时Ea上升至(0.91±0.49),为了对抗后负荷的不断增大,右心室通过增强心肌收缩力维持右心室-肺动脉耦合效率(即Ees/Ea),右心室收缩力Ees由正常人的(0.60±0.28)增至(1.39±0.91)。然而,本研究并未发现Ea和Ees的变化有明显差异,可能是当肺动脉平均压升高的程度不严重时(本研究设定为不高于50 mmHg),肺动脉的末梢阻力、动脉顺应性、特性阻抗等并未对右心室产生严重负荷,Ees/Ea仍然能够维持。但进一步研究发现,当肺动脉平均压力进一步上升时,Ea为(1.34±0.74),较对照组显著升高,此时右心室通过显著增强心肌收缩力提高做功,Ees较前显著增高,大约为对照组的2.5倍。尽管右心室加强了收缩力来对抗后负荷的增加,但其升高的幅度并不足以抵消后负荷的增加,因此Ees/Ea较前下降,开始出现Ees/Ea不能匹配。
总而言之,本研究首次量化了PAH对人体局部力学性能的影响,有助于更好地理解PAH的疾病机制,为后续研究提供了重要信息。本研究提出了一个非常重要的观点,即PAH的早期(肺动脉平均压力低于50 mmHg时),右心室保持了最初的收缩力,能够克服轻微增高的后负荷,Ees/Ea良好;随着肺动脉平均压力进一步升高时,右心室后负荷增强,右心室通过进一步加强收缩力来对抗后负荷的升高,然而收缩力增强的幅度并不能抵抗后负荷的变化,因此出现Ees/Ea降低。
本研究是中国第一个较大样本PAH Ees/Ea的研究。本研究也存在诸多不足:(1)所有患者必须做MRI检查,因此对于NYHA心功能分级Ⅳ级的患者均排除在外,而Ⅳ级的患者往往具有更高的肺动脉压力和更差的Ees/Ea,本研究无法观察到;(2)MRI检查与导管检查无法同步实施,拟合压力和容积曲线时会出现一定的偏差;(3)MRI测量右心室容积的准确度远低于通常所测量的左心室容积,本研究采用的是半自动勾勒容积,这样做不可避免出现一定主观偏差。
[1] Galiè N, Humbert M, Vachiery JL, et al.2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: the joint task force for the diagnosis and treatment of pulmonary hypertension of the European Society of Cardiology (ESC)and the European Respiratory Society (ERS): endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT).Eur Heart J, 2016,37(1):67-119.
[2] Sacks MS, Chuong CJ.A constitutive relation for passive rightventricular free wall myocardium.J Biomech, 1993, 26(11):1341-1345.
[3] Sacks MS, Chuong CJ.Biaxial mechanical properties of passive right ventricular free wall myocardium.J Biomech Eng, 1993,115(2): 202-205.
[4] Witzenburg C, Raghupathy R, Kren SM, et al. Mechanical changes in the rat right ventricle with decellularization.J Biomech,2012, 45(5): 842-849.
[5] Ghaemi H, Behdinan K, Spence AD. In vitro technique in estimation of passive mechanical properties of bovine heart Part I. Experimental techniques and data. Med Eng Phys, 2009, 31(1): 76-82.
[6] Valdez‐Jasso D, Simon MA, Champion HC, et al. A murine experimental model for the mechanical behaviour of viable right‐ventricular myocardium. J Physiol, 2012, 590(18): 4571-4584.
[7] Hill MR, Simon MA, Valdez-Jasso D, et al. Structural and mechanical adaptations of right ventricle free wall myocardium to pressure overload. Ann Biomed Eng, 2014, 42(12): 2451-2465.
[8] Vanderpool RR, Pinsky MR, Naeije R, et al. RV-pulmonary arterial coupling predicts outcome in patients referred for pulmonary hypertension. Heart, 2015, 101(1): 37-43.
[9] 卢蓉, 尚小珂, 张刚成, 等.肺动脉高压患者血流动力学特点与循环内皮细胞的相关性研究.中国介入心脏病学杂志, 2015,23(7):376-380.
[10] Mocumbi AO, Thienemann F, Sliwa K. A global perspective on the epidemiology of pulmonary hypertension. Can J Cardiol,2015, 31(4): 375-381.
[11] Shang XK, Lu R, Zhang X, et al. Efficacy of bosentan in patients after Fontan procedures: a double-blind, randomized controlled trial. J Huazhong Univ Sci Technolog Med Sci, 2016,36(4): 534-540.
[12] 卢蓉, 张刚成, 尚小珂,等.靶向药物联合介入封堵治疗动脉导管未闭合并艾森门格综合征5例效果观察.解放军医药杂志, 2014,26(6):12-16.
[13] Vonk-Noordegraaf A, Haddad F, Chin KM, et al. Right heart adaptation to pulmonary arterial hypertension: physiology and pathobiology. J Am Coll Cardiol, 2013, 62(25 Suppl):D22-D33.
[14] Schmitto JD, Doerge H, Post H, et al. Progressive right ventricular failure is not explained by myocardial ischemia in a pig model of right ventricular pressure overload.Eur J Cardiothorac Surg, 2009, 35(2): 229-234.
[15] 尚小珂, 卢蓉, 肖书娜,等.同步心导管及2D 超声构建人肺动脉高压右心室压力容积环的研究.中国介入心脏病学杂志, 2015,23(11):626-630.
[16] Chirinos JA. Ventricular-arterial coupling: Invasive and noninvasive assessment. Artery Res, 2013, 7(1).
[17] Quick CM, Mohiuddin MW, Laine GA, et al. The arterial system pressure–volume loop. Physiol Meas, 2005, 26(6):N29-N35.
