锆柱撑膨润土对水中磷的吸附和再生性能研究
2018-06-30刘兴勇曹洪岩
钱 程, 刘兴勇, 杨 虎, 曹洪岩
(四川理工学院a.分析测试中心;b.化学工程学院, 四川 自贡 643000)
引 言
随着经济的不断发展,水体中磷超标成为当前环境污染的突出问题,这不仅破坏了生态平衡,也给人类生活带来潜在威胁[1-2],因此,除磷显得尤为重要。常用的除磷方法主要包括生物法[3]、化学沉淀法[4]和吸附法[5],其中吸附法因其操作简便、成本较低、可再生等优点备受关注[6]。
膨润土是一种以蒙脱石为主要成分的天然矿石[7-9],在我国储量丰富,而且也是一种对环境友好型黏土,同时具备较强的离子交换能力[10]。但将膨润土直接用于磷的吸附,效果并不理想,为提高磷吸附能力,对其进行功能化改性是必要的。文献调研发现,关于改性膨润土除磷已有一定研究,且主要集中于Fe、Al、Mg、Ca和La改性[11-13],而在众多无机功能化试剂中,水和氧化锆具备环境友好,无毒,稳定[14-15]以及磷亲和性好[16]等特点,被视为一种极具潜力的除磷剂。姜博汇等[17]采用沉淀法制备了羟基锆改性膨润土,研究了其除磷性能,但对其再生和吸附机理未进行深入探讨,同时,采用沉淀法易造成活性成分与膨润土的物理混合,吸附和再生时会不可避免的发生脱落,从而造成改性试剂浪费,实际应用的经济性较差。
本文采用浸渍法制备锆柱撑膨润土,探究其对磷的吸附和再生性能,并对其结构、吸附机理进行表征和分析,进一步理解磷的吸附过程。
1 材料与方法
1.1 材料和试剂
材料:膨润土原料(Raw Bentonite)购自上海试四赫维化工有限公司,记为R-B。
试剂:八水氧氯化锆,氢氧化钠,磷酸二氢钾,浓盐酸等试剂均为分析纯,由国药集团化学试剂公司生产。使用水均为去离子水。
1.2 吸附剂制备
称取10.0 g R-B,置于250 mL三口烧瓶中,并依次加入100 mL不同浓度的氧氯化锆溶液,其中Zr/R-B(n/wt)分别为0.2 mmol/g,0.4 mmol/g,0.6 mmol/g,0.8 mmol/g,1.0 mmol/g和1.2 mmol/g,323 K下搅拌反应6 h后,经抽滤、洗涤、323 K温度下恒温干燥24 h研磨,过120~200目筛后,作为吸附剂备用。Zr/R-B为0.2 mmol/g,0.4 mmol/g,0.6 mmol/g,0.8 mmol/g,1.0 mmol/g和1.2 mmol/g下所制备的吸附剂分别记为Zr0.2-B,Zr0.4-B,Zr0.6-B,Zr0.8-B,Zr1.0-B和Zr1.2-B。
1.3 磷吸附实验
采用钼酸铵分光光度法[18],测定磷的浓度,计算磷平衡吸附量qe:
(1)
式中:C0和Ce分别为吸附前后磷的浓度,mg/L;V为溶液体积,L;m为吸附剂的质量,g。
吸附研究中,采用0.1 mo/L NaOH或0.1 mo/L HCl调节pH。非特殊说明,吸附条件控制为:初始pH=7.0;温度为室温(293 K);水浴振荡速率180 rpm。
1.3.1 吸附时间的影响
量取500.0 mL一定浓度磷溶液(5 mg/L,10 mg/L和20 mg/L)于500 mL烧杯中,加入1.0 g吸附剂,室温下(293 K),于磁力搅拌器上恒速搅拌反应,并用2.5 mL带滤头的针管定时取一定体积水样,取样总量不超过溶液体积5.0%,计算磷吸附量qt:
(2)
式中:C0和Ct分别为吸附前和t时的磷浓度,mg/L;V为溶液体积,L;m为吸附剂的质量,g。
1.3.2 初始浓度的影响
称取0.1 g吸附剂于50 mL离心管中,与25.0 mL 不同浓度的磷溶液(5 mg/L~100 mg/L)混合均匀,于恒温振荡水浴锅中振荡吸附12 h后,离心分离,取上层清液,测定吸附平衡磷浓度和平衡吸附量。
1.3.3 pH的影响
量取一定体积10.0 mg/L的磷溶液,用0.1 mol/L NaOH或0.1 mol/L HCl调节pH至3.0~9.0,量取25.0 mL不同pH的溶液于50 mL离心管中,加入0.1 g吸附剂,室温下振荡反应12 h,离心后取上层清液,测定体系最终pH和磷吸附量。
1.3.4 吸附剂再生
以NaOH为再生剂,研究再生浓度(0.01 mol/L,0.05 mol/L,0.1 mol/L和0.5 mol/L)对磷解吸率的影响和5次再生磷的吸附性能。
称取0.1 g吸附剂于50 mL离心管中,与25.0 mL 10.0 mg /L的磷溶液于恒温振荡水浴锅中,振荡吸附12 h后,离心分离,取上层清液测定磷吸附量。反复洗涤、离心后,加入25.0 mL再生溶液,室温振荡反应12 h后,离心后取上层清液测定磷含量,计算磷解吸量。循环以上操作,测定5次再生后磷吸附性能。
1.4 材料表征
材料成分采用德国布鲁克公司S4 Explorer型X射线荧光光谱仪测定;材料表面形貌和元素种类分别采用日本电子JSM-7500F型场发射电子显微镜(SEM)和英国牛津X-MAX型X射线电子能谱分析仪(EDS)观察和分析;膨润土晶相和物质种类采用德国布鲁克公司D2 phaser型X射线衍射分析仪测定;X射线光电子能谱分析(XPS)采用美国赛默飞公司Escalab 250Xi型X射线电子能谱仪测定。
2 结果与讨论
2.1 Zr添加量对磷吸附的影响
Zr添加量对磷吸附的影响及Zr含量变化如图1所示。由图1可知,锆改性后,膨润土的磷吸附量明显提高,且随着Zr添加量的增加,磷吸附量和Zr含量变化规律相似。一定磷浓度下,随着Zr/R-B由0.2 mmol/g增加至0.6 mmol/g时,Zr含量增加明显,磷吸附量快速增加,继续增加Zr添加量,Zr含量增加不明显,磷吸附量增加缓慢,当Zr/R-B超过0.8 mmol/g时,磷吸附量增加较少,原因是一定质量的膨润土离子交换能力有限,当Zr用量为0.8 mmol/g时,Zr在膨润土上的交换趋于饱和。考虑到性价比,故选择0.8 mmol/g为最佳条件,并将Zr0.8-B作为后续研究的吸附剂。
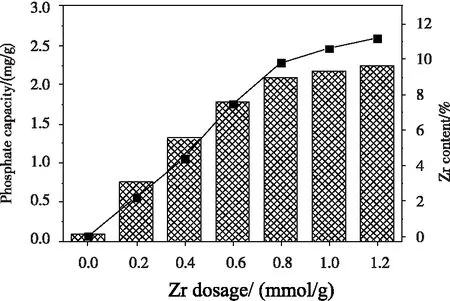
图1 Zr添加量对磷吸附的影响
2.2 表征
R-B和Zr0.8-B的X射线光电子能谱分析(XRD)谱图如图2所示。由图2可知,R-B中含有明显的蒙脱石衍射峰,表明膨润土主要成分为蒙脱石[13]。改性后,作为蒙脱石晶面间距特征衍射峰(001)晶面衍射峰[19-20]出现的位置发生明显变化,2 θ由6.75 °减小到4.72 °,晶面间距(d001)从1.31 nm增加到1.87 nm,表明浸渍改性后,锆进入了膨润土层间,撑大膨润土的层间距。
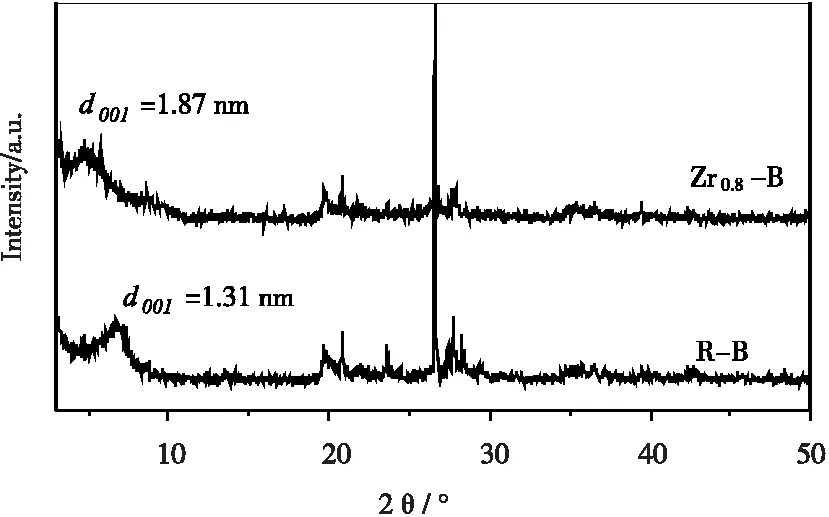
图2 R-B和Zr0.8-B的XRD谱图
图3分别为R-B((a)5 kx;(b)10 kx)和Zr0.8-B((c)5 kx;(d)10 kx)的SEM图像。由图3可知,R-B整体为块状,呈明显的片层堆积的特点。改性后,Zr0.8-B整体的片层结构未发生明显变化但表面更为粗糙,局部呈现零碎的小片状。这样的变化能一定程度增加材料的比表面积,有利于吸附的进行。

图3 R-B和Zr0.8-B的SEM图
2.3 吸附时间的影响
时间对磷吸附性能的影响如图4所示。由图4可知,Zr0.8-B对磷的吸附经历了快速吸附、缓慢吸附和吸附平衡三个阶段,原因在于,吸附初期,吸附剂具有较多的吸附位点,随着时间延长吸附点逐渐被占据,吸附速率减慢且最终趋于平衡。初始浓度5 mg/L,10 mg/L和20 mg/L下,吸附分别在120 min,180 min和240 min附近达到平衡,且平衡吸附量qexp逐渐增加,分别为0.92 mg/g,1.88 mg/g和3.84 mg/g。
为进一步描述磷吸附过程,分别采用拟一级动力学模型和拟二级动力学模型[22-23]对数据进行拟合,结果如图4所示,相关参数见表1。
(3)
(4)
式中:qe(mg/g)为平衡吸附量;t(min)为吸附时间;qt(mg/g)为t时的吸附量;k1(1/min)、k2(g/(mg·min)为吸附速率常数。
由相关系数R2可知,相比于拟一级动力学模型(R2>0.91),拟二级动力学模型(R2>0.97)能更好对吸附数据进行拟合,这表明吸附的限速步骤为化学吸附。此外,由表2可知,初始浓度为5 mg/g,10 mg/g和20 mg/g时,拟二级动力学拟合所得的平衡吸附量分别为0.95 mg/g,2.08 mg/g和4.31 mg/g,更接近于实验测得qexp,速率常数k2分别为0.1446 g/(mg·min),0.0345 g/(mg·min)和0.0076 g/(mg·min),这表明在低浓度条件下,Zr0.8-B对磷的吸附速率更快,能更快达到吸附平衡。
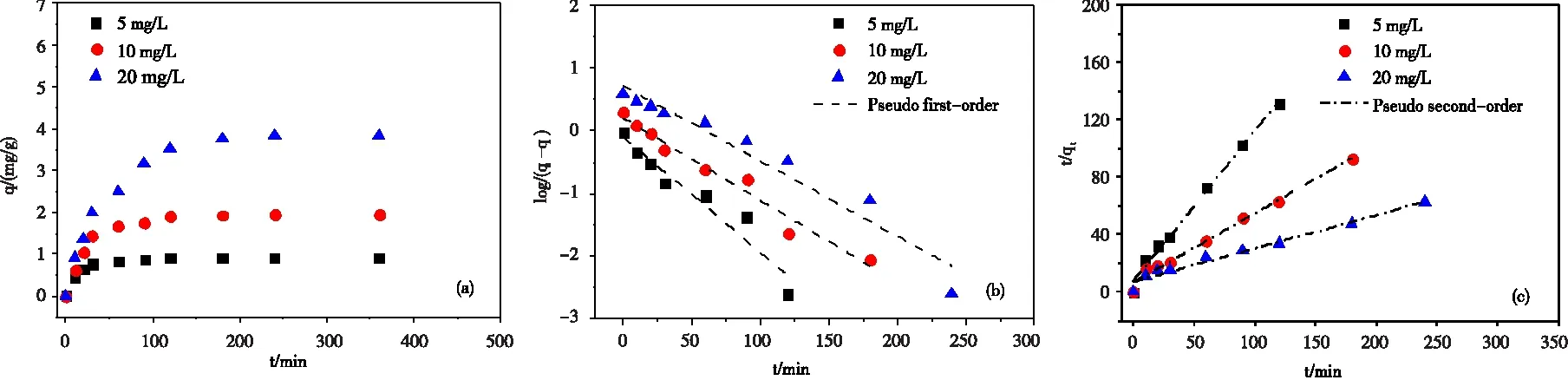
图4 时间对磷吸附的影响和动力学拟合曲线
2.4 初始浓度对磷吸附的影响
为进一步评估磷的吸附容量,本文在一定温度下,吸附不同浓度的磷,当吸附达到饱和状态,绘制吸附等温线,即吸附平衡浓度和平衡吸附量的关系曲线。采用Langmuir模型(式5)和Freundlich模型(式6)[24-26],对吸附数据进行非线性拟合,结果见图5和表2。
(5)
(6)
式中:qe是平衡吸附量,mg/g;qmax为吸附饱和时的理论最大吸附量,mg/g;Ce是溶液的平衡浓度,mg/L;KL为Langmuir系数,L/mg;KF和n为Freundlich吸附常数和与温度有关的无量纲的特征系数。

表1 磷吸附动力学参数
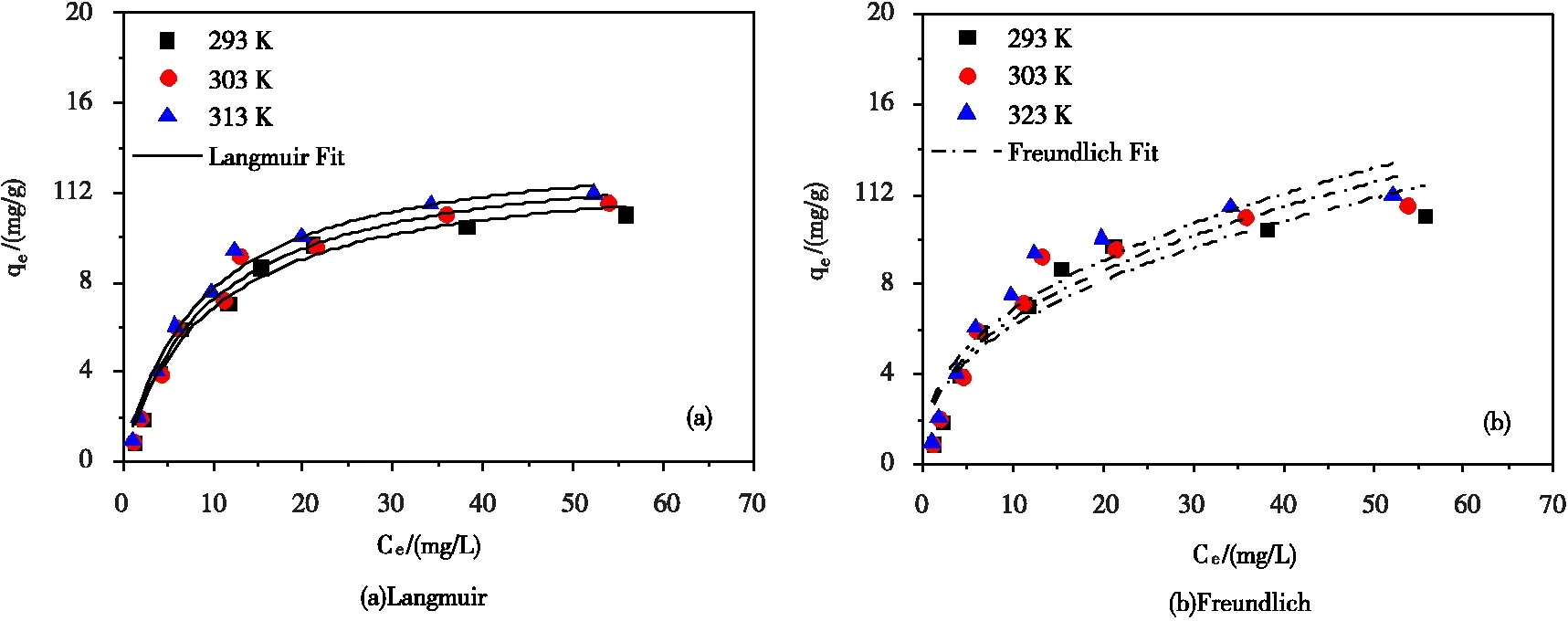
图5 磷吸附等温线
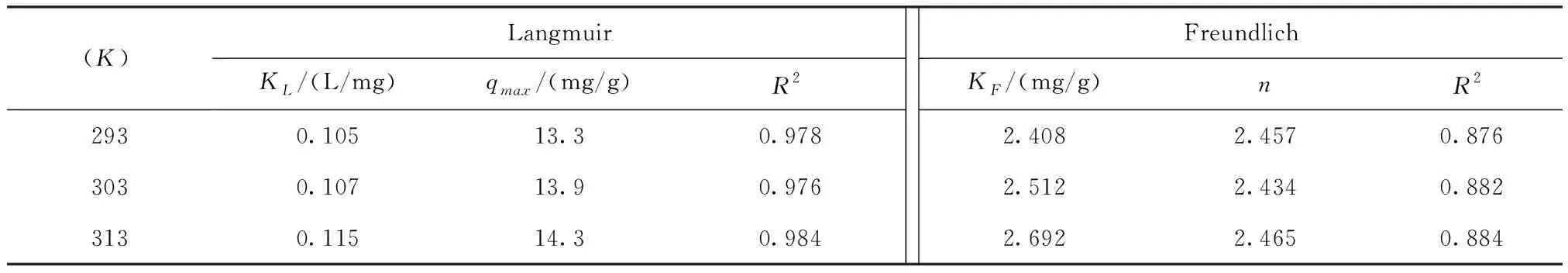
(K)293303313LangmuirKL/(L/mg)qmax/(mg/g)R20.10513.30.9780.10713.90.9760.11514.30.984FreundlichKF/(mg/g)nR22.4082.4570.8762.5122.4340.8822.6922.4650.884
由图5和表2可知,采用Langmuir模型对吸附数据进行拟合所得的相关系数(R2>0.97)明显高于Freundlich模型(R2>0.87),表明Zr0.8-B对磷的吸附主要是单层吸附。温度为293 K,303 K和313 K条件下,由Langmuir模型拟合所得的最大吸附量(qmax)分别为13.3 mg/g,13.9 mg/g和14.3 mg/g,表明,升高温度有助于磷的吸附。同时,相比于文献报道的其他改性膨润土和锆基吸附材料(表3),也有较好的磷吸附效果。

表3 磷吸附性能对比
2.5 初始pH对磷吸附的影响
图6为不同初始pH(4.0~9.0)环境下磷平衡吸附量和吸附终点pH的变化曲线。由图6可知,酸性条件有利于磷的吸附,随着pH的升高,磷吸附量呈现不断下降的趋势,当初始pH=9.0时,吸附量较pH=4时下降了49.7%。此外,pH=4.0~9.0时,吸附终点pH相比于初始pH均有不同程度的增加。当初始pH≥7.0时,增加幅度变小,终点pH分别升高了0.7,0.4和0.2。
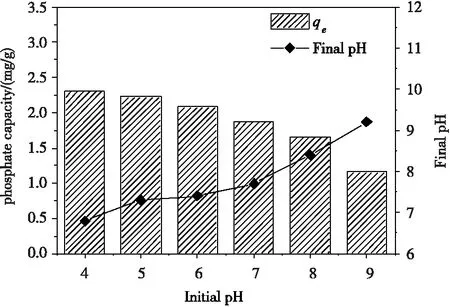
图6 pH对磷吸附的影响
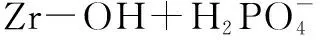
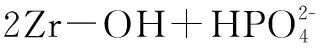
当溶液初始pH升高时,溶液的OH-浓度增加,平衡向左移动,这不利吸附的进行,造成吸附量的减少。同时,吸附过程中,吸附剂上的锆表面羟基(-OH)被磷酸根交换,OH-被释放到溶液中,使得吸附终点pH升高。
2.6 吸附剂再生
吸附剂再生性能对吸附剂的实际应用至关重要,本文以NaOH溶液为再生剂,研究NaOH浓度对磷解吸率的影响和5次再生后磷的吸附性能,结果见表4和图7。

表4 再生剂对磷解吸率影响

图7 5次再生磷吸附量
由表4可知,NaOH浓度升高有利于磷解吸,当NaOH浓度<0.1 mol/L时,磷解吸率增加明显,从50.8%增加至76.6%和88.4%。而当而NaOH浓度增加至0.5 mol/L时,磷解吸率增加幅度变小,相比于0.1 mol/L时,解吸率仅增加了2.4%。这是由于NaOH浓度增加,使得体系中OH-浓度升高,反应平衡向磷解吸方向移动,不利于磷的吸附;但磷的吸附-解吸是一种动态平衡,当OH-达到一定浓度,磷的吸附-解吸达到新的平衡,导致OH-对磷解吸率贡献并不显著,因此选取0.1 mol/L为再生浓度。
以0.1 mol/L NaOH为再生剂,经5次连续再生后,磷吸附量减少18.6%,表明锆插层膨润土具备较好的再生能力。
2.7 吸附机理
为进一步理解Zr0.8-B对磷的吸附机理,采用SEM-EDS和XPS对Zr0.8-B和磷吸附后的吸附剂(Zr0.8-B-P)进行表征和分析。
2.7.1 SEM-EDS分析
图8为Zr0.8-B-P的SEM-EDS图((a)SEM;(b)Zr元素;(c)P元素)。由图8可知,Zr0.8-B颗粒中含有一定量的Zr和P元素,表明改性后,Zr-OH成功负载在R-B上,且磷成功吸附于Zr0.8-B。

图8 Zr0.8-B-P的SEM-EDS图
2.7.2 XPS分析
图9为Zr0.8-B和Zr0.8-B-P的XPS数据经过XPSPEAK41软件拟合所得的图谱。其中图9(a)是Zr0.8-B和Zr0.8-B-P的Zr 3d图谱,由图9可知,磷吸附后,Zr 3d的结合能变大,这是由于锆表面的羟基(-OH)被磷酸根部分取代,并形成了新物质(Zr-O-P),而相比于H(2.1),P(2.19)具有更高的电负性[2,14],当磷吸附后,羟基(-OH)被磷酸根代替,使得Zr电荷密度变小,导致了Zr的结合能变大。同时,也证明了磷在Zr0.8-B的吸附是化学吸附。
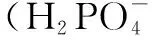
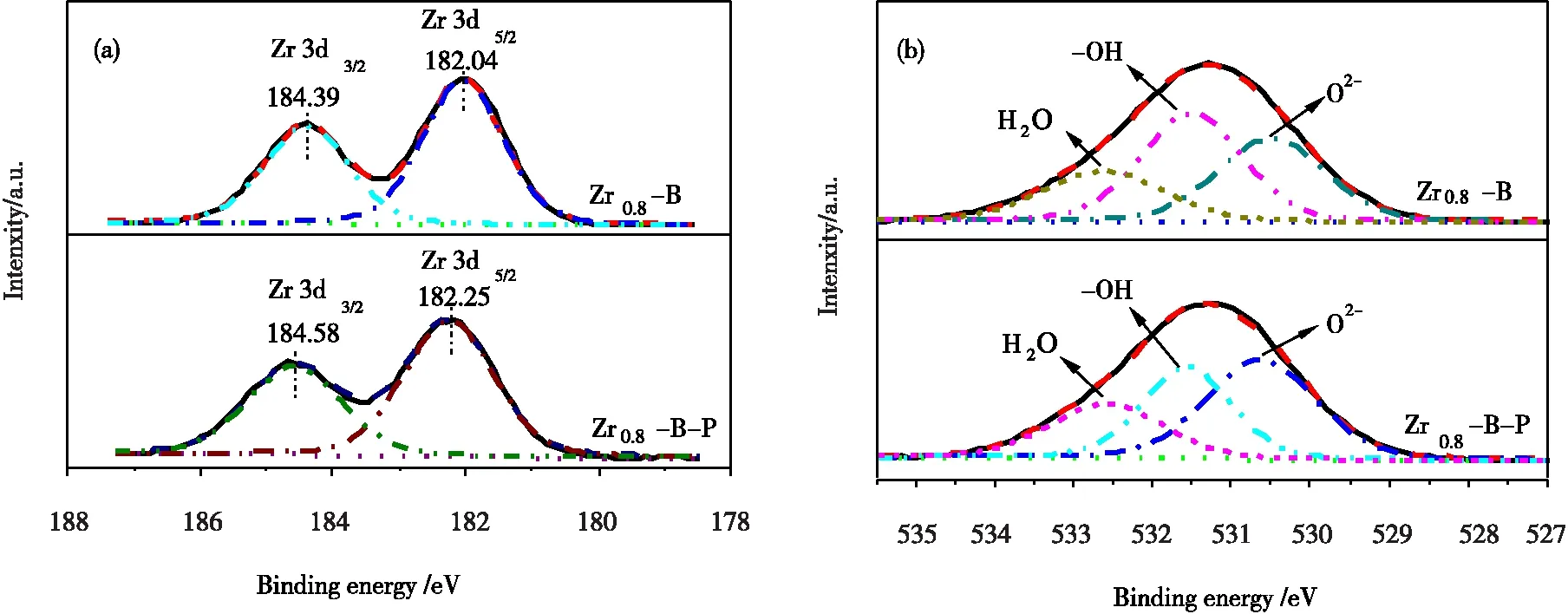
图9 吸附前后的XPS图谱
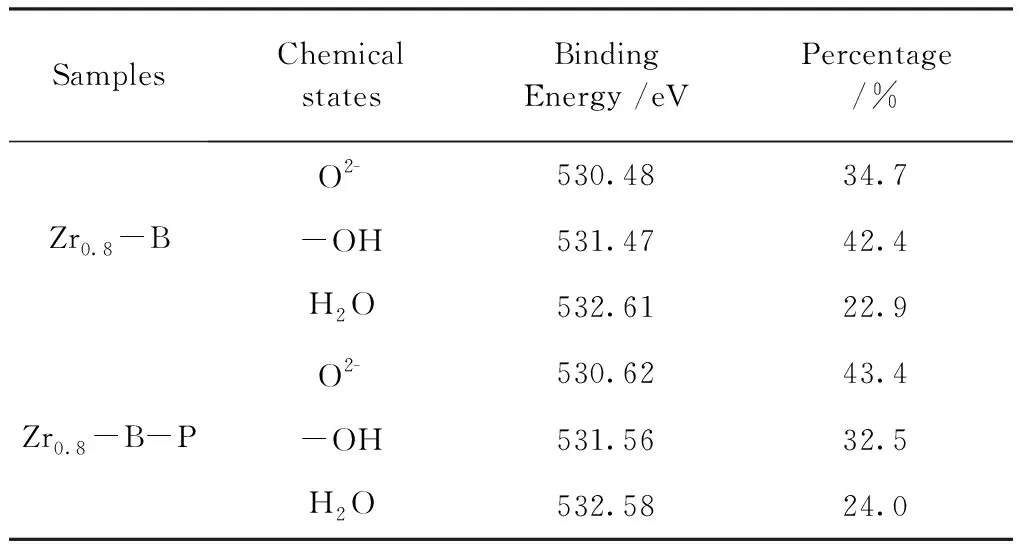
SamplesChemical statesBinding Energy /eVPercentage /%Zr0.8-BO2-530.4834.7-OH531.4742.4H2O532.6122.9Zr0.8-B-PO2-530.6243.4-OH531.5632.5H2O532.5824.0
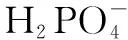
3 结 论
(1)改性后膨润土对磷的吸附能力显著提升,一定程度增加Zr的添加量有利于增加磷吸附量,且当Zr=0.8 mmol/g时较佳。
(2)改性后,膨润土层间距d001增大0.55 nm,膨润土形貌发生明显变化,表面更为粗糙。
(3)锆柱撑膨润土对磷的吸附经过了快速吸附、缓慢吸附和吸附平衡的过程,符合拟二级动力学模型,吸附等温线符合Langmuir吸附模型。
(4)一定范围内增加NaOH浓度有利于磷的解吸。以0.1 mol/L NaOH为再生试剂,经5次再生后,磷吸附量下降了18.6%,表明锆柱撑膨润土有较好的再生能力。
(5)SEM-EDS、pH和XPS分析表明,磷在Zr-OH改性膨润土上的吸附是化学吸附,且羟基(-OH)起关键作用,吸附机理为配体交换。
参考文献:
[1] ZHANG L,ZHOU Q,LIU J Y,et al.Phosphate adsorption on lanthanum hydroxide-doped activated carbon fiber[J].Chem Eng J,2012,185-186:160-167.
[2] ZHONG E M,LIU X H,JIANG J H,et al.Preparation and characterization of zirconia-loaded lignocellulosicbutanol residue as a biosorbent for phosphate removal from aqueous solution[J].Appl Surf Sci,2016,387:419-430.
[3] MARTíN H G,IVANOVA N,KUNIN V,et al.Metagenomic analysis of two enhanced biological phosphorus removal (EBPR) sludge communities[J].Nat Biotechnol,2006,24:1263-1269.
[4] HAUDUC H,TAKáCS I,SMITH S,et al.A dynamic physicochemical model for chemical phosphorus removal[J].Water Res,2015,73:157-170.
[5] GUAYA D,VALDRRAMA C,FARRAN A,et al.Simultaneous phosphate and ammonium removal from aqueous solution by a hydrated aluminum oxide modified natural zeolite[J].Chem Eng J,2015,271:204-213.
[6] YIN H B,KONG M.Simultaneous removal of ammonium and phosphate from eutrophic waters using natural calcium-rich attapulgite-based versatile adsorbent[J].Desalination,2014,351:128-137.
[7] MA J F,QI J,YAO C,et al.A novel bentonite-based adsorbent for anionic pollutant removal from water[J].Chem Eng J,2012,200-202:97-103.
[8] ZHU R L,ZHU L Z,ZHU J X,et al.Sorption of naphthalene and phosphate to the CTMAB-Al-13 intercalated bentonites[J].J Hazard Mater,2009,168:1590-1594.
[9] GU L,XU J L,LV L,et al.Dissolved organic nitrogen (DON) adsorption by using Al-pillared bentonite[J].Desalination,2011,269:206-213.
[10] ZAMPARAS M,DROSOS M,GEOGIOU Y,et al.A novel bentonite-humic acid composite material BephosTMfor removal of phosphate and ammonium from eutrophic waters[J].Chem Eng J,2013,225:43-51.
[11] YAN L G,XU Y Y,YU H Q,et al.Adsorption of phosphate from aqueous solution by hydroxy-aluminum,hydroxy-iron and hydroxy-iron-aluminum pillared bentonites[J].J Hazard Mater,2010,179:244-250.
[12] BOURAIE M R,MASOUD A A.Adsorption of phosphate ions from aqueous solution by modified bentonite with magnesium hydroxide Mg(OH)2[J].Appl Clay Sci,2017,140:157-164.
[13] KUROKI V,BOSCO G E,FADINI P S,et al.Use of a La(III)-modified bentonite for effective phosphate removal from aqueous media[J].J Hazard Mater,2014,274:124-131.
[14] ZONG Z,WEI D,WAN H Q,et al.Adsorptive removal of phosphate ions from aqueous solution using zirconia-functionalized graphite oxide[J].Chem Eng J,2013,221:193-203.
[15] LIN J W,ZHAN Y H,WANG H,et al.Effect of calcium ion on phosphate adsorption onto hydrous zirconium oxide[J].Chem Eng J,2017,309:118-129.
[16] WANG Z,XING M C,FANG W K,et al.One-step synthesis of magnetite core/zirconia shell nanocomposite for high efficiency removal of phosphate from water[J].Appl Surf Sci,2016,366:66-77.
[17] 姜博汇,林建伟,詹艳慧,等.不同锆负载量锆改性膨润土对水中磷酸盐吸附作用的对比[J].环境科学,2017,38(6):2400-2411.
[18] SONG X Y,PAN Y Q,WU Q Y,et al.Phosphate removal from aqueous solutions by adsorption using ferric sludge[J].Desalination,2011,280:384-390.
[19] 方圣琼,潘进,李晓,等.羟基铁柱撑蒙脱石对庆大霉素的吸附性能[J].硅酸盐学报,2016,44(2):314-320.
[20] TIMOFEEVAA M N,PANCHENKOA V N,GIL A,et al.Effect of the acid-base properties of Zr,Al-pillared clays on the catalytic performances in the reaction of propylene oxide with methanol[J].Appl Catal B:Environ,2011,104:54-63.
[21] LIU H L,SUN X F,YIN C Q,et al.Removal of phosphate by mesoporous ZrO2[J].J Hazard Mater,2008,151:616-622.
[22] WANG W J,ZHOU J,WEI D,et al.ZrO2-functionalized magnetic mesoporous SiO2as effective phosphate adsorbent[J].J Colloid Interf Sci,2013,107:442-449.
[23] RAMAKRISHNA M,SURESH V.Apple Peels-A Versatile Biomass for Water Purification[J].ACS Appl Mater Interfaces,2013,5:4443-4449.
[24] YANG J,YUAN P,CHEN H Y,et al.Rationally designed functional macroporous materials as new adsorbents for efficient phosphorus removal[J].J Mater Chem,2012,22:9983-9990.
[25] LI G L,GAO S,ZHANG G S,et al.Enhanced adsorption of phosphate from aqueous solution by nanostructured iron(III)-copper(II) binary oxides[J].Chem Eng J,2014,235:124-131.
[26] 韩朗,庹必阳,杨慧,等.锆柱撑蒙脱石对黄药的吸附机理[J].硅酸盐学报,2017,45(5):1-8.
[27] 王虹,林建伟,詹艳慧,等.锆改性高岭土原位改良技术控制重污染河道底泥磷释放效果[J].环境科学,2015,36(10):3720-3729.
[28] TIAN S L,JIANG P X,NING P,et al.Enhanced adsorption removal of phosphate from water by mixed lanthanum/aluminum pillared montmorillonite[J].Chem Eng J,2009,151:141-148.
[29] XIONG W P,TONG J,YANG Z H,et al.Adsorption of phosphate from aqueous solution using iron-zirconiummodified activated carbon nanofiber:Performance and mechanism[J].J Colloid.Interf Sci,2017,439:17-23.
[30] LONG F,GONG J L,ZENG G M,et al.Removal of phosphate from aqueous solution by magnetic Fe-Zr binary oxide[J].Chem Eng J,2011,171:448-455.
