磷酸甘油酸激酶1和前列腺癌临床特征的相关性及在预后预测中的作用
2018-06-30潘恩山李煜罡朱晓光
潘恩山,李煜罡,朱晓光
(南方医科大学 1中医药学院, 2中西医结合医院泌尿外科, 广东 广州 510315)
前列腺癌(prostate cancer,PCa)是一种严重威胁男性生命的恶性肿瘤,在中国的发病率远低于西方国家,但是近年来也呈逐年上升的趋势[1]。PCa的发病可能与生活方式、寿命延长、人口老龄化以及前列腺特异性抗原(prostate-specific antigen,PSA)早期诊断技术的提高有关;而PCa患者的死亡则和初诊患者已局部进展或远处转移丧失了根治性治疗的机会相关[2],这是因为PCa易发生远处转移,尤其是骨转移,所以寻找PCa转移相关基因尤为重要。磷酸甘油酸激酶1(phosphoglycerate kinase 1,PGK 1)是糖酵解通路上的关键酶,催化1,3-二磷酸甘油酸转变成3-磷酸甘油酸,且进一步影响DNA的复制和损伤修复。在多种恶性肿瘤组织中,包括结肠癌、乳腺癌、肺癌以及肝癌,PGK1的表达和肿瘤的发生发展以及预后明显相关[3-6]。研究还表明PGK1和PCa的骨转移密切相关,但是其在PCa组织中的表达以及和PCa临床特征以及预后的关系还不清楚。本研究通过收集PCa和良性前列腺增生(benign prostatic hyperplasia,BPH)患者的前列腺组织,采用免疫组化(immunohistochemistry,IHC)和Western blot法测定PGK1的表达,分析PGK1和PCa临床特征以及预后的关系。
材 料 和 方 法
1 样品收集
本研究对象为自2013年1月~2014年12月于南方医科大学中西医结合医院经门诊诊治,并在住院部行手术治疗的BPH患者30例和PCa患者132例,所有患者经过医院病理科确认,并且临床资料齐全。前列腺病理组织用10%福尔马林固定,石蜡包埋,切片厚度4 μm。对所有患者进行随访,随访时间为3~48个月。
2 实验方法
2.1细胞培养 前列腺正常细胞株RWPE-1和PCa细胞株LNCaP、DU145和PC3均在含10%胎牛血清、1×105U/L 青霉素 G和100 mg/L 链霉素的RPMI-1640 培养基中,37 °C、5% CO2进行培养。当细胞融合度大约为80%时用胰酶消化进行传代。
2.2IHC检测 常规石蜡切片厚度4 μm,放入70 ℃烤箱烤片1 h。切片脱蜡,自来水和蒸馏水冲洗各20 s,确保洗涤充分。采用高温高压法修复抗原。放入3%过氧化氢水溶液5~10 min,以去除内源性过氧化酶。洗涤。滴加抗PGK1兔多克隆抗体(稀释度1∶500;Abcam)后37 ℃孵育2 h。甩掉 I 抗,切片放入PBS缓冲液中清洗3次,每次3 min,充分洗涤,防止因 I 抗洗涤不净引起的非特异性染色。滴加辣根过氧化物酶标记羊抗兔IgG聚合物(稀释度1∶5 000;北京中杉金桥生物技术有限公司),37 ℃孵育20 min。DAB显色5 min。苏木素复染细胞核数秒。分化、返蓝。梯度乙醇脱水,二甲苯透明,中性树胶封片。采用相差显微镜拍照(×100和×400),表达量分析采用Image-Pro Plus 6.0软件,对每张照片进行分析得出每张照片阳性的积分吸光度(integrated absorbance,IA)。染色结果根据每张切片的阳性细胞比例及着色深浅进行半定量评分。染色强度:无色0分,淡黄色1分,棕黄色2分,棕褐色为3分;再按阳性细胞百分率打分:阳性细胞<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。染色强度与阳性细胞百分比的乘积≤1为阴性,>1为阳性。
2.3Western blot检测 1 000 r/min离心10 min收集细胞,吸净上清后留沉淀。沉淀中直接加入细胞裂解液,冰上充分裂解。BCA法测定总蛋白浓度,10% SDS-PAGE分离蛋白,电泳结束后取出分离胶进行转膜,加入转膜缓冲液,恒定电流0.5 A转膜2 h。室温下,将PVDF膜放入5%脱脂奶粉中封闭1 h。然后将PVDF膜放入10 mL稀释过的抗PGK1抗体(1∶2 000)中4 ℃过夜。去除抗PGK1抗体,30 mL 1×TBST洗膜3次,每次5 min,再加入10 mL稀释的辣根过氧化物酶标记的羊抗兔IgG聚合物(1∶5 000),室温孵育2 h。30 mL 1×TBST洗膜3次,每次5 min,暗室进行曝光。灰度采用ImageJ分析。
3 统计学处理
采用SPSS 19.0统计软件进行数据处理和统计分析。计量资料采用均数±标准差(mean±SD)表示,多组之间比较采用单因素方差分析,多组中两两比较采用LSD法;计数资料组间对比采用2检验。Cox回归分析进行单因素和多因素分析前列腺癌的危险因素,Kaplan-Meier法分析PGK1阴性表达和阳性表达组的生存率。以P<0.05为差异有统计学意义。
结 果
1 PGK1在PCa组织和细胞中的表达
IHC结果显示,PCa组织标本中都有不同程度的PGK1表达。PGK1主要表达于胞浆,偶尔可在核中显示,呈棕黄色颗粒状。与BPH组相比,PGK1在PCa组织中的表达强度显著提高,见图1A。与前列腺正常细胞株RWPE-1相比,PCa细胞株LNCaP、PC3和DU145中PGK1的表达显著升高(P<0.05),见图1B。
2 PGK1和PCa临床特征的关系
PGK1和PCa临床特征的关系如表1所示。PGK1和PCa患者的年龄和肿瘤大小的差异无统计学显著性,而与Gleason评分、TNM分期、局部浸润、骨转移和血清PSA的表达有显著相关性(P<0.05)。PGK1的高表达与高Gleason评分、高TNM分期、局部浸润、发生骨转移和高血清PSA水平密切相关。
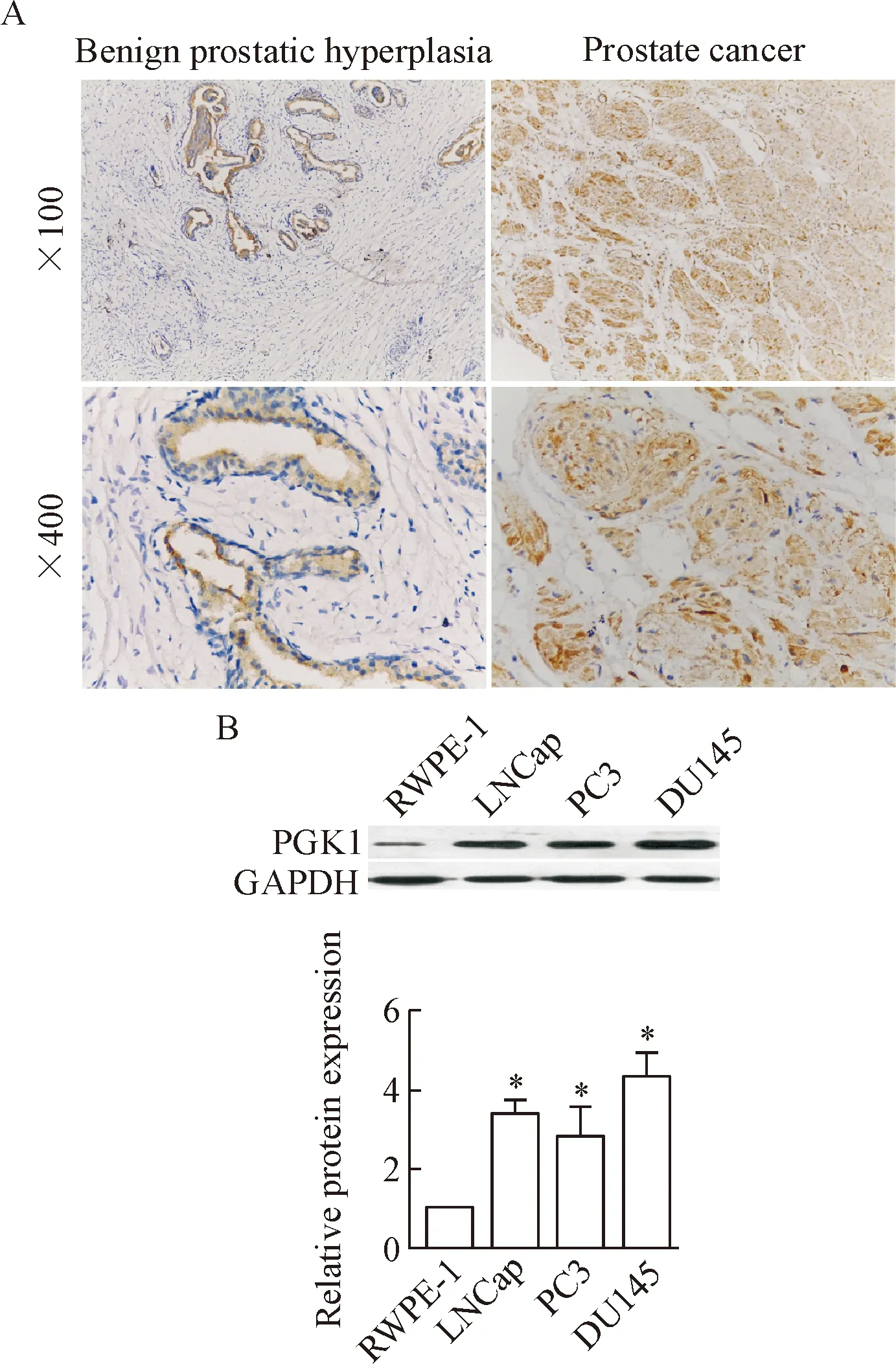
Figure 1. The expression of PGK1 in the prostate cancer tissues and cells. A: representative images of IHC for obser-ving the expression of PGK1 in the prostate cancer and benign prostatic hyperplasia tissues; B: the relative expression of PGK1 in the prostate cells detected by Western blot.*P<0.05vsthe RWPE-1.
图1IHC和Westernblot检测PGK1在PCa组织和细胞中的表达
3 PGK1对PCa患者的预后预测
根据IHC结果将PCa组织分为PGK1表达阳性和阴性2组,其中阴性表达组为54例,阳性表达组为78例。用生存曲线分析PCa患者的生存时间和PGK1表达的关系,结果如示,Kaplan-Meier分析表明PGK1的阳性表达和阴性表达组生存时间差异显著(P=0.009),PGK1表达阳性预示预后不良,见图2。进一步采用单变量和多变量Cox分析,确定PGK1的表达和表1的临床病理参数是否为前列腺癌患者生存的独立危险参数,结果如表2所示。单变量Cox分析表明Gleason评分、TNM分期、局部浸润、骨转移、血清PSA水平及PGK1表达是影响PCa患者生存的危险因素;进一步采用多变量Cox分析表明骨转移、血清PSA水平和PGK1表达是PCa患者生存的独立危险因素。
表1PGK1和PCa的临床特征的关系
Table 1. The relationship between PGK1 and clinicopathological features of PCa

Clinicopathological featurenPGK1 expression+- 2PAge0.6780.410 ≤60471730 >60853748Tumor size (cm)1.9810.159 <5782850 ≥5542628Gleason grade9.2540.002 ≤7673631 >7651847TNM stage5.8230.016 Ⅰ+Ⅱ793940 Ⅲ+Ⅳ531538Invasion5.4840.019 Yes 842856 No 482622Bone metastasis9.4340.002 Yes36729 No964749Serum PSA (μg/L)29.7000.000 ≤1039309 >10932469
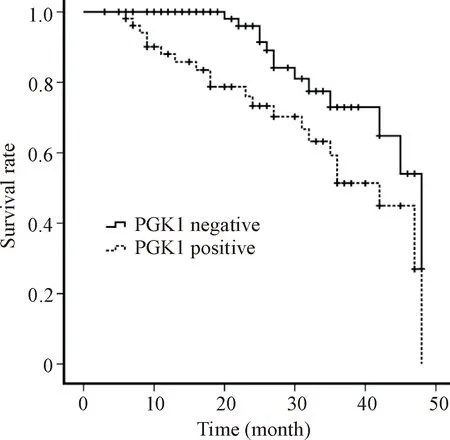
Figure 2. Evaluation of the influence of PGK1 on the prognosis of prostate cancer patients by survival curves.
图2生存曲线评估PGK1对PCa患者预后的影响
讨 论
PGK1是糖酵解通路上的关键酶,催化1,3-二磷酸甘油酸转变成3-磷酸甘油酸,进一步影响DNA的复制和损伤修复。PGK-1和肿瘤的发生发展以及耐药性有着密切关系。研究表明,PGK1的K323 位点乙酰化能够影响肝癌PCAF(p300/CBP-associated factor)和SIRT7(sirtuin 7)的表达,促进肝癌细胞的增长,从而促进肝癌的发生和发展[3]。在结肠癌中,PGK1在转移患者组织中的表达比未转移患者明显升高,表明PGK1和结肠癌的转移密切相关[4]。全基因组表达谱芯片筛查分析发现PGK1在卵巢癌的基因调控网络中具有重要作用[7];PGK1还能够促进神经胶质瘤的迁移和侵袭,促进神经胶质瘤的化疗耐药[8-9]。以往研究还表明PGK1在PCa组织中的表达明显上升,高表达的PGK1能够诱导成骨细胞分化,抑制破骨细胞形成,促进PCa的骨转移[10]。PGK1在PCa相关的基质细胞也高表达;基质细胞高表达PGK1释放到肿瘤微环境中能够刺激CXCL12-CXCR4信号通路,促进MMP-2和MMP-3蛋白的表达,诱导PCa细胞的迁移和侵袭[11]。本研究表明PGK1在PCa组织和细胞中的表达明显上升,而且PGK1的表达与PCa的Gleason评分、TNM分期、局部浸润、骨转移和血清PSA水平具有显著相关性,和以往研究相似。
表2单变量和多变量COX分析前列腺癌患者临床特征对总生存率的影响
Table 2. The effects of clinicopathological parameters on overall survival of PCa patients evaluated by univariate and multivariate Cox analysis

Clinicopathological parameterUnivariate analysisMultivariate analysisRisk ratio95% CIPRisk ratio95% CIPAge 1.4850.722~3.0540.283Tumor size0.7960.386~1.6430.538Gleason grade2.4881.731~7.0280.0111.3450.306~2.8160.077TNM stage2.3811.506~7.5920.0130.9130.191~1.9690.116Invasion2.4941.114~3.5530.0311.9190.411~8.9690.407Bone metastasis3.3392.316~10.615<0.0012.8501.382~3.4760.011Serum PSA2.7561.459~4.1140.0112.0261.493~2.7480.005PGK1 expression5.4392.543~11.633<0.0014.1182.191~9.442<0.001
CI: confidence interval.
PGK1和肿瘤的预后不良明显相关,可以作为肿瘤的预后预测基因。在乳腺癌中PGK1表达和乳腺癌癌旁组织相比明显上升,和患者的总生存率密切相关[12]。Lu等[13]研究表明PGK1能够作为胆囊癌的预后预测蛋白;Zieker等[14]发现在胃癌中PGK1高表达,PGK1可以作为PCa预后不良预测的标志物。本研究表明Gleason评分、TNM分期、局部浸润、骨转移、血清PSA水平及PGK1表达是影响PCa患者生存的危险因素,而多变量COX分析表明骨转移、血清PSA水平和PGK1表达是PCa患者生存的独立危险因素。进一步研究表明高表达的PGK1与PCa的预后不良明显相关,与PGK1在其它肿瘤中的预后预测作用相似。
总之,PGK1是PCa患者生存的独立危险因素,能够作为PCa的预后预测标志物。但是由于文中收集的样本数较少,下一步将收集大样本进行调查验证。
[参 考 文 献]
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2):87-108.
[2] Chen W, Zheng R, Zeng H, et al. Annual report on status of cancer in China, 2011[J]. Chin J Cancer Res, 2015, 27(1):2-12.
[3] Hu H, Zhu W, Qin J, et al. Acetylation of PGK1 promotes liver cancer cell proliferation and tumorigenesis[J]. Hepatology, 2017, 65(2):515-528.
[4] Ahmad SS, Glatzle J, Bajaeifer K, et al. Phosphoglyce-rate kinase 1 as a promoter of metastasis in colon cancer[J]. Int J Oncol, 2013, 43(2):586-590.
[5] Shashni B, Sakharkar KR, Nagasaki Y, et al. Glycolytic enzymes PGK1 and PKM2 as novel transcriptional targets of PPARγ in breast cancer pathophysiology[J]. J Drug Target, 2013, 21(2):161-174.
[6] Tang SJ, Ho MY, Cho HC, et al. Phosphoglycerate kinase 1-overexpressing lung cancer cells reduce cyclooxygenase 2 expression and promote anti-tumor immunityinvivo[J]. Int J Cancer, 2008, 123(12):2840-2848.
[7] 李典鹤, 黄昌男, 李 奇. 基于癌症基因组图谱筛查卵巢浆液性囊腺癌相关基因[J]. 中国病理生理杂志, 2016, 32(12):2276-2281.
[8] 丁 浩, 周 涛, 成宜军, 等. 下调磷酸甘油酸激酶1增强胶质瘤U251细胞的放射敏感性[J]. 临床神经外科杂志, 2014, 21(5):321-325.
[9] Cheng YJ, Ding H, Du HQ, et al. Downregulation of phosphoglycerate kinase 1 by shRNA sensitizes U251 xe-nografts to radiotherapy[J]. Oncol Rep, 2014, 32(4):1513-1520.
[10] Jung Y, Shiozawa Y, Wang J, et al. Expression of PGK1 by prostate cancer cells induces bone formation[J]. Mol Cancer Res, 2009, 7(10):1595-1604.
[11] Wang J, Ying G, Jung Y, et al. Characterization of phosphoglycerate kinase-1 expression of stromal cells derived from tumor microenvironment in prostate cancer progression[J]. Cancer Res, 2010, 70(2):471-480.
[12] Sun S, Liang X, Zhang X, et al. Phosphoglycerate kinase-1 is a predictor of poor survival and a novel prognostic biomarker of chemoresistance to paclitaxel treatment in breast cancer[J]. Br J Cancer, 2015, 112(8):1332-1339.
[13] Lu W, Gao J, Yang J, et al. Down-regulated phosphoglycerate kinase 1 expression is associated with poor prognosis in patients with gallbladder cancer [J]. Medicine (Baltimore), 2015, 94(49):e2244.
[14] Zieker D, Konigsrainer I, Traub F, et al. PGK1 a potential marker for peritoneal dissemination in gastric cancer[J]. Cell Physiol Biochem, 2008, 21(5-6):429-436.
