初发急性髓性白血病患者外周血中高表达TAL1基因及其意义*
2018-06-30何子凡廖紫薇陈少华吴秀丽李扬秋
何子凡,丘 丹,廖紫薇,陈少华,吴秀丽,李扬秋
(暨南大学基础医学院血液病研究所, 广东 广州 510632)
TAL1又称为干细胞白血病基因,是重要的调控造血分化的转录因子,属碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)转录因子家族成员[1]。TAL1表达于正常原始造血细胞中,在造血和胚胎血管发育中发挥关键调控作用,它通过调控相关靶基因的表达来影响造血细胞的发育和分化[2-3]。T细胞急性淋巴细胞白血病(T-cell acute lymphoblastic leukemia, T-ALL)患者常见TAL1高表达,并与预后不良相关[2,4]。但TAL1在其它类型白血病,如成人常见白血病类型——急性髓性白血病(acute myeloid leukemia,AML)细胞中表达情况并不清楚,因此,我们对初发AML患者外周血中TAL1基因的表达水平进行了定量检测。
材 料 和 方 法
1 研究对象
收集本研究所自行保存的急性白血病细胞株样本,包括T-ALL细胞株(Jurkat细胞株和CCRF-CEM细胞株)及AML细胞株(HL-60细胞株和NB4细胞株);收集经细胞形态学、组织化学染色及流式细胞术免疫学分型确诊的47例初发急性髓性白血病患者的外周血样本(男27例,女20例;年龄20~77岁,中位年龄36.0岁),其中包括10例AML-M1型,9例AML-M2型,9例AML-M3型,10例AML-M4型及9例AML-M5型;同时收集12例健康志愿者外周血样本作为健康对照组(男6例,女6例,年龄20~51岁,中位年龄28.5岁)。采样通过医院伦理学委员会批准,已征得患者及健康献血者的同意并签署知情同意书。
2 RNA提取和cDNA合成
收集肝素抗凝外周血样本后,常规方法分离外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)。用TRIzol试剂盒(Invitrogen)分别提取所收集的PBMCs和白血病细胞株样本的RNA,并应用随机引物和SuperScript III反转录酶试剂盒(Invitrogen)反转录合成cDNA并检测合成cDNA的质量。
3 引物设计
根据NCBI基因库的TAL1基因序列(Gene ID:6886),分别设计上游引物(5’-GGATGCCTTCCCTATGTTCA-3’)和下游引物(5’-AAGATACGCCGCACAACTTT-3’);以β-actin作为内参照,设计其上游引物(5’-AGAAAATCTGGCACCACACC-3’)和下游引物(5’-AGAGGCGTACAGGGATAGCA-3’)。引物均由上海英潍捷基公司合成。
4 Real-time PCR
参照RealMaster Mix试剂盒(Tiangen)说明书,以β-actin作为内参照,利用SYBR Green I染料检测PBMCs中TAL1的mRNA表达水平。总反应体系为20 μL,包括2.5×RealMaster Mix(Tiangen)10 μL、0.4 mmol/L上、下游引物以及1 μL cDNA;每一标本设2个复孔。反应条件为:95 ℃ 3 min;95 ℃ 30 s、60 ℃ 30 s、72 ℃ 45 s,共30个循环;72 ℃ 5 min;在82 ℃设读板检测荧光。扩增完后,进行熔解曲线分析,以0.17 ℃ /s变化速度从55 ℃~95 ℃每隔2 s记录1次荧光值,获得熔解曲线。反应在Chromo 4实时荧光定量PCR仪(Bio-Rad)上进行,实验设空白对照和阳性对照。采用2-ΔΔCt法分析目的基因TAL1的相对表达水平。
5 统计学处理
采用SPSS 13.0统计软件对数据进行统计学处理。计量数据以均数±标准差(mean±SD)表示。采用Mann-Whitney非参数检验或Welch检验进行正常对照组与AML细胞株或AML患者外周血样本中TAL1 mRNA相对表达水平的两两比较。以P<0.05为差异有统计学意义。
结 果
1 TAL1 mRNA在急性白血病细胞株中的表达水平
既往研究显示T-ALL中TAL1异常高表达,因此,本实验首先检测T-ALL细胞株Jurkat和CCRF-CEM中TAL1的表达情况作为基本数据,结果显示Jurkat细胞和CCRF-CEM细胞中TAL1 mRNA的表达水平均高于健康对照组,其中Jurkat细胞的表达水平更高。我们进一步检测了AML细胞HL-60和NB4细株中TAL1 mRNA的表达水平,结果发现HL-60细胞中TAL1的表达水平明显高于T-ALL细胞株,而NB4细胞中TAL1的表达水平较健康对照组也有一定程度的增加(P<0.05),见图1。
2 TAL1 mRNA在AML患者PBMCs中的表达水平
我们进一步分析原代AML细胞样本中TAL1的表达特点,结果发现TAL1 mRNA在AML患者外周血中的表达水平显著高于健康对照组(P<0.05)。我们对不同亚型的初发AML患者PBMCs中TAL1的mRNA表达水平也进行了定量分析,结果显示初发AML-M1、AML-M2、AML-M3、AML-M4和AML-M5中的TAL1 mRNA表达水平均显著高于健康对照组(P<0.05),见图2。我们还分析了不同亚型AML患者的TAL1的表达模式,发现虽然TAL1在AML-M1和AML-M5亚型中呈现较高的水平,但是统计学分析的结果显示AML各种亚型之间的TAL1基因表达水平均无显著差异,见图2。
讨 论
TAL1基因位于1p32,首先是在1例罕见伴有t(1;14)(p32;q11)染色体易位的T-ALL中发现的,主要的遗传学改变是在1号染色体TAL1基因的5′非编码区和SIL基因之间存在一段90 kb的缺失,形成SIL/TAL1融合基因,导致TAL1高表达[5],这种TAL1重排可见于25%~30%的T-ALL。SIL/TAL1重排与不良预后相关,高发溶瘤综合征和弥漫性血管内凝血,死亡率高,无病生存期和总生存期短。SIL/TAL1+T-ALL小鼠模型中也有类似发现[6]。在小于9岁的儿童T-ALL中,伴有SIL/TAL1阳性提示预后不良[7]。造血干细胞移植后出现SIL/TAL1融合基因阴性转阳性或者TAL1基因高表达的T-ALL患者存在早期复发,可作为移植后微小残留病变的新检测指标[8]。但是,1项来自欧洲的儿童T-ALL临床研究报道,由于SIL/TAL1伴有较多的髓外复发,382例儿童T-ALL中,16%伴有SIL/TAL1的患儿总体预后与SIL/TAL1阴性组无显著差异[9]。因此,需要从多个方面深入探讨TAL1基因与白血病发病的相关性。
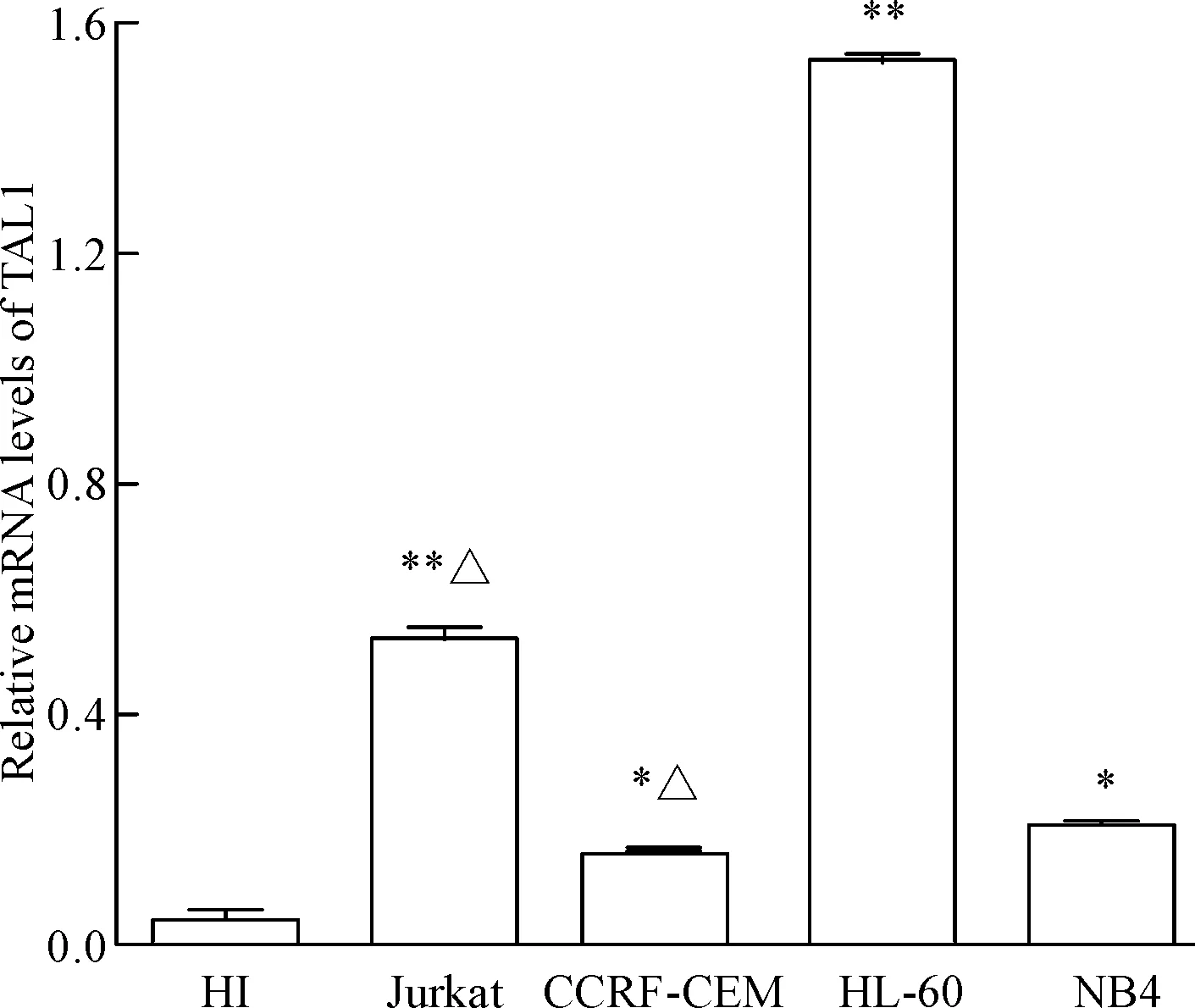
Figure 1. Relative mRNA levels of TAL1 in acute leukemia cell lines (Jurkat, CCRF-CEM, HL-60, NB4) and PBMCs of healthy individuals (HI). Mean±SD.n=4.*P<0.05,**P<0.01vsHI group;△P<0.05vsHL-60 group.
图1TAL1mRNA在健康人外周血PBMCs和急性白血病细胞株中的水平

Figure 2. Relative mRNA expression levels of TAL1 in PBMCs of acute myeloid leukemia (AML) patients and healthy individuals (HI). The short dash represents the median value.
图2TAL1mRNA在健康人和AML患者外周血PBMCs中的水平
目前对TAL1基因的研究多数集中于T-ALL中,关于TAL1基因在其它类型白血病中的表达情况并不清楚。AML是一类成人常见的恶性血液病,具有高度异质性,伴有不良细胞遗传学或分子遗传学者预后较差。为了解TAL1基因与AML发病的相关性,我们首先检测了急性白血病细胞株中TAL1基因的表达水平,发现TAL1基因不但高表达于T-ALL细胞株Jurkat和CCRF-CEM中,而且在AML细胞株HL-60和NB4中也呈高表达,甚至出现更高的表达水平,我们进一步证实了初发的原代AML细胞中TAL1基因也存在异常高表达。动物实验已证实TAL1基因的高表达可以诱导T细胞恶性转化,与T-ALL发病相关[1-2],而TAL1在AML中的作用尚不明确。TAL1表达于正常原始造血细胞中,在造血和胚胎血管发育中发挥关键调控作用。其中,共同髓样前体细胞(common myeloid precursor,CMP)转化为粒系/单核系祖细胞(granulocyte-macrophage progenitor,GMP)的过程中依赖TAL1的参与,随着分化成熟,TAL1的表达水平下调[10]。由此,我们推测其异常高表达可能影响粒系的分化发育,参与AML的发病。TAL1的异常高表达可能是通过TAL1基因异常甲基化而介导的,有报道显示在AML小鼠模型中发现存在TAL1基因的异常甲基化[11],也有研究发现TAL1的表达模式受TAL1基因甲基化影响[12]。这可能是有别于T-ALL的TAL1基因异常表达介导AML发生的另一种模式,但还有待进一步的证实。本研究中还发现TAL1基因在AML-M1和AML-M5亚型中呈现较高的表达水平,可能与这两种AML亚型病人的外周血或骨髓中幼稚细胞较多相关。但可能由于样本量的限制,AML各种亚型之间的TAL1基因表达水平未显示显著统计学差异,还需要进一步扩大样本量加以证实。
致谢:本文作者感谢美国佛罗里达大学医学院生化与分子生物学系Suming Huang教授对TAL1基因研究给予的指导。
[参 考 文 献]
[1] Porcher C, Chagraoui H, Kristiansen MS. SCL/TAL1: a multifaceted regulator from blood development to disease[J]. Blood, 2017, 129(15):2051-2060.
[2] Sanda T, Leong WZ. TAL1 as a master oncogenic transcription factor in T-cell acute lymphoblastic leukemia[J]. Exp Hematol, 2017, 53:7-15.
[3] Hoang T, Lambert JA, Martin R. SCL/TAL1 in hematopoiesis and cellular reprogramming[J]. Curr Top Dev Biol, 2016, 118:163-204.
[4] 李扬秋, Siegert W, Schmidt CA. 干细胞白血病基因在白血病中的表达[J]. 中国病理生理杂志, 1997, 13(2):176-178.
[5] Carlotti E, Pettenella F, Amaru R, et al. Molecular characterization of a new recombination of the SIL/TAL-1 locus in a child with T-cell acute lymphoblastic leukaemia[J]. Br J Haematol, 2002, 118(4):1011-1018.
[6] Wang D, Zhu G, Wang N, et al. SIL-TAL1 rearrangement is related with poor outcome: a study from a Chinese institution[J]. PLoS One, 2013, 8(9):e73865.
[7] Mansur MB, Emerenciano M, Brewer L, et al. SIL-TAL1 fusion gene negative impact in T-cell acute lymphoblastic leukemia outcome[J]. Leuk Lymphoma, 2009, 50(8):1318-1325.
[8] Zhao X, Hong Y, Qin Y, et al. The clinical significance of monitoring the expression of the SIL-TAL1 fusion gene in T-cell acute lymphoblastic leukemia after allogeneic hematopoietic stem cell transplantation[J]. Int J Lab Hematol, 2017, 39(6):613-619
[9] D’Angiò M, Valsecchi MG, Testi AM, et al. Clinical features and outcome of SIL/TAL1-positive T-cell acute lymphoblastic leukemia in children and adolescents: a 10-year experience of the AIEOP group[J]. Haematologica, 2015, 100(1):e10-e13.
[10] Brunet de la Grange P, Zink E, Armstrong F, et al. Impairment of granulo-monocytic development of human common myeloid progenitors but not of granulo-monocytic progenitors by decreasing stem cell leukemia/T-cell acute leukemia 1 expression[J]. Stem Cells, 2008, 26(6):1658-1662.
[11] Sonnet M, Claus R, Becker N, et al. Early aberrant DNA methylation events in a mouse model of acute myeloid leukemia[J]. Genome Med, 2014, 6(4):34.
[12] Patel B, Deng C, Litt M, et al. CTCF mediated enhancer and promoter interaction regulates differential expression ofTAL1 oncogene in normal and malignant hematopoiesis[J]. Blood, 2012, 120:281.
