STMN1在宫颈癌中表达的临床意义及抑制其表达对宫颈鳞癌SiHa细胞活力和凋亡的影响*
2018-06-30柴芝红应灵潇潘一红蔡仙丽孔为民
柴芝红,应灵潇,潘一红,蔡仙丽,孔为民
(1台州市立医院妇科, 2台州市中心医院妇科, 浙江 台州318000; 3首都医科大学附属北京妇产医院妇瘤科, 北京 100006)
宫颈癌是常见的女性恶性肿瘤,目前在我国的发病率和死亡率呈上升趋势,且发病年龄呈现年轻化,对女性的生命及健康造成了严重的威胁[1]。宫颈癌的发生发展是一个涉及表观遗传学改变、免疫改变、抑癌基因失活及癌基因激活等多阶段、多基因的复杂网络调控过程。因此,从分子水平上研究宫颈癌的发病机制对于治疗具有重要意义。微管解聚蛋白1(stathmin 1,STMN1)是近些年研究较多的一种能够在细胞有丝分裂和分裂间期使微管动力学改变的小分子磷蛋白,在大部分正常组织中有表达,在多种肿瘤中过表达,主要参与调控微管的动态平衡,进而影响多种生理病理过程[2]。有研究显示,胃癌中STMN1的过表达与分化程度呈现正相关[3];结肠癌中STMN1的阳性表达与TNM分期及淋巴转移相关,而与性别、年龄、肿瘤位置及分化程度无关[4];也有研究发现,抑制STMN1的表达可诱导胃癌细胞凋亡,且增强对化疗药物的敏感性[5]。但目前关于STMN1对宫颈癌的影响尚未清楚。因此,本研究首先检测了STMN1在宫颈癌中的表达,并分析与临床指标的关系,并通过RNA干扰抑制其表达后检测细胞的增殖和凋亡情况,为宫颈癌的治疗提供理论基础。
材 料 和 方 法
1 组织样本
选取浙江台州市立医院医院在2014年6月~2015年8月期间手术切除的宫颈癌标本80例,所有标本均经过病理证实,且术前均未行放疗、化疗或生物治疗。其中鳞癌为70例,腺癌为10例,年龄为25~68岁,平均年龄为41.5岁。按照FIGO,2009标准进行分期,ⅠB1期、ⅡB2期、ⅢB3期和ⅣB4期分别为24例、16例、24例和16例;低分化和高分化分别为28例和52例;有盆腔淋巴转移及无盆腔淋巴转移分别为24例和56例。另取15例癌旁组织作为对照。
2 试剂和仪器
宫颈鳞癌SiHa细胞购自中国科学院上海细胞所;胎牛血清、RPMI-1640培养基和MTT试剂盒均购自Sigma; LipofectamineTM2000转染试剂盒购自Gibco;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自北京康为世纪生物技术有限公司;全蛋白提取试剂盒、ECL发光试剂盒和膜联蛋白V(Annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)细胞凋亡试剂盒均购自中国碧云天试剂公司;抗STMN1、信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)、p-STAT3和survivin抗体购自Santa Cruz Biotechnology。酶标仪购自BioTek;流式细胞仪购自Becton Dickinson。
3 方法
3.1宫颈癌组织中STMN1的表达 按照全蛋白提取试剂盒的说明提取宫颈癌及癌旁组织中的总蛋白,BCA法进行蛋白定量,上样缓冲液与蛋白样品按照1∶4的比例充分混合均匀,沸水中煮沸5 min进行变性,每孔中40 μg蛋白样品行10% SDS-PAGE,电泳结束后转膜至PVDF膜,10%的脱脂奶粉室温封闭2 h,洗膜,加抗STMN1(1∶5 000稀释)和GAPDH(1∶2 000稀释) I 抗,4 ℃孵育过夜,洗膜,加入HRP标记的羊抗兔(1∶2 000稀释)II 抗,室温孵育1 h,洗膜,增强型化学法(ECL)检测蛋白质印迹,显影、定影后晾干保存。
3.2细胞培养 SiHa细胞在37 ℃、5% CO2饱和湿度条件下,用含10%胎牛血清的PRMI-1640培养基培养。取生长至对数期的细胞进行实验。
3.3实验分组及STMN1-siRNA的转染 实验分为3组:(1)正常对照(control)组:细胞不经特殊处理;(2)阴性对照(negative control,NC)组:细胞转染合成的阴性siNRA;(3)STMN1-siNRA组:细胞内转染合成的STMN1-siNRA。以每孔1×105的密度将对数生长期的SiHa细胞接种于6孔板中,细胞生长达到60%融合时进行转染,siRNA的转染浓度为每孔中100 nmol/L,转染终体积为每孔中加入培养基2 mL。置于37 ℃、5% CO2培养箱中培养4~6 h后,将培养基换为含有10%胎牛血清的PRMI-1640完全培养基,继续培养48 h后收集细胞,进行相应的实验。
3.4STMN1、STAT3、p-ATAT3和survivin蛋白表达检测 参照方法3.1。
3.5MTT法测定细胞活力 以1×108/L的密度将对数生长期的SiHa细胞接种于96孔板中,每孔中加入100 μL,置于37 ℃、5% CO2饱和湿度条件下培养24 h后,按照3.3分组进行转染,转染48 h后收集细胞,每孔中加入MTT溶液20 μL (5 g/L),培养4 h后每孔中加入150 μL的DMSO溶液终止反应。酶标仪中振荡10 min,检测490 nm各个孔的吸光度(A)值,每组4个复孔,实验重复3次。
3.6流式细胞术检测细胞凋亡 各组细胞转染后培养48 h,用0.25 %的胰蛋白酶消化细胞,离心,PBS漂洗细胞1次,弃上清,加入100 μL的PBS重悬细胞,再分别加入Annexin V-FITC和PI试剂各5 μL,轻轻混匀,置于室温环境中避光反应30 min,流式细胞仪检测细胞凋亡率。
3.7细胞活性氧簇(reactive oxygen species,ROS)的检测 各组细胞转染后培养48 h,依照中国碧云天试剂公司ROS检测试剂盒操作说明,上流式细胞仪前0.5 h,所有孔中加入适量的2’,7’-二氯二氢荧光素二乙酸酯(DCFH-DA),孵箱孵育,0.5 h后将没孔的细胞消化收集至15 mL的离心管中,离心,弃上清,PBS洗涤细胞1次,弃上清,加入200 μL的PBS重悬细胞,移入流式管中,流式细胞仪在488 nm激发波长和525 nm发射波长下检测细胞的荧光强度。荧光强度与细胞内的ROS水平呈现正相关,以此反映细胞内的ROS水平。实验重复3次。
4 统计学处理
所有实验数据采用SPSS 21.0软件进行分析。计数资料用n(%)表示,其统计推断采用χ2检验;计量资料用均数±标准差(mean±SD)表示,两组比较用独立样本t检验,多组差异比较采用单因素方差分析,多重比较采用Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 宫颈癌组织中STMN1的蛋白表达
Western blot检测宫颈癌组织中STMN1的蛋白表达,结果显示,宫颈癌组织中STMN1的蛋白表达显著高于癌旁组织(P<0.01),见图1。
2 STMN1的表达对宫颈癌临床指标的影响
由表1可知,STMN1的表达与宫颈癌患者年龄和组织学分型无关,而与临床分期、组织学分化程度及淋巴结转移相关(P<0.05)。

Figure 1. The protein expression of STMN1 in the cervical can-cer tissues. Mean±SD.n=80.*P<0.05vsadjacent tissue.
图1STMN1在宫颈癌中的蛋白表达
表1STMN1的表达对宫颈癌临床指标的影响
Table 1. The relationship between protein expression of STMN1 and clinical indicators of cervical cancer (n=80)
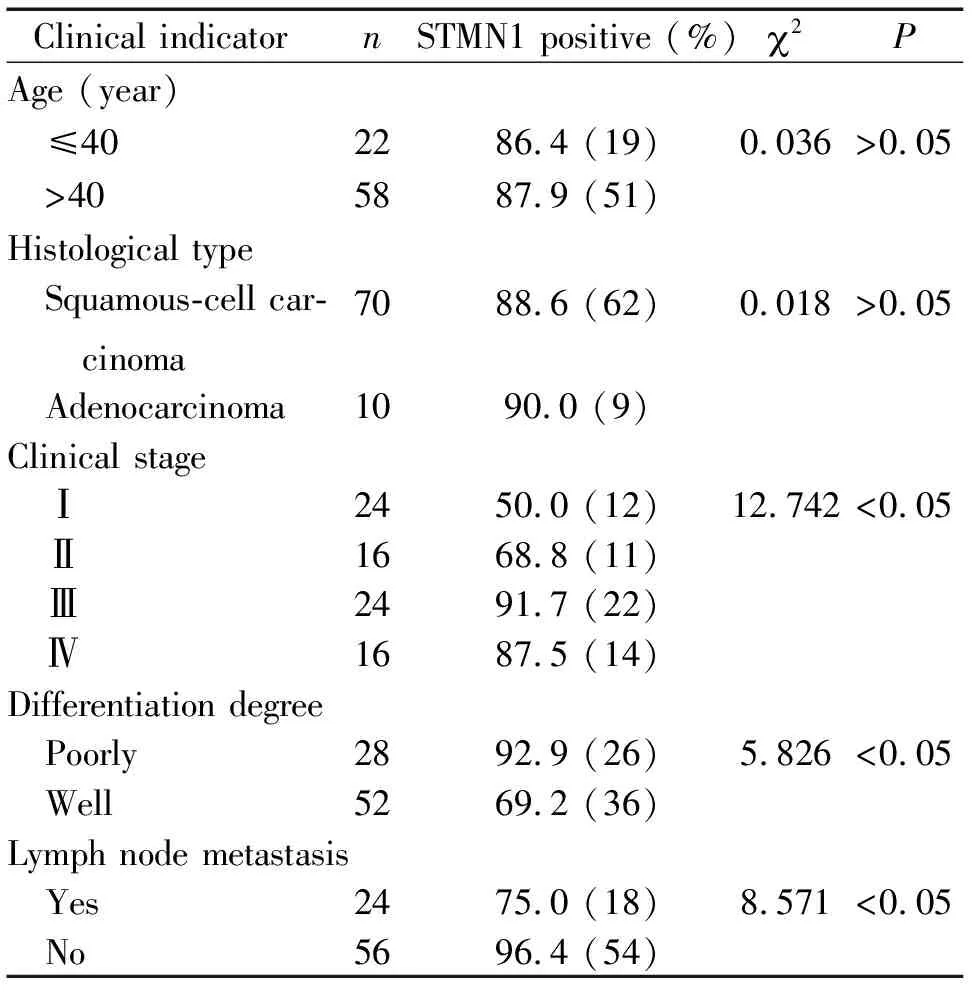
Clinical indicatornSTMN1 positive (%) 2PAge (year) ≤402286.4 (19)0.036>0.05 >405887.9 (51)Histological type Squamous-cell car- cinoma7088.6 (62)0.018>0.05 Adenocarcinoma1090.0 (9)Clinical stage Ⅰ2450.0 (12)12.742 <0.05 Ⅱ1668.8 (11) Ⅲ2491.7 (22) Ⅳ1687.5 (14)Differentiation degree Poorly 2892.9 (26)5.826<0.05 Well 5269.2 (36)Lymph node metastasis Yes2475.0 (18)8.571<0.05 No5696.4 (54)
3 STMN1在转染STMN1-siRNA的细胞中的表达
NC组STMN1的蛋白表达与control组差异无统计学显著性,而STMN1-siRNA组STMN1的蛋白表达显著低于control组(P<0.01),见图2。
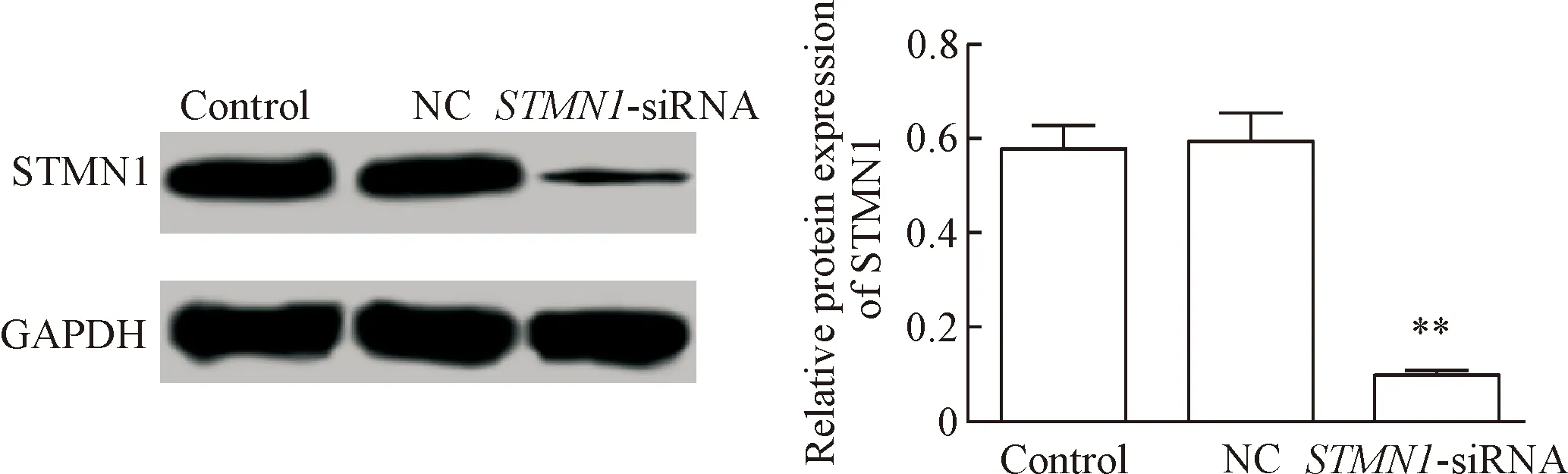
Figure 2. The protein expression of STMN1 in the SiHa cells transfected withSTMN1-siRNA. Mean±SD.n=3.**P<0.01vscontrol group.
图2STMN1在转染STMN1-siRNA细胞中的表达
4 各组细胞活力及凋亡的检测结果
MTT法检测各组细胞活力,流式细胞术检测细胞凋亡,结果显示,与control组比较,STMN1-siRNA组的细胞活力显著降低(P<0.01),凋亡率显著升高(P<0.01),见图3、表2。
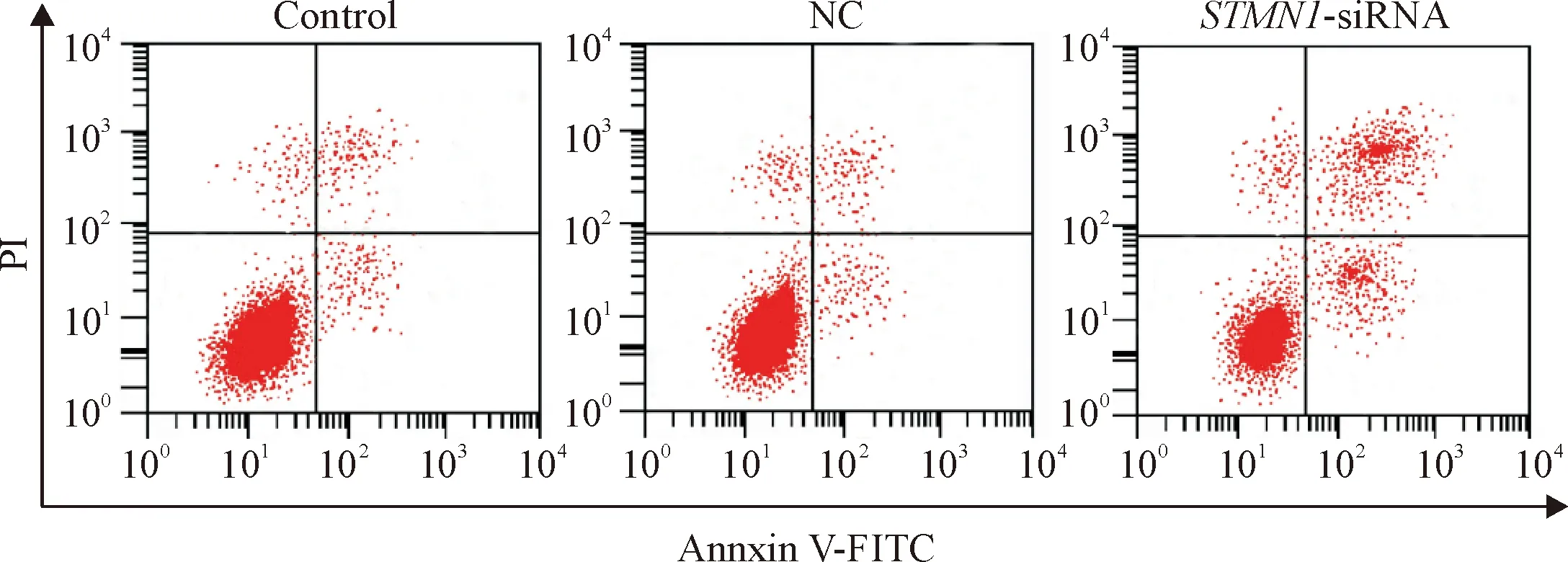
Figure 3. The apoptosis of the cells in each group analyzed by flow cytometry.
图3各组细胞凋亡的流式细胞术分析
表2各组细胞的活力及凋亡率情况
Table 2. The viability and apoptotic rate of the cells in each group (Mean±SD.n=3)
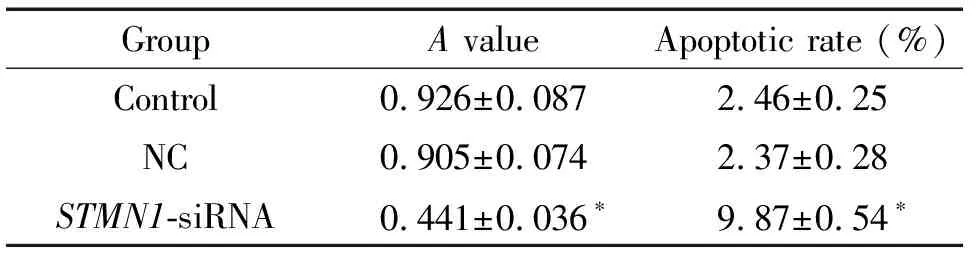
GroupA valueApoptotic rate (%)Control 0.926±0.0872.46±0.25NC0.905±0.0742.37±0.28STMN1-siRNA 0.441±0.036∗9.87±0.54∗
*P<0.05vscontrol group.
5 各组细胞ROS含量的检测结果
DCFH-DA荧光探针检测结果表明,STMN1-siRNA组ROS的含量显著高于control组(P<0.01),见图4。
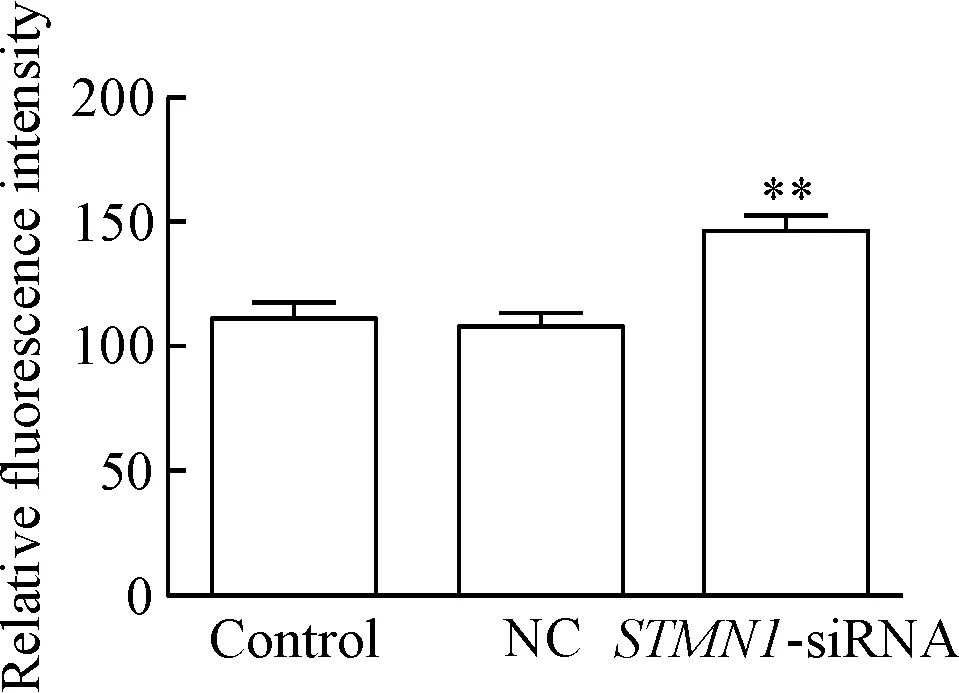
Figure 4. The ROS content in each group. Mean±SD.n=3.**P<0.01vscontrol group.
图4各组细胞的ROS含量
6 各组细胞STAT3信号通路相关蛋白水平的检测结果
Western blot结果表明,STMN1-siRNA组p-STAT3和survivin的蛋白水平均显著低于control组(P<0.01),见图5。
讨 论
STMN1基因定位于人1p36.1染色体,其蛋白是一种能够在细胞有丝分裂及分裂间期使微管的动力学改变的小分子磷蛋白,参与细胞的增殖、微管动力学、细胞运动及周期调控等过程[6]。有研究发现,STMN1与多种肿瘤的临床病理特征及生物学行为密切相关[7]。但关于STMN1对宫颈癌临床病理特征的影响还未清楚,本研究通过Western blot检测到宫颈癌中STMN1的蛋白表达升高,与临床参数间的关系分析发现,STMN1的表达与宫颈癌患者年龄和组织学分型无关,而与临床分期、组织学分化程度及淋巴结转移相关。非小细胞肺癌中STMN1的表达上调,其表达与淋巴结转移相关,而与性别、年龄、TNM分期、肿瘤大小和组织类型无关[8];乳腺癌中STMN1的过表达与有无淋巴结转移相关[9];肉瘤中STMN1的高表达与肿瘤的迁移及复发也存在一定的关系[10]。本研究结果与一些研究者在其它肿瘤中的研究结果是相似的。
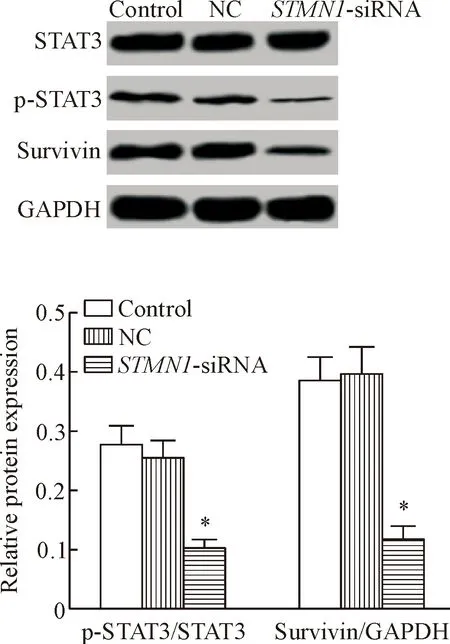
Figure 5. The protein levels of STAT3, p-STAT3 and survivin in each group. Mean±SD.n=3.**P<0.01vscontrol group.
图5各组细胞中STAT3、p-STAT3和survivin的蛋白表达
有研究表明,肿瘤细胞中STMN1参与了细胞增殖、凋亡、侵袭、迁移和分化等过程,是近些年来备受关注的用于肿瘤检测、预防和治疗的标志基因[11]。白血病细胞中抑制STMN1的表达可降低细胞在活体中的致瘤特性[12]。STMN1对宫颈癌细胞增殖凋亡的影响还未清楚。RNA干扰技术能使内源性mRNA降解,引起特定基因在转录后发生沉默,具有高度特异性及稳定性,目前在基因功能研究及肿瘤治疗中得到广泛应用[13]。本研究中通过RNA干扰技术沉默宫颈癌中STMN1基因的表达,检测细胞增殖及凋亡情况,发现STMN1的表达受到抑制后宫颈癌细胞的增殖明显降低,凋亡率增加。这提示STMN1可能是宫颈癌检测、预防和治疗的标志物。
ROS的累积程度可决定细胞的生存状态,适量的累积可促进肿瘤细胞的存活,而过度的ROS累积,可导致细胞的氧化应激损伤,最终导致细胞的损伤乃至死亡,宫颈癌中ROS水平升高可诱导细胞的凋亡[14]。本研究结果发现,抑制STMN1的表达可提高宫颈癌中ROS水平。STAT3是一个新近发现的核转录因子,可通过调控影响细胞增殖、凋亡、分化和生存相关的基因而促进肿瘤的增殖、血管生成,并阻滞细胞的凋亡,呈现出强的致癌作用[15-16]。目前在多种肿瘤中发现STAT3蛋白的异常激活[17]。这也提示STAT3可能是肿瘤治疗的靶点。有研究指出,下调STAT3可降低宫颈癌细胞的增殖,促进细胞的凋亡[18]。作为一个癌基因,STAT3本身并不引起癌变,而是通过激活影响凋亡的survivin、细胞周期的cyclin D1等靶基因而诱导肿瘤的发生[19]。本研究发现宫颈癌中STMN1的表达受到抑制后,磷酸化的STAT3及survivin的表达降低。这说明STMN1对宫颈癌细胞的影响可能通过提高ROS水平及STAT3信号表达实现。
综上所示,STMN1在宫颈癌中高表达,其表达与宫颈癌患者年龄和组织学分型无关,而与临床分期、组织学分化程度及淋巴结转移相关,抑制STMN1的表达后宫颈癌细胞增殖受到抑制,凋亡增加,ROS水平升高,STAT3信号通路表达受到抑制。本研究初步证实了STMN1对宫颈癌临床病理特征及生物学特性的影响,并进一步研究了可能的分子机制。接下来的实验将致力于宫颈癌的其它生物学特性,以期为STMN1在宫颈癌的诊治提供理论帮助。
[参 考 文 献]
[1] Wen SY, Lin Y, Yu YQ, et al. miR-506 acts as a tumor suppressor by directly targeting the hedgehog pathway transcription factor Gli3 in human cervical cancer[J]. Oncogene, 2015, 34(6):717-725.
[2] Kuang XY, Jiang HS, Li K, et al. The phosphorylation-specific association of STMN1 with GRP78 promotes breast cancer metastasis[J]. Cancer Lett, 2016, 377(1):87-96.
[3] 廖 巧, 赵玉茹, 屈 彪, 等. STMN1 与 TUBB3 蛋白在胃癌和癌旁组织中的表达与临床意义[J]. 中国临床药理学与治疗学, 2016, 20(12):1335-1339.
[4] Wu W, Tan XF, Tan HT, et al. Unbiased proteomic and transcript analyses reveal that stathmin-1 silencing inhibits colorectal cancer metastasis and sensitizes to 5-fluorouracil treatment[J]. Mol Cancer Res, 2014, 12(12):1717-1728.
[5] Meng ZJ, Tao K. Enhancement of chemosensitivity by stathmin-1 silencing in gastric cancer cellsinsituandinvivo[J]. Oncol Res, 2016, 23(1-2):35-41.
[6] He X, Liao Y, Lu W, et al. Elevated STMN1 promotes tumor growth and invasion in endometrial carcinoma[J]. Tumor Biol, 2016, 37(7):9951-9958.
[7] Wang Z, He R, Xia H, et al. Knockdown ofSTMN1 enhances osteosarcoma cell chemosensitivity through inhibition of autophagy[J]. Oncol Lett, 2017, 13(5):3465-3470.
[8] Zou ZQ, Du YY, Sui G, et al. Expression of TS, RRM1, ERCC1, TUBB3 and STMN1 genes in tissues of non-small cell lung cancer and its significance in guiding postoperative adjuvant chemotherapy[J]. Asian Pac J Cancer Prev, 2015, 16(8):3189-3194.
[9] Obayashi S, Horiguchi J, Higuchi T, et al. Stathmin1 expression is associated with aggressive phenotypes and can-cer stem cell marker expression in breast cancer patients[J]. Int J Oncol, 2017, 51(3):781-790.
[10] Li J, Hu G, Kong F, et al. Elevated STMN1 expression correlates with poor prognosis in patients with pancreatic ductal adenocarcinoma[J]. Pathol Oncol Res, 2015, 21(4):1013-1020.
[11] Lu W, Hu Y, Ma Q, et al. miR-223 increases gallbladder cancer cell sensitivity to docetaxel by downregulating STMN1[J]. Oncotarget, 2016, 7(38):62364-62376.
[12] Machado-Neto JA, de Melo Campos P, Favaro P, et al. Stathmin 1 is involved in the highly proliferative phenotype of high-risk myelodysplastic syndromes and acute leukemia cells[J]. Leuk Res, 2014, 38(2):251-257.
[13] 黄生辉, 李建华, 张玮琼, 等. 沉默TREM-2 对类风湿关节炎成纤维样滑膜细胞迁移和侵袭的影响[J]. 中国病理生理杂志, 2016, 32(1):134-139.
[14] Deorukhkar A, Ahuja N, Mercado AL, et al. Zerumbone increases oxidative stress in a thiol-dependent ROS-independent manner to increase DNA damage and sensitize colorectal cancer cells to radiation[J]. Cancer Med, 2015, 4(2):278-292.
[15] Siveen KS, Sikka S, Surana R, et al. Targeting the STAT3 signaling pathway in cancer: role of synthetic and natural inhibitors[J]. Biochim Biophy Acta, 2014, 1845(2):136-154.
[16] 李 逦, 王 纯, 卢宏达. 马钱子碱通过抑制 IL-6/STAT3 信号通路诱导结肠癌 SW480 细胞凋亡[J]. 中国病理生理杂志, 2016, 32(6):998-1003.
[17] Zhang P, Li H, Yang B, et al. Biological significance and therapeutic implication of resveratrol-inhibited Wnt, Notch and STAT3 signaling in cervical cancer cells[J]. Genes Cancer, 2014, 5(5-6):154-164.
[18] Guo J, Kim D, Gao J, et al. IKBKE is induced by STAT3 and tobacco carcinogen and determines chemosensitivity in non-small cell lung cancer[J]. Oncogene, 2013, 32(2):151-159.
[19] Zhang B, Lu Z, Hou Y, et al. The effects of STAT3 and Survivin silencing on the growth of human bladder carcinoma cells[J]. Tumor Biol, 2014, 35(6): 5401-5407.
