番石榴叶抑制db/db小鼠肾脏TGF-β1蛋白表达研究*
2018-06-28郭翔宇刘铜华许光远董笑克
段 颖,郭翔宇,刘铜华,孙 文,许光远,董笑克,丁 雷
1.首都医科大学附属北京同仁医院传统医学科 (北京 100730),2.北京中医药大学东方医院内分泌科(北京 100078),3.北京中医药大学养生研究所(北京 100029),4.首都医科大学附属复兴医院中医科(北京 100038),5.北京中医药大学第二临床医学院(北京100078)
糖尿病肾病(Diabetic nephropathy,DN)是糖尿病最常见的微血管并发症之一,DN早期症状比较隐匿,随着病情进展出现进行性蛋白尿和肾功能减退[1],后期发展为终末期肾病(End stage renal disease,ESRD),是糖尿病患者致残、致死的主要原因之一[2]。DN早期病理改变表现为基底膜轻度增厚及系膜基质增生,肾小球滤过率升高和肾小球肥大,后期形成典型的Kimmelstiel-Wilson 结节,肾小球滤过率进行性下降[3]。前期研究中已经发现番石榴叶提取物可以降低血糖,改善胰岛素抵抗[4-5]。但番石榴叶是否有肾脏保护并不清楚。本实验将进一步观察番石榴叶提取物对db/db小鼠肾脏组织TGF-β1蛋白表达的影响,探讨番石榴叶改善肾脏纤维化的作用机制。
材料与方法
1 实验药物 番石榴叶干燥叶片购自沈阳医药集团公司大东公司,由北京中医药大学药学院药物化学实验室提取,提取工艺为:番石榴叶片粉碎后取粗粉1.1kg,用3倍量乙酸乙酯在25℃、超声50MHz的条件下提取10 min,重复共7次,过滤取药渣,用5倍量的乙醇超声提取15min/次,重复4次,留取过滤液,浓缩得浸膏。浸膏与4倍量水制成混悬液,6000 r/min条件下离心15min得上清液1;乙醇提取剩余药渣用5倍量水超声提取40min,重复2次,将两次过滤所得滤液合并,在6000 r/min的条件下离心15min得上清液2,合并上清液1、2,采用改良明胶法去除鞣质,再次过滤后滤液上聚酰胺(100~200 目)柱,依次用水洗脱,洗脱液减压浓缩,制得水浸膏64.07 g。
2 动物与饲养 16只10周龄SPF级雄性C57BLKS/J db/db小鼠,8只C57BLKS/J db/m同窝小鼠作为对照,所有动物均由南京大学模式动物研究所提供。动物在北京中医药大学动物实验中心(SPF级)饲养,饲养条件:温度(23±2)℃、湿度(55±10) %,12/12 h光照黑暗循环,自由摄食饮水,db/db小鼠予高脂饲料(购自北京科澳协力饲料有限公司)喂养,db/m小鼠喂养小鼠全价营养普通饲料(购自北京维通利华实验动物技术有限公司),除实验需要空腹禁食外,其余时间小鼠均自由进食、饮水。
3 试剂与仪器 瑞士罗氏血糖仪及配套试纸;HE试剂盒,北京索莱宝生物科技公司;(30)辣根过氧化物酶标记的兔抗山羊IgG,中杉金桥公司;羊抗兔IgG/HRP,美国Sigma公司;TGF-β1抗体,美国CST公司;低温高速离心机,美国Thermo公司;BX53型光学显微镜,日本OLYMPUS公司。
4 分组与给药 所有动物适应性喂养一周后,根据小鼠体重、血糖,将db/db小鼠采用区组随机法分为番石榴叶提物组和模型组,db/m小鼠设为正常对照组,每组各8只。分组完成后按体表面积换算法分别给药,各组剂量为:番石榴叶提物组 0.11g/(kg·d-1)(相当于生药材2g/kg);正常组、模型组每日灌服等量蒸馏水;每日固定时间灌胃1次,连续12周。
5 标本采集 干预12周后,所有小鼠禁食不禁水12 h,摘眼球取血,离心分离血清-80℃冻存待用;颈椎脱臼法处死,迅速剖取小鼠左侧肾脏,固定于4%多聚甲醛中待用。
6 观察指标及检测方法
6.1 观察小鼠一般情况:观察并记录实验期间各组小鼠精神状态、活动情况、毛色、进食量、饮水量一般情况等,每4周记录一次体重变化。
6.2 血糖测定:分别检测各组大鼠入组前及灌胃第4周、8周、12周时血糖水平,检测前一天禁食不禁水12 h,血糖测定采用断尾检测法。
6.3 肾脏苏木素-伊红(HE)染色:取固定48h后小鼠左侧肾脏,常规石蜡包埋,切片4 μm;HE染色:石蜡切片常规脱蜡至水,苏木素染色,自来水返蓝,伊红染色,1%盐酸-酒精脱色,梯度酒精脱水,中性树胶封片,光镜下观察。
6.4 肾脏免疫组化:4%中性多聚甲醛固定液中肾脏组织石蜡切片,梯度酒精脱蜡至水,0.01%Triton 37℃15min,PBS水洗3次; 抗原修复,3%H2O2孵育15min,正常山羊血清孵育 37℃15min,倾去,I抗(1∶100稀释) 4℃ 过夜;复温,PBS水洗,II抗室温孵育,DAB显色,常规脱水,中性树胶封片,镜下观察,Image-Pro Plus(IPP)软件分图片光密度值。
结 果
1 番石榴叶提取物对db/db小鼠体重的影响 与模型组相比,番石榴叶提取物对第4周db/db小鼠体重无明显影响,可以显著降低小鼠第8周、第12周体重,见表1。
2 番石榴叶提取物对db/db小鼠血糖的影响 与模型组相比,番石榴叶提取物显著降低db/db小鼠第4周、第8周、第12周空腹血糖,见表2。

表1 番石榴叶提取物对db/db小鼠体重的影响(g)
注:与对照组比较,*P<0.05

表2 番石榴叶提取物对db/db小鼠空腹血糖的影响(g)
注:与对照组比较,*P<0.05
3 番石榴叶提取物对db/db小鼠肾脏HE染色的影响 模型组小鼠肾脏组织可见肾小球扩张、球囊壁黏连,同时伴有毛细血管扩张、球旁器增生以及系膜细胞增生、并可见不同程度的肾小管扩张、颗粒样变性等病理改变;番石榴叶提取物组上述病理变化均有改善(图1)。
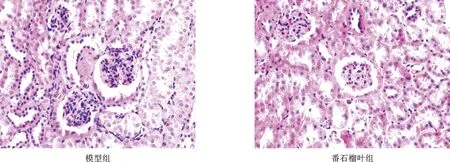
图1 番石榴叶提取物对db/db小鼠肾脏HE染色的影响(×400)
4 番石榴叶提取物对db/db小鼠肾脏免疫组化TGF-β1蛋白表达的影响 根据小鼠肾脏TGF-β1蛋白免疫组织化学染色图像分析平均光密度,结果显示,与模型组相比,经过12周治疗,番石榴叶提取物组TGF-β1蛋白表达显著降低,(P<0.05),见表3(图2)。
表3 番石榴叶提取物对db/db小鼠肾脏免疫组化TGF-β1蛋白表达的影响
注:与模型组比较,*P<0.05
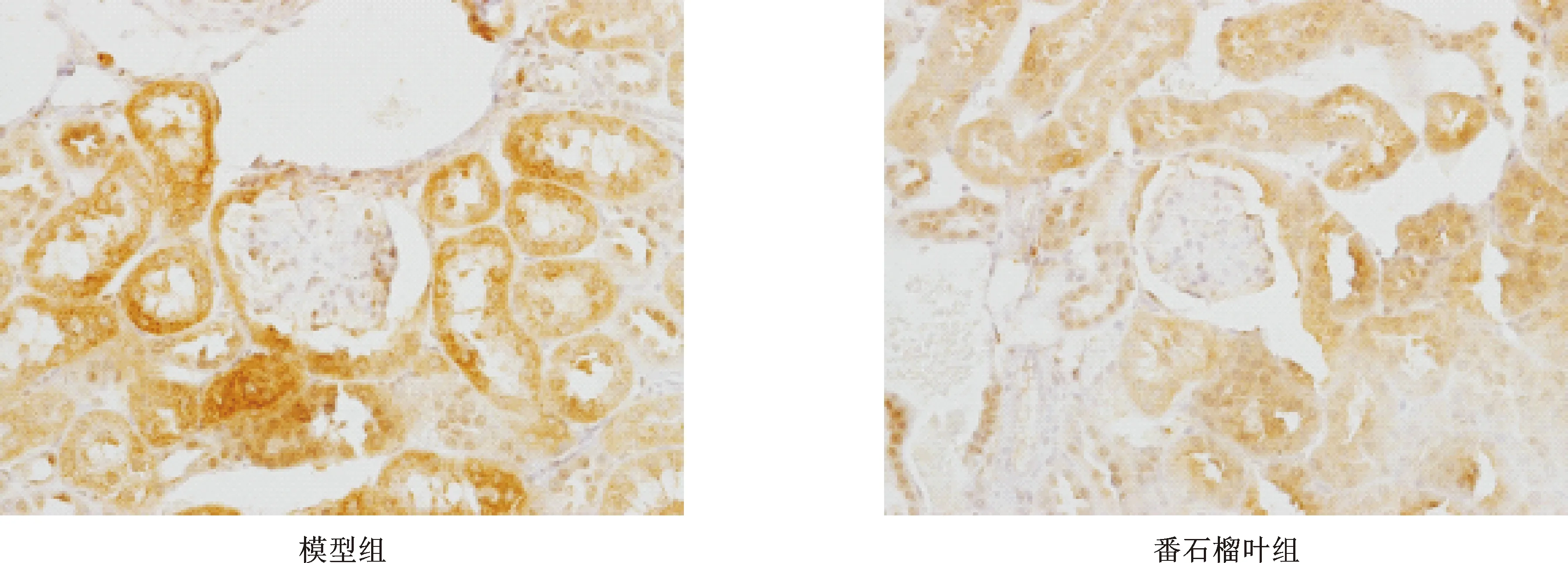
图2 番石榴叶提取物对db/db小鼠肾脏TGF-β1免疫组化表达的影响(×400)
讨 论
番石榴叶是桃金娘科植物番石榴(Psidium guajava Linn.)的叶及带叶嫩枝,在我国主要在福建、台湾、广东、广西、四川等地区栽培,具有燥湿健脾,清热解毒的功效,是民间用于治疗泄痢腹痛、疔疮肿毒的常用药,近年来发现番石榴叶可以治疗糖尿病。现代药理研究显示番石榴叶中的黄酮类、酚酸类,三萜和倍半萜类等化学成分具有降血糖的活性[6]。本课题组在前期的研究中发现番石榴叶水提物可以显著降低SHRSP.ZF大鼠血糖,在机制研究中发现,番石榴叶水提物通过上调肝脏脂联素受体表达,激活AMPK-PPAR-α信号转导通路,促进肝脏游离脂肪酸氧化抑制肝脏糖异生,降低空腹血糖;激活肌肉组织IRS-PI3K-AKT信号转导通路,促进骨骼肌GLUT4从细胞浆转运至细胞膜,降低餐后血糖[4-5]。
理想的动物模型是研究和防治糖尿病及其并发症的基础,db/db小鼠是目前使用最广泛的自发型肥胖型2型糖尿病模型[7]。db/db小鼠4 号染色体上的瘦素受体(LepRdb/db)缺失,影响下丘脑摄食中枢,导致食欲过盛,引起肥胖、高脂血症、高胰岛素血症、胰岛素抵抗以及糖尿病,该模型同时也是研究DN肾脏早期形态学变化的良好模型,db/db小鼠在第4周即可表现出早期的肾脏病变,肾脏病理改变主要为系膜细胞增生、基质扩张以及基底膜增厚,随着病程进展db/db小鼠肾脏组织学呈进行性变化,8周开始出现蛋白尿,14-18周可出现肾小球细胞肥大、空泡变性、肾小管管腔变窄、肾间质小血管玻璃样变等病理改变,20周以后可出现中到重度蛋白尿,病理表现为肾小球节段性硬化[8]。
氧化应激是糖尿病肾病发生和发展的重要病理生理基础之一。高糖诱导肾小球系膜细胞产生过多的活性氧簇(ROS),脂质过氧化作用增强,丙二醛(MDA)蓄积和过氧化物歧化酶(SOD)减少[9],导致蛋白质非酶糖化、多元醇通路活化、DAG-PKC通路激活,导致与肾纤维化相关的TGF-β表达增加[10],病理上可表现为肾小球和肾小管基底膜增厚,肾小球硬化和肾小管-间质纤维化等,临床上表现为尿蛋白增加。TGF-β1是最重要的促纤维化细胞因子,TGF-β1与肾小管上皮细胞上的TGF-β受体结合,可以激活包括Smad2,Smad3和Smad4在内的多种转录因子,刺激上皮细胞产生胶原、纤连蛋白、层粘蛋白等成分[11-12],促导致肾脏组织纤维化。
本实验研究结果显示,从治疗第4周开始,番石榴叶提取物开始表现出显著的降低db/db小鼠体重和空腹血糖的作用,这个结果和我们课题组之前的研究结果是一致的。经过12周的治疗,番石榴叶提取物显著改善db/db小鼠肾脏肾小球扩张、球囊壁黏连、肾小球系膜细胞增生、肾小球毛细血管扩张、球旁器增生、肾小管扩张颗粒样变性等肾脏组织病理学改变。肾脏组织TGF-β1免疫组化蛋白定量测定结果提示,番石榴叶提取物具有显著降低了TGF-β1蛋白表达的作用。以上结果可以得出,对肾脏TGF-β1免疫组化蛋白表达的降调节,是番石榴叶提取物肾脏保护的作用机制之一。
[1] Erratum regarding US renal data system 2016 annual data report: epidemiology of kidney disease in the united states[J]. Am J Kidney Dis,2017,69(5): 712.
[2] Zelnick LR,Weiss NS,Kestenbaum BR,etal. Diabetes and CKD in the United States Population[J]. Clin J Am Soc Nephrol,2017,12(12):1984-1990.
[3] Balafa O,Liapis G. Nodular glomerulosclerosis: not always diabetic nephropathy[J]. Minerva Med,2017,109(3):248-250.
[4] Guo X,Yoshitomi H,Gao M,etal. Guava leaf extracts promote glucose metabolism in SHRSP.Z-Leprfa/Izm rats by improving insulin resistance in skeletal muscle[J]. BMC Complement Altern Med,2013,1:13-52.
[5] Guava leaf extracts alleviate fatty liver via expression of adiponectin receptors in SHRSP.Z-Leprfa/Izm rats.Guava leaf extracts alleviate fatty liver via expression of adiponectin receptors in SHRSP.Z-Leprfa/Izm rats[J]. Nutr Metab (Lond),2012,20: 9-13.
[6] 郭翔宇,刘铜华,朱寅荻,等.番石榴叶化学成分及其治疗2型糖尿病研究进展[J]. 世界科学技术—中医药现代化,2014,16(5): 1029-1034.
[7] Tesch GH,Lim AK. Recent insights into diabetic renal injury from the db/db mouse model of type 2 diabetic nephropathy [J]. Am J Physiol Renal Physiol,2011,300(2): F301-F310.
[8] Kitada M,Ogura Y,Koya D. Rodent models of diabetic nephropathy: their utility and limitations [J]. Int J Nephrol Renovasc Dis,2016,14(9):279-290.
[9] Hong YA,Lim JH,Kim MY,etal. Extracellular superoxide dismutase attenuates renal oxidative stress through the activation of adenosine monophosphate-activated protein kinase in diabetic nephropathy [J]. Antioxid Redox Signal,2017,26(17):1543-1561.
[10] Wilson PG,Thompson JC,Yoder MH,etal. Prevention of renal apoB retention is protective against diabetic nephropathy: role of TGF-β inhibition [J]. J Lipid Res,2017,58(12):2264-2274.
[11] Hills C, Price GW, Wall MJ,etal. Transforming growth factor beta 1 drives a switch in connexin mediated cell-to-cell communication in tubular cells of the diabetic kidney[J]. Cell Physiol Biochem,2018,45(6):2369-2388.
[12] Yoon JJ, Lee YJ, Namgung S,etal. Samchuleum attenuates diabetic renal injury through the regulation of TGF-β/Smad signaling in human renal mesangial cells[J]. Mol Med Rep. 2018,17(2):3099-3108.
[13] Tang F,Hao Y,Zhang X,Qin J. Effect of echinacoside on kidney fibrosis by inhibition of TGF-β1/Smads signaling pathway in the db/db mice model of diabetic nephropathy [J]. Drug Des Devel Ther,2017 Sep 21;11:2813-2826.
[14] Huang K,Gao X,Wei W. The crosstalk between Sirt1 and Keap1/Nrf2/ARE anti-oxidative pathway forms a positive feedback loop to inhibit FN and TGF-β1 expressions in rat glomerular mesangial cells[J].Exp Cell Res,2017,361(1): 63-7.
