单增李斯特菌感染TNF-α人源化小鼠模型的建立与应用
2018-06-26孙萌萌徐艳峰占玲俊
唐 军,孙萌萌,徐艳峰,占玲俊
(中国医学科学院医学实验动物研究所,国家中医药管理局人类疾病动物模型三级实验室,卫计委人类疾病比较医学重点实验室,北京 100021)
肿瘤坏死因子(TNF-α)是在风湿性关节炎、克罗恩病等慢性炎症性疾病致病机制中起主要作用的一种促炎性因子。在类风湿关节炎和强直性脊柱炎的临床治疗上,英夫利昔单抗和阿达木单抗等TNF-α抑制剂是疗效最为显著的一类药物。但这些药物的使用也会带来一些风险,在治疗中需要特别注意。比如患者发生严重感染和其他机会性感染的风险增加,包括结核分枝杆菌、单增李斯特菌等引起的感染[1-2]。在对这一类药物及其仿制药进行临床前研究的时候,有必要对这些潜在的不良反应进行评估[3]。作为一种在自然环境中分布广泛的致病菌,单增李斯特菌往往对免疫功能低下的人群如新生儿、孕妇和免疫功能缺陷者等造成威胁[4]。我们通过建立一种单增李斯特菌感染的TNF-α人源化小鼠模型,为评价TNF-α单抗类药物治疗引起的单增李斯特菌感染风险提供了一种研究模式,并应用该模型对阿达木单抗进行了初步评价。
1 材料与方法
1.1 实验动物
实验用TNF-α人源化小鼠12只,购于百奥赛图公司[SCXK(京)2015-0008],是将C57BL/6小鼠17号染色体上Tnf基因用人TNF基因进行原位替换,从而使人TNF基因在该品系小鼠上表达。野生型C57BL/6,6只,购于维通利华公司[SCXK(京)2012-0001]。实验动物均为SPF级,雌性,14周龄,体重22~24 g。动物饲养及实验在中国医学科学院医学实验动物研究所[SYXK(京)2015-0035]ABSL-2实验室开展。动物实验方案经研究所实验动物管理和使用委员会(IACUC)批准,批准号为ILAS-PL-2015-014。
1.2 实验材料
单核增生李斯特菌,编号1.10753(ATCC编号19115),来源于中国普通微生物菌种保藏管理中心(CGMCC);阿达木单抗(adalimumab),艾伯维公司;PALCAM选择性培养基(CM509 A),购自北京陆桥;含0.6%酵母浸膏的胰酪胨大豆肉汤TSB-YE(CM501 A),购自北京陆桥。
1.3 实验方法
1.3.1菌液制备和动物感染
向菌种安瓿瓶中加入0.5 mL TSB-YE培养基,充分溶解后全部加入7 mL TSB-YE培养基中37℃过夜培养。复苏增菌两次后,进行连续稀释,然后均匀涂布于PALCAM培养基上,培养24~48 h后对菌落进行计数,菌落为浅绿色,中心凹陷,菌落周围有黑色的水解环,计算菌液浓度(CFU/mL)。增菌后的菌液立刻置于4℃保存,动物感染时将原菌液用生理盐水连续稀释一定比例后取200 μL进行腹腔注射。注射所用菌液再次涂布平皿,培养计数后对接种菌量进行修正,实际注射量为每只1×104CFU。
1.3.2动物分组
动物分为三组,每组6只:野生型C57BL/6小鼠感染对照组;TNF-α人源化小鼠感染对照组;TNF-α人源化小鼠adalimumab组。对照组小鼠感染前24 h 静脉注射生理盐水200 μL,adalimumab组小鼠则按照10 mg/kg在感染前24 h静脉注射阿达木单抗200 μL。
1.3.3检测及分析方法
小鼠感染1 d(n=3)及4 d(n=3)后进行解剖,取肝及脾组织。一部分进行组织匀浆后,连续稀释并均匀涂布于PALCAM平板上,培养24~48 h。计数并计算组织荷菌量。另一部分置于10%福尔马林溶液中固定,石蜡包埋后切片进行病理检测。苏木素-伊红(HE)染色:切片脱蜡,经苏木素染色,1%盐酸酒精分化,氨水反蓝后伊红染色,脱水透明封片,然后观察组织相应的病理变化。免疫组织化学染色:组织切片脱蜡,使用柠檬酸钠进行抗原修复,封闭后加一抗Listeriamonocytogenesantibody(ab35132,Abcam)、F4/80 antibody(565409,BD)、TNF-α antibody(ab9635,Abcam)、CD45R antibody(550286,BD),4℃过夜后加二抗,DAB显色,苏木素复染后冲洗,脱水透明封片。切片经滨松NanoZoomer S60进行数字扫描后,使用NDP软件进行相关分析。
1.4 统计学方法
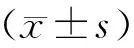
2 结果
2.1 病理HE染色
感染后第1天,各组脾组织的病理变化不明显,肝组织均出现肝细胞水肿,无其他特异性病变,但各组间差异无显著性(图1)。肝的病理改变表明单增李斯特菌已经侵袭进入这一重要的靶器官,并造成了一定的病理损伤。但在这一时间点病变较为轻微,尚不典型,各组间差异不明显,没有观察到adalimumab干预对疾病的早期影响。

注:(1)野生型小鼠对照组;(2)TNF-α人源化小鼠对照组;(3)TNF-α人源化小鼠adalimumab干预组。图1 感染1 d后组织病理变化情况(×10)Note. (1) A WT control mouse. (2) A control TNF-α mouse. (3) A TNF-α mouse injected with adalimumab.Fig.1 Pathological changes of the mouse liver and spleen at one day after infection
感染后第4天,各组肝组织均出现明显的病理变化,为肝细胞坏死伴随炎性细胞浸润,且各组之间存在显著差异。这种广泛分布的微脓肿病变是李斯特菌病的一种典型病理表现,其数量和大小反映了疾病的严重程度。如图2A所示,野生型组C57BL/6小鼠肝中出现点状的微脓肿,数量较少且面积小。TNF-α人源化小鼠对照组表现与野生型组类似,而adalimumab组则表现为面积较大且数量较多的微脓肿。我们统计了每只小鼠肝数字化切片中全部微脓肿的数量和大小,如图2B所示。各组间比较发现adalimumab组中微脓肿半径显著大于TNF-α人源化小鼠对照组及野生型组对照(图2C)。这表明adalimumab干预显著加重了单增李斯特菌感染小鼠的肝脏病理损伤。
2.2 组织荷菌量
感染后第4天,取各组动物肝和脾,称重后测定其单增李斯特菌的荷菌量。结果显示,人源化TNF-α小鼠在肝脾组织中的荷菌量与野生型C57BL/6小鼠差异没有显著性。而adalimumab组的小鼠在以上两种组织中的荷菌量均显著高于野生型对照组和TNF-α人源化小鼠组(图3)。
从病理变化和组织荷菌量的差异,可以看出TNF-α对于宿主抵抗单增李斯特菌的免疫具有重要作用,TNF-α单抗干预后宿主疾病进展显著加重。此外,人TNF-α替代小鼠TNF-α之后,没有对宿主抵抗李斯特菌的免疫产生显著性的影响。
2.3 免疫组化分析
为了观察TNF-α受抗体阻断后,对各类免疫细胞在感染位点分布的影响,进一步检测了组织中F4/80和CD45R[5]的表达分布情况。与荷菌量检测结果一致,adalimumab组小鼠肝微脓肿内可见较多的单增李斯特菌存在。此外,该组病灶及周围也存在较高水平的TNF-α表达。通过巨噬细胞表面标记分子F4/80的分布可见,巨噬细胞也在微脓肿附近呈聚集分布,TNF-α单抗干预未对巨噬细胞的募集产生显著影响。在脾内,CD45R的表达分布在各组内也未见显著差异(图4)。
从以上结果可见,adalimumab作为在临床广泛使用的重要药物,对巨噬细胞、B细胞等重要免疫细胞在宿主对单增李斯特菌感染应答时的分布并未产生显著干扰。但TNF-α单抗的干预确实加重了TNF-α人源化小鼠中单增李斯特菌感染引起的疾病。
3 讨论
本研究建立了一种单增李斯特菌感染的TNF-α人源化小鼠模型,并应用该模型初步评价了阿达木单抗对单增李斯特菌感染风险的影响。应用阿达木单抗阻断体内TNF-α作用,加剧了感染单增李斯特菌的TNF-α人源化小鼠的组织病理病变,增加了组织中的荷菌量,这说明TNF-α在宿主抵抗单增李斯特菌感染中起着比较重要的作用,使用TNF-α单抗类药物将显著增加患李斯特菌病的风险。
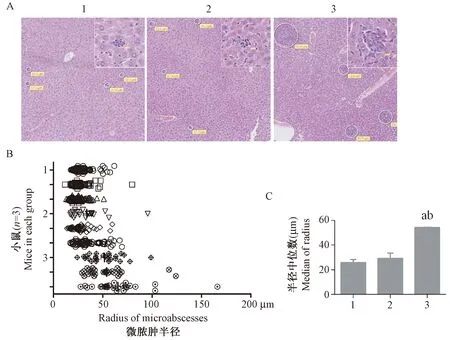
注:(A)HE染色后镜下各组肝中微脓肿形态(大图×10,小图×40);(B)各组每只小鼠肝切片中观察到的微脓肿半径分布,图中各点表示单个微脓肿;(C)各组肝中微脓肿半径统计;(1)野生型小鼠对照组;(2)TNF-α人源化小鼠对照组;(3)TNF-α人源化小鼠adalimumab干预组;与野生型小鼠对照组比较,aP< 0.05;与TNF-α人源化小鼠对照组比较,bP< 0.05。图2 感染4天后各组间肝微脓肿差异Note. (A) The morphology of microabscesses in liver tissues after infection. HE staining (×10, ×40). (B) The radius distribution of microabscesses observed in the liver tissues of each mouse. Each spot indicates single microabscess. (C) The median radius and SD of microabscesses in the liver tissues. (1) WT mouse control group. (2) TNF-α mouse control group. (3) TNF-α humanized mouse group injected with adalimumab. Compared with the WT control group,aP< 0.05. Compared with the TNF-α mice control group,bP< 0.05.Fig.2 Comparison of microabscesses in the mouse liver tissues at 4 days after infection
从模型运用方面,本研究也初步证明了TNF-α人源化小鼠模型在TNF-α单抗类药物的临床前研究中具有比较广泛的应用前景。本研究中使用的阿达木单抗是临床应用的全人源化单抗,也能与小鼠TNF-α交叉反应。但另一种单抗药物英夫利昔(infliximab)则仅可特异性结合人TNF-α。对于英夫利昔及其他新的人TNF-α特异性单抗药物的相关研究来说,使用TNF-α人源化小鼠模型是非常必要的。
既保证对慢性炎症性疾病的显著疗效,又保留对机会致病菌的保护性免疫应答能力,是TNF-α拮抗药物研发的重要方向。例如,研究跨膜型和分泌型TNF-α在功能上的区别和联系对于精确调控宿主免疫具有重要意义,同时也是更精确的TNF-α拮抗药物研发的重要基础[6-8]。鉴于小鼠TNF-α与人TNF-α功能上的显著差异[9],不仅在对风湿性疾病的治疗效果上,还有在对患者发生机会性感染的风险评估上,TNF-α人源化小鼠模型的研究对TNF-α拮抗药物研发都具有重要意义。

注:(1)野生型小鼠对照组;(2)TNF-α人源化小鼠对照组;(3)TNF-α人源化小鼠adalimumab干预组;与野生型小鼠对照组比较,aP< 0.001;与TNF-α人源化小鼠对照组比较,bP< 0.01。图3 感染4 d后各组间组织荷菌量差异Note. (1) WT mouse control group. (2) TNF-α humanized mouse control group. (3) TNF-α mouse injected with adalimumab group. Compared with the WT mouse control group,aP< 0.001. Compared with the TNF-α mouse control group,bP< 0.01.Fig.3 Comparison of bacterial load in the mouse liver and spleen tissues at 4 days after infection

注:(1)野生型小鼠对照组;(2)TNF-α人源化小鼠对照组;(3)TNF-α人源化小鼠adalimumab干预组。图4 感染4 d后肝和脾微脓肿周围的改变(免疫组化染色)Note. (1) WT mouse control group. (2) TNF-α humanized mouse control group. (3) TNF-α mouse injected with adalimumab group.Fig.4 Changes of microabscesses in the liver and spleen tissues at 4 days after infection. Immunohisitochemical staining
