金线莲醇提物在斑马鱼中降血糖效果的探究
2018-06-26许璟瑾张文娟陈志永李秀敏潘裕添王兵丽欧一新
许璟瑾,张文娟,陈志永,李秀敏,潘裕添,王兵丽,欧一新,2,薛 钰,3*
(1.闽南师范大学菌物产业工程技术中心,福建 漳州 363000; 2.上海交通大学,生命科学技术学院,上海 200240;3.膜生物学国家重点实验室,北京 100101)
糖尿病(diabetes mellitus, DM)是一种由遗传因素和环境因素互相作用引起常见的严重代谢性疾病。其主要病因是源于体内胰岛素信号通路受损或是胰岛素靶点的敏感性降低,导致糖代谢途径异常从而引起血液中葡萄糖含量增加,临床上以高血糖为主要的生理病征,同时伴随着尿糖、胰岛素缺乏或作用下降。糖尿病分为 I 型糖尿病和 II 型糖尿病,胰岛素绝对缺失、必需依赖外源性胰岛素延续生命的患者归为 I 型糖尿病,大部分不依赖外源性胰岛素延续生命者归为 II 型糖尿病[1-4]。在生物体内维持血糖平衡有四个非常重要的基因。胰岛素(preproinsulin, insulin)是调节血糖平衡的关键因子[5], 胰岛素由胰腺中的β细胞合成, 通过结合位于脂肪细胞、肌肉细胞等细胞上的胰岛素受体,调控葡萄糖转运体从胞浆移动至细胞膜上,从而促使细胞对葡萄糖的摄取[6-8]。磷酸烯醇式丙酮酸羧激酶1(phosphoenolpyruvatecarboxykinase1,pck-1)与糖原异生、甘油异生、肥胖和糖尿病等代谢疾病密切相关[9],在维持葡萄糖的稳态中起关键的作用[10]。胰腺十二指肠同源盒基因1(pancreaticandduodenalhomeobox1,pdx-1)大多表达于胰岛内分泌胰岛素的β细胞和分泌生长抑素的δ细胞中[11],在调节胰腺发育和分化中起着非常重要的作用[12-13]。神经分化因子-1(neuronaldifferentiation1,neurod-1)对胰岛β细胞的发育及生理功能至关重要[14]。近年来,随着生活水平的提高和老龄化进程的加速, 糖尿病患病率呈快速上升趋势, 糖尿病尤其II型糖尿病已经成为继癌症、心脑血管疾病之后的严重威胁人类健康的第三大疾病[15-16]。目前,还没有一种药物能完全治愈糖尿病,很多西药只能控制血糖,且有副作用。相比于西药,中草药不仅能降血糖,还能防止慢性并发症的发生,有些中草药,例如肉桂含有黄烷醇多酚抗氧化物质具有刺激胰岛β细胞分泌胰岛素,降低胰岛素抵抗等功能。因此中草药在治疗糖尿病方面具有非常好的前景。
金线莲(Anoectochilusroxburghii(Wall.)Lindl.)又名金线兰,为兰科(Orchidaceae),开唇兰属(Anoectochilus)多年生珍稀药用植物。主要分布于中国福建、台湾以及东南亚地区[17-18]。有初步研究表明金线莲全草水煎液具有较好的降血糖作用[19],但是降血糖的活性成分和作用机理还不明确。因此本研究就地取材,对福建金线莲具有降血糖作用的组分进行了筛选,并且进行了初步的机理研究。
斑马鱼基因总数(约23 500个)与人类相当,神经系统、心血管系统、内脏器官、血液以及视觉系统的发育过程在分子水平上与人的一致性高达85%,便于将实验数据与人类的资料相比较[20-23],并且具有体型小、易饲养等优点。所以本研究利用斑马鱼筛选金线莲降血糖活性组分,通过检测四个与糖代谢相关基因在金线莲醇提物处理后的表达与高糖模型作对比,来探究金线莲降血糖的初步机理。
1 材料和方法
1.1 实验动物
5月龄性成熟TU品系斑马鱼(Daniorerio),雌雄各15条,斑马鱼体长3~4 cm,由清华大学孟安明课题组惠赠,根据Westerfield[24]方法在闽南师范大学菌物产业工程技术中心斑马鱼实验室繁殖培育。
实验前1 d,挑选已达性成熟的斑马鱼放置于交配缸内,将雌雄鱼用隔板分开,第2天清晨将隔板拔掉让其交配产卵,待胚胎受精30 min后收集受精卵于含有Holfreter水的培养皿中,28℃恒温培养。
1.2 主要试剂及仪器
福建金线莲(闽南师范大学菌物产业工程技术中心培植);丙三醇(西陇化工);多聚甲醛(Sigma);PBS(Sigma)3300型高速离心机(Kubota);HH-2数显恒温水浴锅(金坛市科析仪器有限公司);AUY320日本岛津电子分析天平(上海仪田精密仪器有限公司);小型离心机(Tiangen);Nikon SMZ18体式荧光显微镜(尼康);辅理善越捷型血糖仪(Abbott Diabetes Care)。
1.3 实验方法
1.3.1金线莲组分的分离与提取
准确称量1 kg新鲜的金线莲全草,按料液比1∶4加入蒸馏水,粉碎,80℃水浴搅拌提取,离心收集上清,沉淀物重复提取两次,把两次提取液合并,上清用旋转蒸发仪蒸发浓缩至一定体积,加入4倍浓缩体积的无水乙醇,放置于4℃冰箱沉淀过夜。第二日通过抽滤把醇沉物和醇提物分离,获得的醇提物蒸发浓缩至一定体积,真空冻干机冻干,获得组分一:金线莲醇提物;醇沉物加蒸馏水溶解滤纸过滤后经过5×103超滤膜超滤,超滤完之后蒸发浓缩至100 mL左右真空冻干机冻干,5×103以上组分为组分二:大分子多糖;5×103以下组分为组分三:小分子多糖。
1.3.2金线莲具有降血糖活性组分的初步筛选
1.3.2.1药物浓度的确定
为探索金线莲各组分对斑马鱼胚胎作用的最佳浓度,进行了以下实验:实验一:受精后的胚胎分为对照组和加药组,对照组用Holfreter水培养至72 h,金线莲醇提物组、大分子多糖组和小分子多糖组的加药浓度梯度都设置为50、100、500、1000 μg/mL。实验二:受精后的胚胎用Holfreter水培养至24 h,分为两组,对照组继续用Holfreter水培养,模型组置换成前期实验已经摸索确定的2%的葡萄糖溶液,斑马鱼幼鱼和成鱼在该浓度葡萄糖溶液胁迫下能引发急性高血糖,处理24 h后即发育至48 h时,将高糖模型组分为五组,每组40枚胚胎,其中模型组继续加2%葡萄糖溶液,另外4组在既加葡萄糖的同时分别加入浓度为50、100、500、1000 μg/mL的金线莲提取物,每种组分都设置该浓度梯度。实验一和实验二每12 h记录胚胎死亡数,挑走死亡的胚胎,更换药物。每次实验做一组平行试验组,将斑马鱼胚胎置于28℃恒温培养箱培养。待胚胎发育至72 h观察其死亡情况和发育情况并详细记录。
1.3.2.2斑马鱼组织液葡萄糖浓度的测定
受精后的胚胎用Holfreter水培养至24 h后分为两组,对照组继续用Holfreter水培养,模型组置换成2%的葡萄糖溶液,胚胎发育至48 h时,将高糖模型组平分为四组,其中一个孔继续加2%的葡萄糖溶液,其他三个孔既加葡萄糖的同时,再分别加入三种金线莲提取物,小分子多糖浓度梯度为30、40、50 μg/mL,大分子多糖和醇提物浓度梯度为300、400、500 μg/mL。由于幼鱼血液太少无法检测血糖浓度,所以待胚胎发育至72 h检测斑马鱼组织液葡萄糖浓度。
将浸泡胚胎的药液吸干,用Holfreter水洗两遍,吸走死胚胎、畸形胚胎以及脱落的外膜,用PBS溶液洗两遍,吸三十枚胚胎转入1.5 mL EP管,把EP管中液体吸干,用2 mL注射器针头在EP管底部扎一小孔,保证胚胎不会离心出EP管,低速离心把EP管中液体甩干,用打火机灼烧EP管,把EP管底部的小孔封住,用研磨棒把斑马鱼研磨均匀,离心取上清滴在血糖试纸检测端,采用辅理善越捷型血糖仪测试并记录。
1.3.3合成相关基因克隆的引物序列
本研究中所有基因序列从http://zfin.org/上下载,引物通过软件Primer 6.0设计。引物序列如表1所示。

表1 糖代谢相关基因的引物序列
1.3.4半定量PCR检测糖代谢相关基因的表达
按照(1.3.2.2)中的方法用金线莲醇提物处理,待胚胎发育至72 h,每组各收集50枚,提total RNA,将RNA反转录成 cDNA,作为半定量PCR的模板,具体操作实验方案参照文献[25]。扩增条件:95℃ 5 min;95℃ 30 s,65℃ 30 s,之后每个循环降低3℃,72℃ 30 s,共6个循环;然后再95℃ 30 s,56℃ 30 s,72℃ 30 s,共26个循环;最后72℃延伸10 min;16℃保存1 h。部分条件可以微调。
1.3.5整胚原位杂交实验试剂与方法
原位杂交中所用探针的制备方法,原位杂交所需要的试剂的配制方法和具体的操作步骤参照文献[25]。
2 结果
2.1 金线莲三种提取物作用斑马鱼胚胎浓度的确定
将0.75 h的野生型胚胎加入不同组分的金线莲提取物,培养至72 h,期间观察统计胚胎发育及死亡情况,其结果如图1 A所示:加入小分子多糖组分在1000 μg/mL和500 μg/mL的浓度下,死亡率是100%;在100 μg/mL时胚胎死亡率明显降低,但发育严重延缓。金线莲大分子多糖组和醇提物组在1000 μg/mL浓度时,胚胎死亡率是100%,500 μg/mL浓度下胚胎致死率较低,且发育正常。将发育至24 h的胚胎加入2%葡萄糖溶液胁迫建立高糖模型,48 h维持高糖的情况下加入不同组分的金线莲提取液培养至72 h,胚胎发育状况及死亡情况如图1B所示:加入小分子多糖组分在1000 μg/mL和500 μg/mL的浓度下,死亡率是100%;浓度在100 μg/mL时虽然胚胎死亡率较低但是胚胎发育严重延缓,浓度在50 μg/mL时胚胎发育正常高糖模型下,金线莲大分子多糖和醇提物在1000 μg/mL浓度时,胚胎死亡率是100%,500 μg/mL浓度下比只加金线莲大分子多糖和醇提物的死亡率略微升高(与图1A 500 μg/mL时相比),且胚胎发育正常。综合以上两部分实验结果,本研究设置小分子多糖实验浓度梯度设为30、40、50 μg/mL。金线莲大分子多糖和醇提物实验梯度设为300、400、500 μg/mL。
2.2 斑马鱼幼鱼组织液葡萄糖浓度的测定
按照(1.3.2.2)中的方法用三种金线莲提取物分别处理斑马鱼胚胎,待胚胎发育至72 h,采用(1.3.2.2)中的测血糖方法筛选出具有降糖作用的金线莲组分。结果如表2所示:模型组即高糖组的幼鱼组织液葡萄糖浓度相比于空白对照显著升高,加入不同浓度小分子多糖的加药组,幼鱼组织液葡萄糖浓度相对于高糖组基本上没有降低;不同浓度的大分子多糖处理后的幼鱼组织液葡萄糖浓度反而有升高的趋势;只有加入醇提物后幼鱼组织液葡萄糖浓度有明显降低,并且随着醇提物浓度的升高,降糖效果越明显。由此得出初步结论:金线莲小分子多糖和大分子多糖没有降血糖效果,醇提物具有显著降血糖效果。
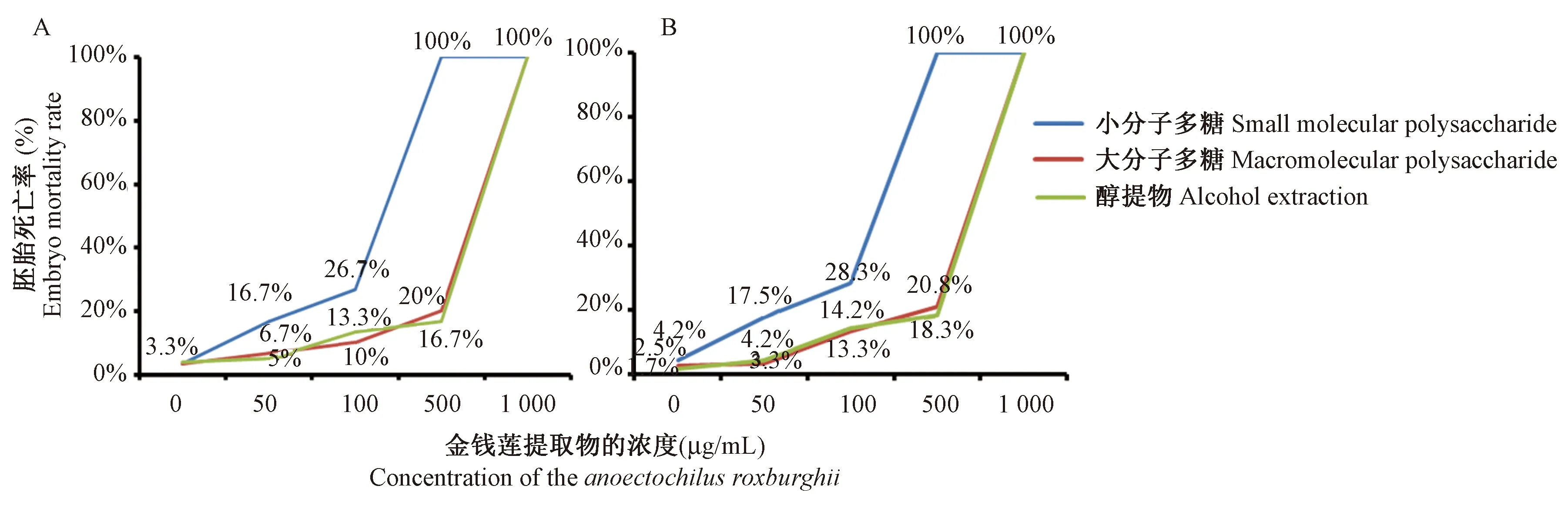
注:A:金线莲提取物溶解在Holfreter水中引起斑马鱼胚胎的致死率;B:金线莲提取物在高糖模型条件下引起斑马鱼胚胎的致死率。图1 不同浓度的金线莲提取物对斑马鱼胚胎死亡率的影响Note. A:The mortality rate of zebrafish embryos induced by Anoectochilus roxburghii extracts dissolved in Holfreter water. B:The mortality rate induced by Anoectochilus roxburghii extracts under conditions of high glucose model.Fig.1 Effect of Anoectochilus roxburghii extracts in different concentrations on the mortality rate of zebrafish embryos

组别GroupsCtr2% Glu2%Glu+低浓度2% Glu+A2%Glu+中浓度2% Glu+B2%Glu+高浓度2% Glu+C小分子多糖Small molecular polysaccha-ride1.47±0.3013.88±0.4453.95±0.4233.82±0.5233.93±0.476大分子多糖Macromolecular polysaccha-ride1.45±0.3153.87±0.4373.90±0.4154.20±0.3634.22±0.397金线莲醇提物Alcohol extraction1.45±0.2933.87±0.437***3.23±0.520#2.78±0.387##2.08±0.075###
注:低浓度、中浓度、高浓度对于小分子多糖分别是30 μg/mL、40 μg/mL,50 μg/mL;低浓度,中浓度,高浓度对于大分子多糖和金线莲醇提物分别是300 μg/mL、400 μg/mL、500 μg/mL;高糖组与对照组相比,***P< 0.001;加药组与高糖组相比,#P< 0.05,##P< 0.01,###P< 0.001。
Note. (A)low,(B)medium,and(C) high concentrations for the small molecules polysaccharide extracts are 30 μg/mL, 40 μg/mL, and 50 μg/mL. The (A)low,(B)medium,and(C) high concentrations for the macromolecular polysaccharide extracts andAnoectochilusroxburghiialcohol extracts are 300 μg/mL, 400 μg/mL and 500 μg/mL. The high glucose group compared with the control group,***P<0.001. Medication group compared with the high glucose group,#P< 0.05,##P< 0.01,###P< 0.001.
2.3 半定量PCR检测糖代谢相关基因的表达
按照(1.3.2.2)中的方法用金线莲醇提物处理,待胚胎发育至72 h,每组各收集50枚,提total RNA,反转录后进行半定量PCR检测insulin、pck-1、pdx-1、neurod-1基因的表达。以β-actin为内参,其结果如图2所示:加入葡萄糖溶液进行高糖胁迫之后,insulin、pck-1、pdx-1三个基因电泳条带的亮度与对照组相比明显减弱,加药组与高糖组相比,条带亮度总体上具有升高的趋势,并且随着金线莲醇提物溶液浓度的升高,亮度越亮;neurod-1基因电泳条带的亮度变化趋势则相反,高糖组与对照组相比,亮度明显增强,加入金线莲醇提物之后,随着金线莲醇提物浓度的升高,亮度逐渐恢复对照水平(图2A)。通过ImageJ软件计算各个基因mRNA的相对表达量,结果如图2B~D所示:insulin在高糖组中的表达只有对照组的50%,金线莲醇提物处理使得insulin的表达量逐步恢复,呈剂量依赖性,在500 μg/mL时效果达到最佳,恢复到对照组的90%(图2B)。高糖胁迫下pck-1 mRNA水平降低至对照组的40%,金线莲醇提物处理浓度在500 μg/mL时,pck-1基因的表达量增加至对照组的60%,恢复效果显著(图2C)。pdx-1基因在加了高糖溶液之后基因表达量是对照组的70%,金线莲醇提物处理浓度在400 μg/mL时效果最佳,pdx-1基因的表达量超过了对照组(图2D)。neurod-1基因加了高糖溶液之后基因表达量是对照组的1.6倍,随着金线莲醇提物浓度的升高,在500 μg/mL时基因表达量基本恢复至对照水平(图2E)。
以上实验结果说明高糖模型下,insulin、pck-1、pdx-1表达下调,金线莲醇提物可以解除高糖对insulin、pck-1、pdx-1的抑制。该研究进一步通过整胚原位杂交检测在经过相同处理后,以上几个基因的时空表达。
2.4 整胚原位杂交检测糖代谢相关基因的时空表达
按照(1.3.2.2)中的方法用金线莲醇提物处理,待胚胎发育至72 h,检测insulin、pck-1、pdx-1和neurod-1的时空表达变化。对照组胚胎insulin基因表达正常位于胚胎躯干的右侧(图3 A),高糖组有超过80%的比例insulin基因表达出现偏移,其中约有50%的胚胎insulin表达移至躯干中间(图3B),超过30%胚胎insulin偏移至躯干左侧(图3C)。加入金线莲醇提物后,insulin的左右不对称表达异常随着金线莲醇提物浓度高逐渐增加而得到明显改善,insulin基因表达在躯干中间和偏左胚胎随着金线莲醇提物浓度的升高逐渐减少,在金线莲醇提物500 μg/mL时,效果达到最佳,正常胚胎上升至67%,偏移到中间的胚胎下降到29%,偏移到中间胚胎仅仅只占4%(图3D)。进行高糖胁迫后会使insulin基因表达部位产生偏移,使胰岛素基因表达下降,加入金线莲醇提物之后,insulin基因表达部位有明显的恢复效果,使胰岛素基因表达得到恢复,与半定量PCR结果一致。
待胚胎发育至72 h检测pck-1、pdx-1和neurod-1的时空表达。进行高糖胁迫后,腹部轮廓高糖组比对照组染色减弱很多(图4A1,B1),加入金线莲醇提物后,随着醇提物浓度的升高,pck-1的染色部位颜色逐渐变深,并且具有浓度依赖性,在金线莲醇提物浓度为400 μg/mL时基本恢复到了对照组的水平(图4C1-E1)。高糖组pdx-1在腹部胰腺部位染色明显比对照组浅(图4A2,B2),加入金线莲醇提物之后,pdx-1在腹部胰腺部位染色随着醇提物浓度的升高逐渐变深(图4C2-E2)。而neurod-1染色情况则与pck-1和pdx-1相反,高糖组头部和颈部的染色相比于对照组增加了很多(图4A3,B3),加入金线莲醇提物之后,随着金线莲醇提物浓度的升高,neurod-1的染色部位颜色逐渐变浅,在浓度为500 μg/mL时,neurod-1的染色基本恢复到了对照组的水平(图4C3~E3)。由此我们得出结论:在高糖模型下,高葡萄糖溶液抑制pck-1和pdx-1基因表达的情况下,金线莲醇提物可以促进pck-1和pdx-1基因的时空表达,与上述半定量PCR结果一致,金线莲醇提物对neurod-1基因的时空表达有抑制作用。
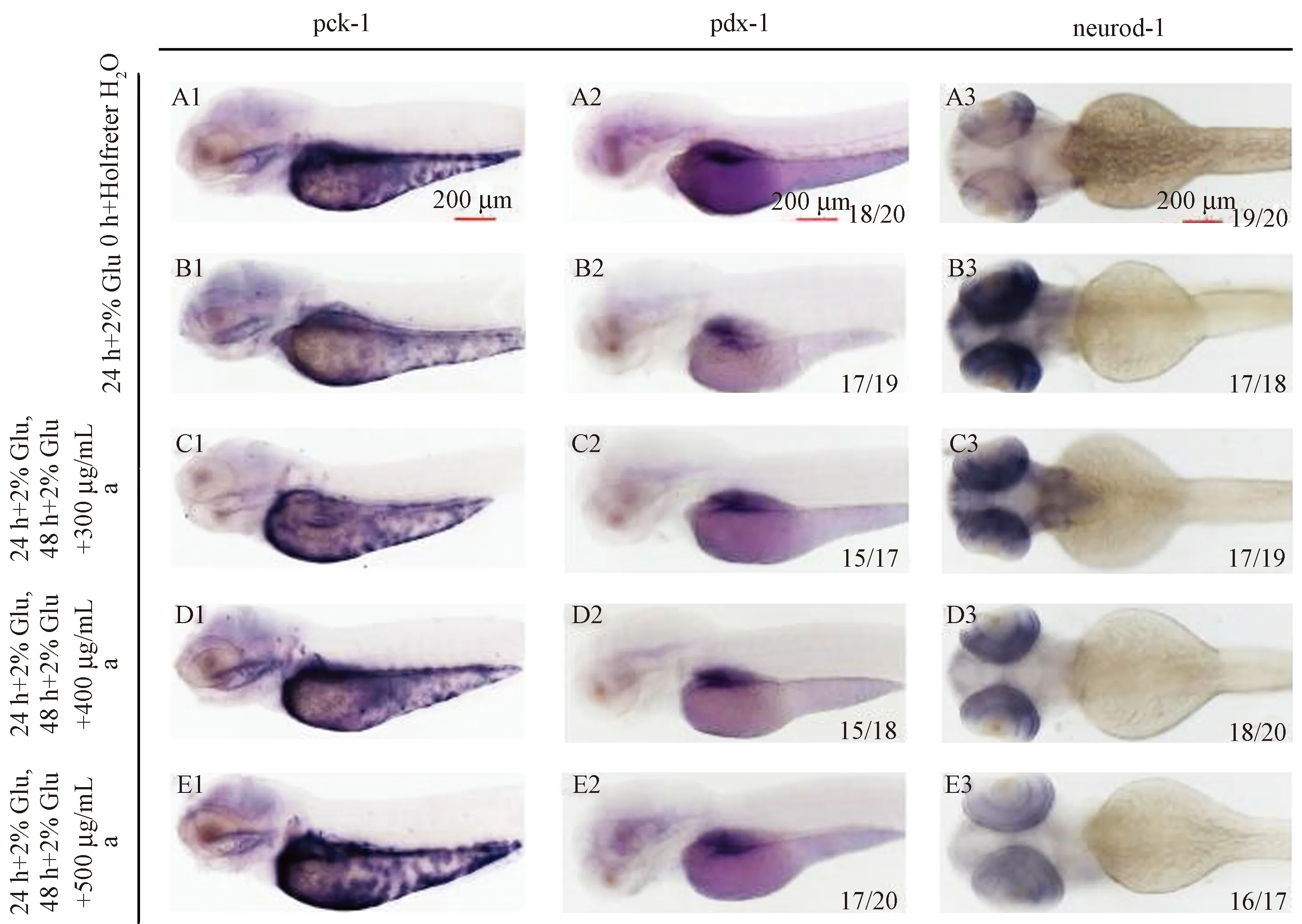
注:(a)金线莲醇提物。图4 金线莲醇提物对pck-1、pdx-1和neurod-1时空表达的影响Note:(a)Anoectochilus roxburghii alcohol extracts.Fig.4 The spatial and temporal expression patterns of pck-1, pdx-1and neurod-1 after treated with Anoectochilus roxburghii alcohol extracts in zebrafish
3 讨论
斑马鱼作为一种新兴的模式生物,具有体型小、易饲养、繁殖周期短等其他模式生物不具备的优点,而且在器官和基因序列上与人类都很相似,所以很多实验室现在用斑马鱼来研究糖尿病。本研究利用斑马鱼来筛选金线莲具有降血糖的活性组分,实验结果表明,对斑马鱼幼鱼进行高糖胁迫,加入金线莲醇提物组与加入其他两种组分(小分子多糖和大分子多糖)的斑马鱼相比较,加入金线莲醇提物组斑马鱼幼鱼组织液内的葡萄糖浓度明显下降,初步筛选出具有降糖作用的活性组分为金线莲醇提物。接下来进行了初步的机理研究,本研究通过半定量PCR以及整胚原位杂交技术检测了四个糖代谢相关基因mRNA的表达水平,发现insulin、pck-1、pdx-1基因在加了高糖溶液之后基因表达量与对照组相比下降非常显著,并且Insulin基因的时空表达发生了偏移,但是经过金线莲醇提物处理后insulin、pck-1、pdx-1基因的表达量与只加葡萄糖组相比明显上升,并且insulin基因的时空表达偏移率明显下降(图2~4),而neurod-1基因mRNA表达则与上述三个基因恰恰相反。我们推测高糖胁迫情况下会抑制pdx-1基因的表达[26],加入金线莲醇提物后可以促进pdx-1基因的正常表达来维持β细胞的形态和正常功能,促进insulin基因的正常表达,insulin基因的时空表达偏移率明显下降。另一方面,金线莲醇提物可以促进pck-1基因的正常表达维持机体葡萄糖的稳态。加入金线莲醇提物后neurod-1基因mRNA表达量下降有待进一步探究。
本研究尚存在改进之处,金线莲降血糖成分不够明确,具体是哪种物质起到降血糖的作用,还需要通过分离纯化进一步确定,此外金线莲醇提物是通过哪种信号途径起到降血糖作用,这些问题都需要进一步研究。
参考文献:
