TGF-β1对M2型巨噬细胞诱导淋巴瘤细胞增殖的影响
2018-06-26黎承平
谢 瑜,黎承平,武 坤,谭 琳
(1.昆明医科大学第一附属医院血液内科,昆明 650032; 2.昆明医科大学第一附属医院检验科,昆明 650032)
淋巴瘤是一种发生在造血系统的血液肿瘤,在全部的恶性肿瘤中约占1.13%,肿瘤的发生除了与肿瘤细胞的生长有关以外,还与微环境有关,微环境包括基质细胞、白细胞等,其中巨噬细胞是白细胞的重要组成部分[1-2]。巨噬细胞有M1和M2型,其中M2型巨噬细胞是目前公认的能够诱导淋巴瘤细胞增殖、侵袭、迁移的巨噬细胞[3-4]。转化生长因子β1(transforming growth factor-β1, TGF-β1)是具有多种功能的生长因子,人体内的几乎所有细胞都可以合成TGF-β1,其可以对细胞免疫功能、增殖等进行调控,并且与肿瘤的发生有关[5-6]。目前的研究显示,TGF-β1对不同的肿瘤细胞的生长作用不同,并且TGF-β1在癌症早期可以发挥抗肿瘤作用,而在癌症的中、后期发挥促进肿瘤发展的作用[7]。研究表明,TGF-β1能够抑制淋巴瘤细胞增殖[8]。本实验拟通过探讨TGF-β1对巨噬细胞诱导淋巴瘤细胞增殖、侵袭、迁移的影响,为以后研究肿瘤的发病机制和寻找有效的治疗方法提供基础。
1 材料和方法
1.1 材料
人单核细胞THP-1和淋巴瘤细胞Jiyoye均购自于中科院细胞库。
1.2 主要试剂及仪器
二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度检测试剂盒购自碧云天研究所;RPMI1640购自美国Sigma;蛋白提取试剂盒购自德国Qiagen;基质金属蛋白酶-9(matrix metalloprotease 9, MMP-9)抗体、增殖细胞核抗原(PCNA)抗体、基质金属蛋白酶-2(matrix metalloprotease 2, MMP-2)抗体、细胞核增殖抗原(Ki- 67)抗体购自于美国CTS;辣根过氧化物标记的IgG购自于碧云天;胎牛血清购自于杭州四季青;β肌动蛋白(β-actin)抗体购自于美国Abcam;TGF-β1购自美国Biovision;3K18低温高速离心机购自美国Sigma;MK3酶标仪、371型CO2培养箱购自美国Thermo。
1.3 实验方法
1.3.1MTT测定TGF-β1对淋巴瘤增殖影响
淋巴瘤细胞Jiyoye培养于含有10%胎牛血清的RPMI 1640中,将细胞种植于96孔板中(种植密度为每孔4000个细胞),并且在细胞中添加TGF-β1,使其最终浓度为0、0.2、0.4、0.8、1.6 ng/mL。将细胞放在37℃,5% CO2培养箱培养48 h。培养结束后,在每孔中依次添加10 μL的MTT,再继续孵育4 h。把孔中的上清液吸除掉,再添加150 μL的DMSO。10 min以后,酶标仪测定540 nm各组的OD值。分组情况如表1。

表1 各组分组处理情况
1.3.2巨噬细胞诱导分化及分组处理
THP-1细胞培养于10%胎牛血清的RPMI 1640中,在实验前用M-CSF将巨噬细胞诱导分化为M2型巨噬细胞。实验分为Control、TGF-β1、M2、M2+TGF-β1共4组细胞。Control为常规培养的Jiyoye细胞;TGF-β1为用0.4 ng/mL的TGF-β1培养的Jiyoye细胞;M2为用M2型巨噬细胞培养液上清培养的Jiyoye细胞;M2+TGF-β1为用M2型巨噬细胞培养液上清培养的Jiyoye细胞,同时在培养液中添加0.4 ng/mL的TGF-β1。Control、TGF-β1、M2、M2+TGF-β1细胞按照上述方法分组处理以后,MTT法测定48 h的增殖情况。诱导分化步骤如下[9]:取约7×106个细胞接种到T25细胞瓶内,0 d时在细胞培养液中添加20 ng/mL的M-CSF,在第5天时用含有20 ng/mL M-CSF、20 ng/mL IL-4、20 ng/mL IL-13、20 ng/mL IL-6的培养液诱导分化。诱导分化共9 d。
1.3.3Transwell小室测定侵袭和迁移
Jiyoye细胞用不含血清的培养液悬浮,接种于Transwell小室中,按照Control、TGF-β1、M2、M2+TGF-β1分组处理,另外在小室的下室中添加含血清的培养液。分别用基质胶湿化(侵袭)和无基质胶湿化(迁移)的孔径为8 μm的Transwell小室按照上述方法处理,培养48 h以后,把上室取出,取棉签把上室中没有穿膜的细胞擦掉,然后置于甲醇溶液中固定10 min,再用0.1%结晶紫染色以后,放在倒置显微镜下对穿膜的细胞进行统计,每组样品随机选5个视野。
1.3.4Western blot分析MMP-2、MMP-9、PCNA、Ki- 67蛋白表达
Control、TGF-β1、M2、M2+TGF-β1细胞按照上述方法分组处理培养48 h以后,提取细胞总蛋白,用BCA法对蛋白定量。分别配制10%分离胶、5%浓缩胶进行电泳。按照每孔添加50 μg样品进行变性处理。80 V的电压条件下电泳30 min;120 V的电压条件下电泳直到染料进入到凝胶底部。在200 mA恒流条件下把蛋白转移到硝酸纤维素膜上,转膜时间约为60 min。取膜,用5%脱脂奶粉于室温环境封闭1.5 h,在1∶600、1∶600、1∶800、1∶800稀释的MMP-2、MMP-9、PCNA、Ki- 67一抗中4℃孵育12 h,再把膜放在1∶3000稀释的二抗中室温孵育2 h。用ECL发光以后,Image J测定条带灰度值,以β-actin为内参。
1.4 统计学方法
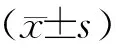
2 结果
2.1 TGF-β1对淋巴瘤细胞增殖的影响
结果见图1中所示,用0、0.2、0.4、0.8、1.6 ng/mL浓度的TGF-β1处理后的细胞OD值分别为:0.85±0.06、0.64±0.05、0.47±0.03、0.35±0.05、0.26±0.04。0、0.2、0.4、0.8、1.6 ng/mL浓度的TGF-β1处理后的细胞OD值比较,经单因素方差分析,差异具有显著性(P< 0.001),0.2、0.4、0.8、1.6 ng/mL浓度的TGF-β1作用后的淋巴瘤细胞OD值明显低于0 ng/mL(P< 0.05)。0.4、0.8、1.6 ng/mL浓度的TGF-β1作用后的淋巴瘤细胞OD值明显低于0.2 ng/mL(P< 0.05)。0.8、1.6 ng/mL浓度的TGF-β1作用后的淋巴瘤细胞OD值明显低于0.4 ng/mL(P< 0.05)。1.6 ng/mL浓度的TGF-β1作用后的淋巴瘤细胞OD值明显低于0.8 ng/mL(P< 0.05)。TGF-β1可以抑制淋巴瘤细胞的增殖。TGF-β1对淋巴瘤细胞半数抑制浓度约为0.4 ng/mL,所以采用0.4 ng/mL的TGF-β1作后续实验。
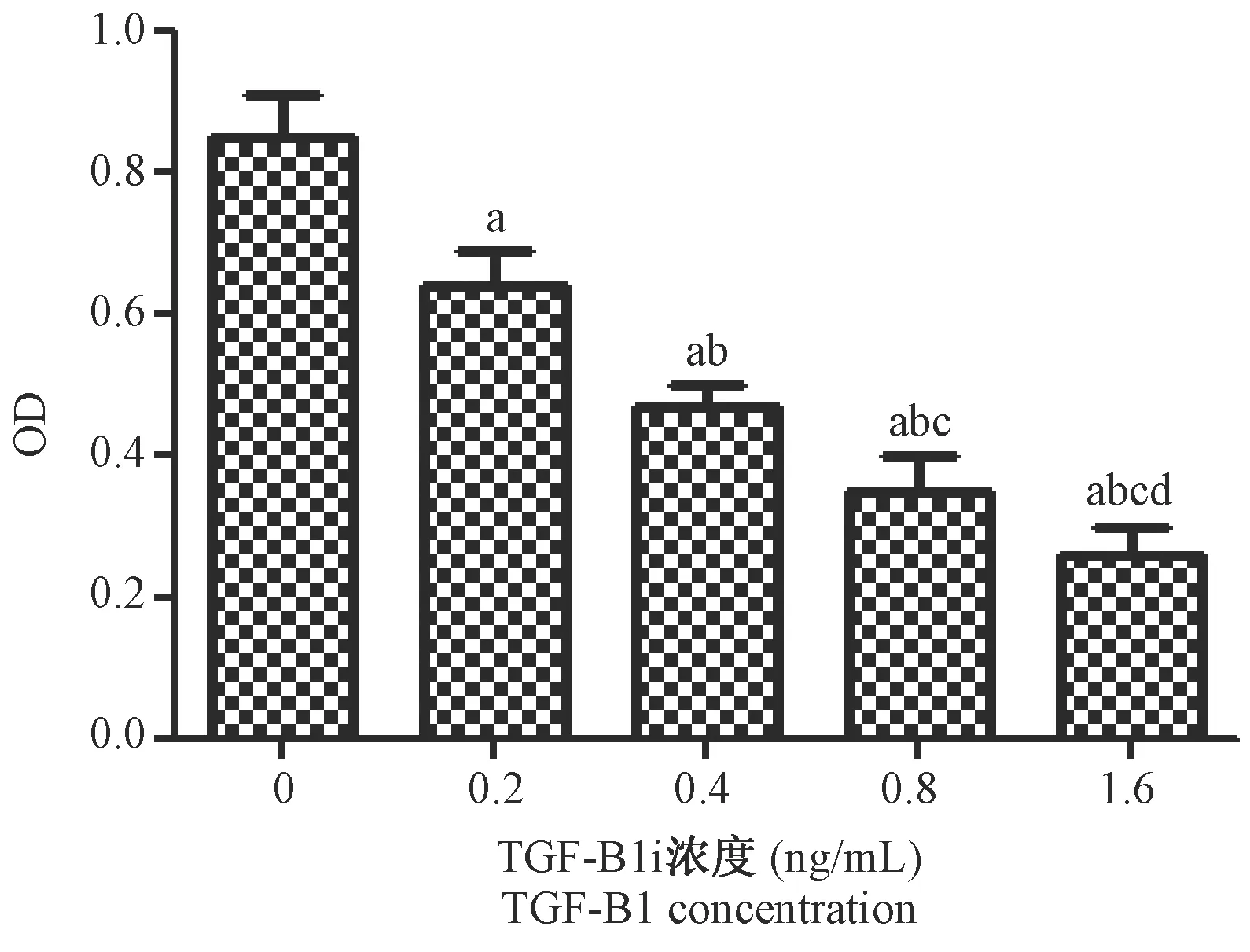
注:与0 ng/mL相比,aP< 0.05;与0.2 ng/mL相比,bP< 0.05;与0.4 ng/mL相比,cP< 0.05;与0.8 ng/mL相比,dP< 0.05。图1 TGF-β1对淋巴瘤细胞增殖的影响Note.Compared with 0 ng/mL treatment,aP< 0.05. Compared with 0.2 ng/mL treatment,bP< 0.05. Compared with 0.4 ng/mL treatment,cP< 0.05. Compared with 0.8 ng/mL treatment,dP< 0.05.Fig.1 Effect of TGF-β1 on the proliferation of lymphoma cells
2.2 TGF-β1对巨噬细胞诱导淋巴瘤细胞增殖影响
结果见图2中所示,Control、TGF-β1、M2、M2+TGF-β1细胞OD值分别为:0.78±0.09、0.42±0.05、1.16±0.13、0.86±0.08。4组细胞OD值比较差异有显著性(P< 0.001),TGF-β1细胞OD值明显低于Control(P< 0.05)。M2细胞明显高于Control(P< 0.05)。M2+TGF-β1细胞OD值明显高于TGF-β1,并且低于M2(P< 0.05)。M2型巨噬细胞诱导淋巴瘤细胞增殖,TGF-β1可以减弱M2型巨噬细胞对淋巴瘤细胞增殖的诱导作用。

注:与Control相比,aP< 0.05;与TGF-β1相比,bP< 0.05;与M2相比,cP< 0.05。图2 TGF-β1对巨噬细胞诱导的淋巴瘤细胞增殖影响Note.Compared with the control group,aP< 0.05. Compared with the TGF-β1-treated group,bP< 0.05. Compared with the M2-treated group,cP< 0.05.Fig.2 Effect of TGF-β1 on the proliferation of lymphoma cells induced by macrophages
2.3 TGF-β1对巨噬细胞诱导的淋巴瘤细胞侵袭影响
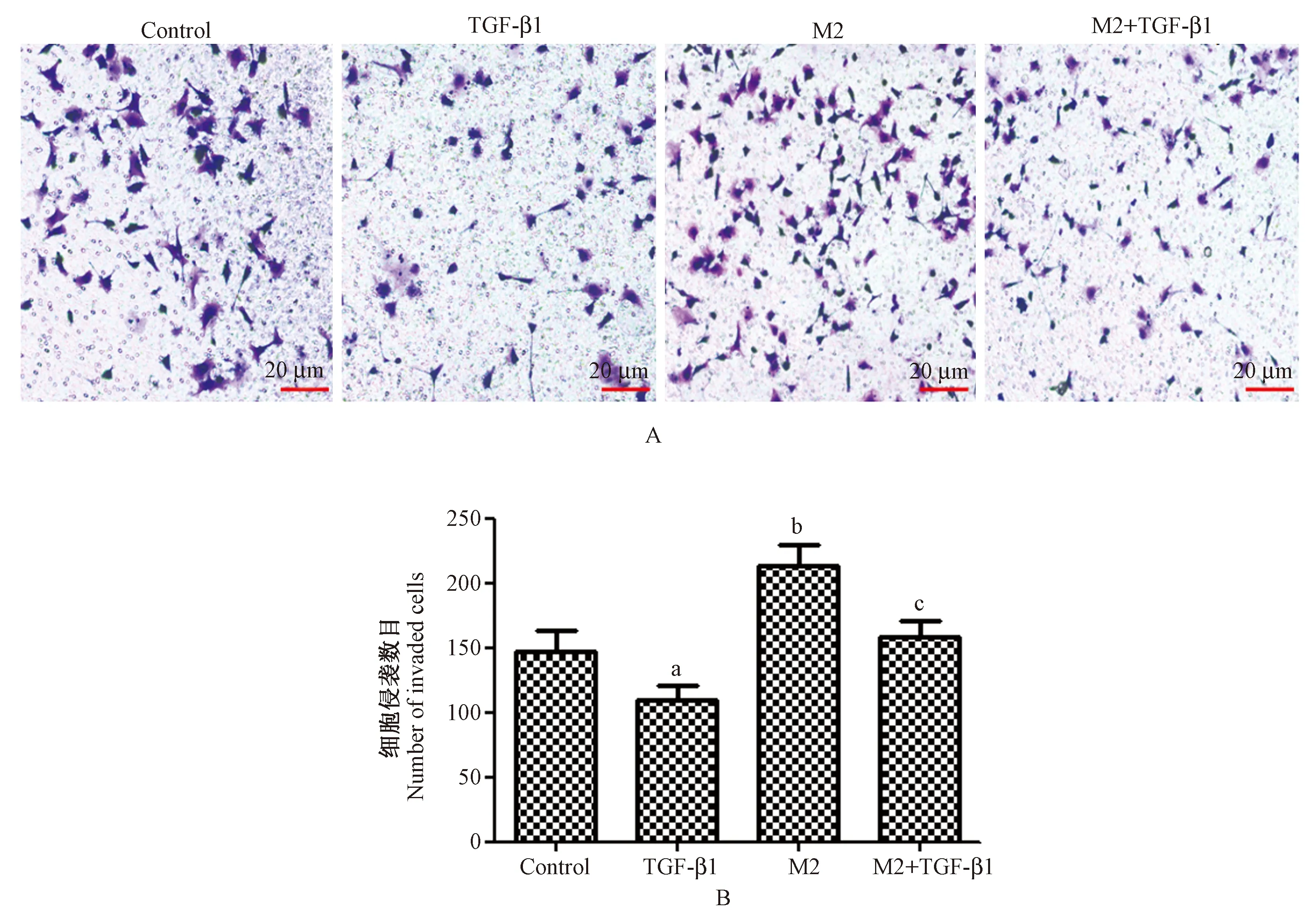
注:(A)Transwell小室测定细胞侵袭结果;(B)各组细胞侵袭数目;与Control相比,aP< 0.05;与TGF-β1相比,bP< 0.05;与M2相比,cP< 0.05。图3 TGF-β1对巨噬细胞诱导淋巴瘤细胞侵袭影响Note.(A)Transwell chamber for measuring cell migration.(B)Number of migrated cells in each group. Compared with the control group,aP< 0.05. Compared with the TGF-β1-treatment group,bP< 0.05. Compared with the M2-treated group,cP< 0.05.Fig.3 Effect of TGF-β1 on the invasion of macrophage-induced lymphoma cells
图3所示,Control、TGF-β1、M2、M2+TGF-β1细胞侵袭细胞数目分别为:147.28±13.92、110.35±10.64、213.92±16.79、158.67±13.26。4组细胞侵袭细胞数目整体比较差异有显著性(P< 0.001),TGF-β1侵袭细胞数目明显低于Control(P< 0.05)。M2侵袭细胞数目明显高于Control(P< 0.05)。M2+TGF-β1侵袭细胞数目明显高于TGF-β1,并且低于M2(P< 0.05)。M2型巨噬细胞诱导淋巴瘤细胞侵袭,TGF-β1可以减弱M2型巨噬细胞对淋巴瘤细胞侵袭的诱导作用。
2.4 TGF-β1对巨噬细胞诱导的淋巴瘤细胞迁移影响
图4所示,Control、TGF-β1、M2、M2+TGF-β1迁移细胞数目分别为:264.31±25.87、195.82±17.59、338.57±28.64、278.65±25.83。4组迁移细胞数目整体比较差异有显著性(F=16.723,P< 0.001),TGF-β1迁移细胞数目明显低于Control(P< 0.05)。M2迁移细胞数目明显高于Control(P< 0.05)。M2+TGF-β1迁移细胞数目明显高于TGF-β1,并且低于M2(P< 0.05)。M2型巨噬细胞诱导淋巴瘤细胞迁移,TGF-β1可以减弱M2型巨噬细胞对淋巴瘤细胞迁移的诱导作用。
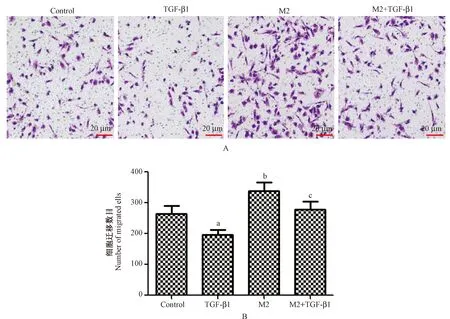
注:(A)Transwell小室测定细胞迁移;(B)各组细胞迁移数目;与Control相比,aP< 0.05;与TGF-β1相比,bP< 0.05;与M2相比,cP< 0.05。图4 TGF-β1对巨噬细胞诱导的淋巴瘤细胞迁移影响Note.(A)Transwell chamber for measuring cell migration.(B)Number of migrated cells in each group. Compared with the control group,aP< 0.05. Compared with the TGF-β1-treated group,bP< 0.05. Compared with the M2-treated group,cP< 0.05.Fig.4 Effect of TGF-β1 on the migration of macrophage-induced lymphoma cells
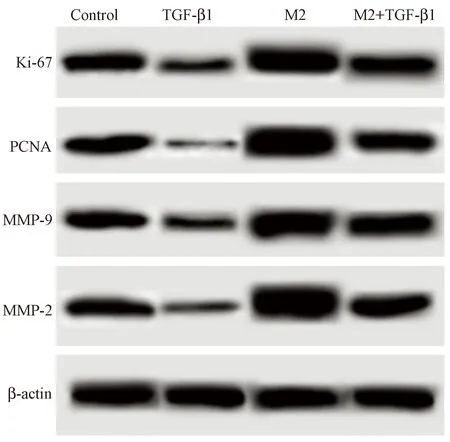
图5 Western blot法测定TGF-β1对巨噬细胞培养液上清作用后的淋巴瘤细胞中MMP-2、MMP-9、PCNA、Ki- 67蛋白水平影响Fig.5 Effect of TGF-β1 on the levels of MMP-2, MMP-9, PCNA and Ki- 67 proteins in the lymphoma cells treated with supernatant of macrophage culture fluid. Results of Western blot assay
2.5 TGF-β1对巨噬细胞培养液上清作用后的淋巴瘤细胞中MMP-2、MMP-9、PCNA、Ki-67蛋白水平影响
图5和表1所示,TGF-β1细胞中MMP-2、MMP-9、PCNA、Ki-67蛋白水平明显低于Control(P< 0.05)。M2细胞中MMP-2、MMP-9、PCNA、Ki- 67蛋白水平明显高于Control(P< 0.05)。M2+TGF-β1细胞中MMP-2、MMP-9、PCNA、Ki- 67蛋白水平明显高于TGF-β1,并且低于M2(P< 0.05)。M2型巨噬细胞诱导淋巴瘤细胞表达MMP-2、MMP-9、PCNA、Ki- 67,TGF-β1可以减弱M2型巨噬细胞诱导的淋巴瘤细胞表达MMP-2、MMP-9、PCNA、Ki- 67作用。
3 讨论
肿瘤细胞的恶性增殖与肿瘤的发生有关,除此以为,肿瘤组织中还含有非肿瘤细胞,这些非肿瘤细胞主要由基质细胞、白细胞等组成,并且白细胞以巨噬细胞为主[10]。巨噬细胞具有多向分化潜能,在不同的微环境下,巨噬细胞的功能、活化程度等都不相同,巨噬细胞分为M1型、M2型,其中M2型与肿瘤微环境密切相关[11-14]。研究表明,M2型巨噬细胞与乳腺癌、淋巴瘤、胰腺癌等患者的预后有关,M2型巨噬细胞过多常常预示预后不良[15-17]。M2型巨噬细胞能够诱导恶性肿瘤细胞的增殖,诱导肿瘤的转移[18-19]。本实验结果表明,M2型巨噬细胞培养液上清处理后的淋巴瘤细胞增殖能力增加,细胞侵袭和迁移数目也增多,这与上述研究报道一致。

表1 TGF-β1对巨噬细胞培养液上清作用后的淋巴瘤细胞中MMP-2、MMP-9、PCNA、Ki- 67蛋白水平影响
注:与Control相比,aP< 0.05;与TGF-β1相比,bP< 0.05;与M2相比,cP< 0.05。
Note. Compared with the control group,aP< 0.05. Compared with the TGF-β1-treated group,bP< 0.05. Compared with the M2-treated group,cP< 0.05.
TGF-β1具有多种调控作用,在不同的细胞中的作用不同,对细胞的增殖、分化等具有相互矛盾的双重作用,TGF-β1对上皮细胞、造血细胞、淋巴样细胞等具有生长抑制作用,而对乳腺癌细胞具有增殖促进作用[20-23]。TGF-β1在肿瘤中表达,并且对于肿瘤的调控作用具有异质性,在同种肿瘤或者不同肿瘤的不同时期,其对细胞生长的作用不同[24]。陈雨龙等[25]的研究显示,TGF-β1刺激卵巢癌A2780细胞以后,细胞在570 nm的OD值升高,细胞穿过Transwell小室膜的细胞数目增多,TGF-β1诱导A2780细胞增殖、侵袭和迁移。李柱虎等[8]用TGF-β1处理淋巴瘤细胞以后,淋巴瘤细胞的存活率降低,TGF-β1抑制淋巴瘤细胞增殖。陈元仲等[26]发现,外源性的TGF-β1可以降低白血病HL-60细胞的增殖能力。本实验结果显示,TGF-β1处理后的淋巴瘤细胞增殖能力下降,细胞迁移和侵袭能力也下降,说明TGF-β1在淋巴瘤细胞中发挥抑制作用。本实验还进一步用TGF-β1处理M2型巨噬细胞诱导的淋巴瘤细胞增殖侵袭和迁移,发现TGF-β1可以抑制M2型巨噬细胞对淋巴瘤细胞的增殖、侵袭和迁移的诱导作用。
细胞外基质的主要成分为Ⅳ型胶原酶,而MMP-2、MMP-9分别是可以降解Ⅳ型胶原酶的非糖化和糖化形式,与肿瘤的转移密切相关[27]。PCNA、Ki- 67是细胞增殖的标志蛋白,其表达水平升高后标志着细胞增殖活性增加[28-29]。本实验表明,TGF-β1降低淋巴瘤细胞中MMP-2、MMP-9、PCNA、Ki- 67蛋白表达,并且TGF-β1还可以抑制M2型巨噬细胞诱导的淋巴瘤细胞中MMP-2、MMP-9、PCNA、Ki- 67蛋白表达,这与检测的细胞增殖、侵袭和迁移结果一致。
M2型巨噬细胞诱导淋巴瘤细胞增殖、迁移和侵袭,而TGF-β1可以抑制M2型巨噬细胞对淋巴瘤细胞增殖、迁移和侵袭的作用,这对于以后研究肿瘤微环境在肿瘤的发生中的作用具有重要意义,本研究为以后探讨TGF-β1在淋巴瘤发病机制中的作用奠定了基础。本实验只在一株淋巴瘤细胞中进行了初步研究,在以后的实验中会在多株细胞中进行验证。
