柏子仁甙对阿尔茨海默病模型大鼠的行为改善作用及其相关作用机制
2018-06-26索金红牟海军刘晓娟姚福祥杨文广
索金红,牟海军,刘晓娟,姚福祥*,杨文广
(1.通辽职业学院,内蒙古 通辽 028000; 2.齐齐哈尔医学院附属第三医院呼吸科,黑龙江 齐齐哈尔 161000; 3.内蒙古通辽市医院药剂科,内蒙古 通辽 028000)
柏子仁为柏科植物侧柏的种仁,具有养心气,润肾燥,益智宁神;烧沥,泽头发,治疥癣的功效[1]。近年来研究表明,柏子仁含柏子仁甙、柏木醇、双萜类成分,还含脂肪油约14%,并含少量挥发油、皂苷、维生素A和蛋白质等,脂肪油的主要成分为不饱和脂肪酸,占62.39%[2]。因此无论是祖国医学理论还是现代医学研究均提示柏子仁有促进学习记忆的作用。但是柏子仁是否对阿尔茨海默病(Alzheimer’s disease, AD)有治疗和预防作用以及治疗和预防的分子机制是什么,目前还未见文献报道,因此需要进一步探索,为传统医药的深入开发利用提供理论基础。本研究的目的就是通过Wistar大鼠双侧大脑海马注射Aβ1- 42建立AD动物模型,着重探讨SPS对AD模型鼠认知功能及海马组织氧化性损伤与抗氧化作用的影响,进一步阐明SPS对AD的神经保护作用机制和神经保护作用效果。
1 材料和方法
1.1 实验动物
SPF级雌性Wistar大鼠60只,24周龄,体重(300±20)g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0011],实验在通辽职业学院实验中心及合约协作单位医学院完成[SYXK(蒙)2016-0003]。所有使用的动物依照国家实验动物使用的相关规定获得学校实验动物伦理委员会的批准(伦理审查证号2017002)。所有大鼠先用Morris水迷宫实验初筛,去除先天痴呆、体力差、游泳姿势不良、视力困难者,剩下的即为合格大鼠,所有合格大鼠按照自然条件喂养,给予充足的食物和水,动物在实验动物房中笼养,每笼3只,实验室保证良好的通风及湿度,室温保持在23℃。
1.2 主要试剂及仪器
超氧化物歧化酶试剂盒(SOD)、谷胱甘肽过氧化物酶试剂盒(GSH)、丙二醛试剂盒(MDA)(南京建成生物工程研究所,批号: 20160829, 20160801, 20160801);UV754紫外可见分光光度计(上海奥析科学仪器有限公司);蛋白提取试剂盒、BCA蛋白浓度测定试剂盒(武汉博士德);Bcl-2、survivin、Bax、Fas、caspase-3(武汉博士德);二抗(武汉博士德);5082型酶标仪(TECAN);Bio-Rad Model 785型电转移仪。
1.3 实验方法
1.3.1动物分组
选取20只经Morris水迷宫实验筛选的正常无痴呆合格大鼠为正常对照组,将每只大鼠放于鼠脑立体定位仪上,双侧海马穿刺,每侧各一次性注入生理盐水5 μL,穿刺坐标为(以Bregma点为0点,AP 3.0 mm,ML 2.0 mm,DV 2.9 mm),另选取50只合格大鼠,将每只大鼠放于鼠脑立体定位仪上,双侧海马穿刺,穿刺坐标为(以Bregma点为0点,AP 3.0 mm,ML 2.0 mm,DV 2.9 mm),双侧海马各一次性注射凝聚态Aβ1 425 μL,术后1周将50只大鼠应用Morris水迷宫实验筛选AD模型大鼠40只(选定标准为以正常对照组大鼠逃避潜伏期平均值的95%可信区间上限值为标准,将超出上限值者确定为AD模型造模成功)。将造模成功的AD模型大鼠随机分为模型组和SPS干预组,每组20只。正常对照组和模型组给予生理盐水5 mL+羧甲基纤维素钠(500 mg/kg)灌胃,持续30 d,SPS干预组每天给予生理盐水5 mL+SPS(300 mg/kg)灌胃[3],持续30 d,每天喂养饮食及饲养条件与造模前一样,30 d后进行水迷宫实验,然后断头取脑(含海马)进行实验。
1.3.2学习记忆能力测试[4]
用药30 d后,全部60只大鼠进行Morris水迷宫实验,测定大鼠的空间学习和记忆能力。水迷宫测试房间保持安静、清洁,整个测试期间,实验环境保持恒定。Morris水迷宫直径120 cm,高60 cm,水深25 cm(高出站台1 cm),水温控制在22℃~26℃,设置4个象限,站台置于第3象限。池壁、水及平台均用墨汁染黑不见水下平台。迷宫上方安装摄像头,采集图像输入计算机。
1.3.3海马组织MDA、GHS含量及SOD活力测定[5]
将正常对照组、模型组、SPS干预组全部60只大鼠用20%的水合氯醛腹腔注射麻醉后,迅速断头取出完整大脑。将大鼠脑置冰盘上,于解剖显微镜下仔细剥除脑膜,沿中线胼胝体切成两半,将半脑翻过,从腹侧面掀开大脑皮层,暴露靠近小脑侧的里面月牙状组织,即为海马,用弯镊取出。保留海马组织,用滤纸吸干水分,天平称重,然后加组织重量9倍的4℃生理盐水,制成组织匀浆液,冷冻离心机2500 r/min离心10 min,取离心后的上清液用生理盐水按1∶9稀释成1%的海马组织匀浆溶液。将准备好的海马组织上清液取样,放在95℃水浴箱中40 min,然后放入离心机中3500 r/min离心10 min,取离心后的上清液,测各管吸光度。含量测定(nmol/mgprot)=(测定管吸光度-空白管吸光度)÷(标准管吸光度-空白管吸光度)×标准管浓度(nmol/mL)÷蛋白含量(mgprot/mL)。SOD活力(U/mgprot)=(对照管吸光度-测定管吸光度) ÷(对照管吸光度×50%)×反应液总体积÷取样量(mL) ÷ 蛋白含量(mgprot/mL)。
1.3.4Western Blotting
将3组大鼠海马组织从液氮罐中取出,取出的3组海马组织块先用冷PBS洗涤3次,去除血污,剪成小块放在匀浆器中,加入细胞裂解液,冰上放置30 min, 4℃ 15 000 r/min 5 min离心,得到的上清为蛋白样品,然后应用BCA法检测样本蛋白浓度。电泳及电转、抗体检测,严格按照试剂盒说明步骤进行。
1.4 统计学方法
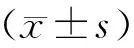
2 结果
2.1 Morris水迷宫实验结果
模型组所有大鼠在5 d内学会寻找平台,潜伏期较正常对照组和SPS干预组明显延长(P< 0.01)。模型组搜索时间较正常对照组、SPS组搜索时间明显延长;模型组搜索距离百分比较正常对照组、SPS干预组搜索距离百分比明显降低(P< 0.01);SPS干预组较正常对照组搜索时间明显延长,SPS干预组较正常对照组搜索距离百分比明显降低(P< 0.01)(见表1)。
2.2 3组大鼠海马MDA、GSH含量及SOD活力的比较
3组大鼠海马MDA、GSH含量及SOD活力的比较见表2,SPS干预组MDA含量明显低于模型组,而高于正常对照组(P< 0.01);GSH含量SPS干预组明显高于模型组,低于正常对照组(P< 0.01);SOD活力SPS干预组明显高于模型组,低于正常对照组(P< 0.01)。
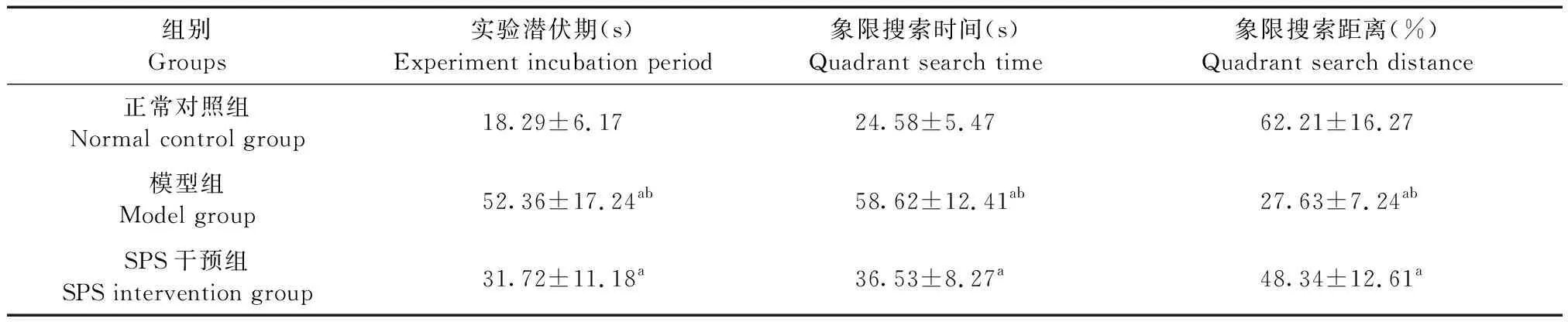
表1 3组大鼠Morris水迷宫实验结果比较
注:与正常对照组比较,aP< 0.01;与 SPS 干预组比较,bP< 0.01。
Note. Compared with the normal control group,aP< 0.01. Compared with the SPS intervention group,bP< 0.01.
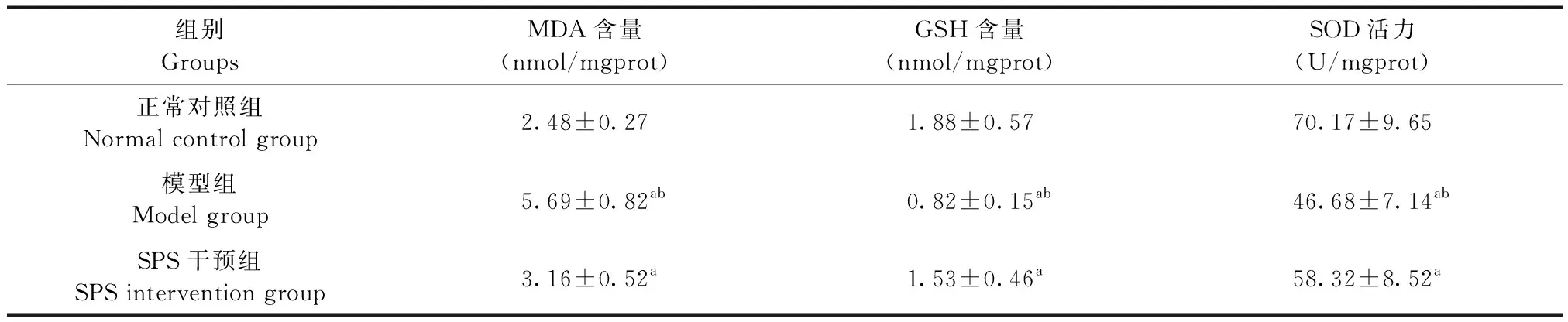
表2 3组大鼠海马MDA、GHS含量及SOD活力的比较
注:与正常对照组比较,aP< 0.01;与 SPS 干预组比较,bP< 0.01。
Note. Compared with the normal control group,aP< 0.01. Compared with the SPS intervention group,bP< 0.01.

表3 3 组大鼠海马组织凋亡相关因子蛋白表达比较(相对光密度)
注:与正常对照组比较,aP< 0.01;与 SPS 干预组比较,bP< 0.01。
Note. Compared with the normal control group,aP< 0.01. Compared with the SPS intervention group,bP< 0.01.
2.3 3组大鼠海马Bcl-2、Survivin、Bax、Fas、Caspase-3蛋白的表达
SPS干预组Bcl-2蛋白表达较模型组上升,两者比较差异有显著性(P< 0.01);同时与对照组比较Bcl-2蛋白表达下降(P< 0.05),而模型组较对照组明显下降,两者比较差异有显著性(P< 0.01)。SPS干预组survivin蛋白表达较模型组上升,两者比较差异有显著性(P< 0.01);同时与对照组比较survivin蛋白表达下降(P< 0.05),而模型组较对照组明显下降,两者比较差异有显著性(P< 0.01)。SPS干预组Bax蛋白表达较模型组下降,两者比较差异有显著性(P< 0.01);同时与对照组比较Bax蛋白表达上升(P< 0.05),而模型组较对照组明显上升,两者比较差异有显著性(P< 0.01)。SPS干预组Fas蛋白表达较模型组下降,两者比较差异有显著性(P< 0.01);同时与对照组比较Fas蛋白表达上升(P< 0.05),而模型组较对照组明显上升,两者比较差异有显著性(P< 0.01)。SPS干预组caspase-3蛋白表达较模型组下降,两者比较差异有显著性(P< 0.01);同时与对照组比较caspase-3蛋白表达上升(P< 0.05),而模型组较对照组明显上升,两者比较差异有显著性(P< 0.01)(见表3和图1)。
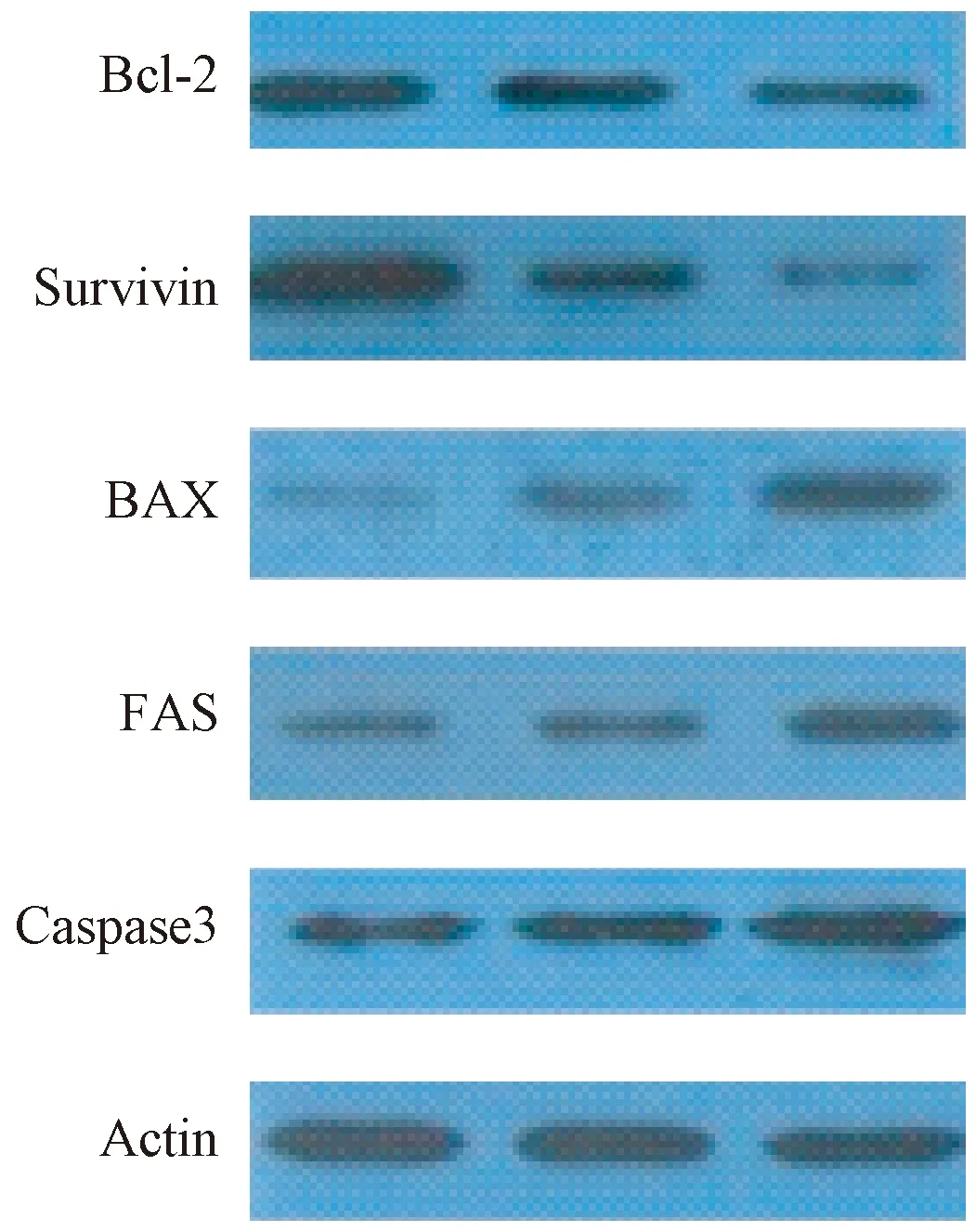
图1 SPS对模型鼠海马Bcl-2、Survivin、Bax、Fas、Caspase-3蛋白表达的影响Fig.1 Effect of SPS on the expression of Bcl-2, survivin, Bax, Fas and caspase-3 proteins in the hippocampus of model rats
3 讨论
AD模型组搜索时间较正常对照组明显延长,两组比较具有明显的统计学差异。其表现主要体现为学习记忆功能的损害,与临床上阿尔茨海默病病人的表现相符,结合我们应用的Aβ1- 42注射模型说明Aβ损害是阿尔茨海默病发病的主要机制,也进一步说明此模型可以作为探索AD病因、寻找AD治疗药物较理想的模型。因此我们采取此模型是符合阿尔茨海默病的发病机制并且其临床表现也符合人类AD的临床表现,为我们下一步的实验奠定了可靠的模型基础。在我们的实验中还发现,进行Morris水迷宫试验测试中比较具有统计学差异,这也说明SPS对阿尔茨海默病模型鼠的认知功能具有保护作用。余正文等[6-8]通过活性筛选发现,柏子仁石油醚提取物对鸡胚背根神经节突起的生长有轻度促生长作用。这些物质的促生长作用有两种可能性:一是促进神经生长因子NGF的合成、分泌及释氧化应激反应对神经元具有直接的毒性作用。由于AD患者中内源性氧化作用增强,而内源性和外源性的抗氧化作用减弱,加上中枢神经系统丰富的脂质成分,因此神经元细胞膜极易遭受自由基的损伤,导致膜的结构破坏和几种乙醛产物的产生;同时自由基的几种成分,特别是羟自由基可以直接破坏核酸,导致染色体的断裂、底物的改变,进而导致蛋白质的变性;此外自由基也可以直接破坏线粒体呼吸链,导致线粒体的变性。这三种因素导致神经元的凋亡甚至是死亡,这可能是导致AD患者神经元丢失的原因。另外氧化应激还与其他致病因素协同作用进一步加重AD的病理过程。
本研究发现,SPS干预组MAD的含量与模型组比较明显降低,说明SPS具有抑制氧化应激反应的能力,从而进一步抑制活性自由基的产生。由于自由基生成减少,由自由基直接造成的神经元细胞膜、DNA的直接损伤以及线粒体呼吸链的损伤会明显减少,神经元的凋亡必然减少,从而发挥其神经元保护作用。本研究还发现SPS干预组GSH的含量和SOD活力均较模型组明显升高,这进一步说明SPS不仅可以通过调节自由基的代谢,也同时可以调节氧化还原反应,加速自由基的清除,减少自由基在神经元内的蓄积,从而对AD模型鼠的海马神经元具有保护作用。但是SPS是直接从基因水平调节氧化应激及抗氧化系统的蛋白质代谢还是间接的作用尚不清楚。笔者推测SPS的作用机制如下:由于SPS促进神经生长因子NGF合成、分泌及释放,且其具有神经生长因子功能,能在基因水平促进抗氧化系统蛋白质的合成,从而促进清除自由基,其亦可通过促进线粒体呼吸链相关蛋白质的合成抑制自由基产生;SPS具有拮抗神经炎症的作用,可减轻神经元损害[9-10]。
在我们的实验中发现,SPS组海马组织Bax、Fas、caspase-3的表达较模型组比较明显降低,两者比较具有统计学意义,说明SPS具有拮抗凋亡的作用,并且细胞内途径和细胞外途径均可以部分拮抗,同时在我们的实验中也发现SPS组海马survivin和Bcl-2的表达明显升高,说明SPS还有促进拮抗凋亡机制的作用。有研究发现[11]在新生小猪低氧缺血模型中SPS在10 mg/d应用时可以明显减少神经元细胞凋亡。有研究发现[12]SPS可以明显减少脑梗死体积百分比,且在海马和皮层单位面积TUNEL阳性细胞的数目明显减少,虽然这两个实验是在缺血中发现的直接证据,也与我们的实验结果基本吻合,也从另外一个角度证实了SPS抗神经元凋亡的效果。SPS调节凋亡是从阻止凋亡通路和激活抗凋亡通路发挥双重作用,但是SPS抗凋亡的具体机制不是很清楚,推测可能与以下机制有关,一是拮抗海马神经元的氧化应激反应,提高抗氧化系统的活性,这在我们前面的实验中已经被证实;二是SPS可以抑制凋亡相关基因的表达[13];三是调节电压门控钙通道和兴奋性谷氨酸受体,减轻细胞凋亡信号的触发因素[14];四是直接抑制APP的合成;五是抑制了乙酰胆碱酯酶的活性。但是在我们的实验中也发现,SPS组海马组织Bax、Fas、caspase-3的表达与正常对照组比较仍然是较高,survivin和Bcl-2的表达较正常对照组低,这说明AD发病机制中神经元的凋亡是一个多途径,多因素的结果,SPS还不能完全拮抗凋亡在AD发病中的作用,这指导
我们在临床应用中,要联合用药。同时我们实验中难以选择一个特异性的凋亡阻滞剂进行对照来进一步评价,需要在下一步实验中进一步完善。
因此,氧化应激反应的增强和抗氧化应激反应系统的减弱必然参与了阿尔茨海默病的发病机制,并且贯穿其发病与发展的整个过程,SPS在阿尔茨海默病模型鼠中表现出了较好的抗氧化应激反应的作用,这必将为AD的治疗带来新的希望,同时也必将扩展祖国医学的深入开发利用。
