树鼩应用于病毒感染性疾病动物模型的研究进展
2018-06-26周风梅李润峰杨子峰张荣平张云辉
周风梅,李润峰,袁 兵,杨子峰,张荣平,张云辉,*
(1.昆明理工大学医学院,昆明 650500; 2.云南省第一人民医院昆明理工大学附属医院,昆明 650000;3.呼吸疾病国家重点实验室/呼吸疾病国家临床研究中心/广州医科大学附属第一医院,广州 510120; 4.昆明医科大学,昆明 650500)
病毒感染性疾病是我国主要传染病之一,常见的有艾滋病、病毒性肝炎、流感、狂犬病等。病毒感染性疾病的发病率很高,约占我国主要传染病发病率的50%(发病率为106.38/10万,致死率为0.91/10万),严重威胁国民健康[1]。病毒感染性疾病的防治需要了解病毒的生物学特性、病原体感染及致病机理,而动物模型是连接人类疾病基础研究和临床应用的重要桥梁,因此,构建灵便有效且与人类有近亲关系的病毒感染模型,对于病毒感染性疾病的防治具有重要意义。目前,在人类病毒感染性疾病研究中已获得广泛应用的非人灵长类动物模型和啮齿类动物模型分别存在价格昂贵和疾病模拟性不足等缺陷,因此急需寻求一种更为理想的病毒学研究动物模型。随着全基因组解析以后进化地位的确立,树鼩已被用于多种病毒性疾病动物模型研究并且优势突显,展示出其作为病毒感染性疾病新型动物模型的巨大潜能。
树鼩是一种形似松鼠的小型哺乳动物,体重一般不超过300 g,广泛分布于南亚、东南亚及我国南部[2]。树鼩与人类在生理学、分类学、基因组学及免疫学等生理生化特性方面的相似性高于常用的大鼠、小鼠等啮齿目实验动物。并且树鼩还具有个体小、成本低、易操作和可感染多种病毒等显著优点。因此,与其它实验动物相比,树鼩是一种较为理想的用于病毒学研究的动物模型。本文从分类学、生理学和免疫学等生物学特征方面阐述了树鼩应用于病毒感染性疾病动物模型的优势,并且重点综述了树鼩在多种人类病毒感染性疾病模型应用中的最新研究进展。
1 树鼩作为病毒感染性疾病动物模型的生物学优势
1.1 分类学
树鼩与灵长类动物的近亲关系在其全基因组得到解析后才最终确立。树鼩与其它29种哺乳动物的基因组数据系统发育分析比较表明树鼩是其中亲缘关系最接近灵长类动物的一种[3]。而对中缅树鼩和其他14个哺乳类动物(其中包括6个灵长类动物)全基因组中的2117个单拷贝基因的系统发育比较也表明树鼩与灵长类物种的亲缘关系更近[4]。此外,树鼩和啮齿类动物的蛋白质序列与人同源比对发现树鼩和人之间的蛋白质相似度较啮齿类动物高,进一步显示树鼩与灵长类动物的亲缘关系高于啮齿类动物。同时,同源比对还发现树鼩的一些重要神经系统和免疫系统信号通路与灵长类动物具有高度的相似性。树鼩与灵长类之间亲缘关系的确立,不仅为进一步研究树鼩提供了基础数据,更重要的是也为树鼩将来能够补充或替代高成本、长周期的非人灵长类实验动物,成为新型的实验动物提供了坚实的遗传基础。
1.2 生理学
树鼩体型小,成年树鼩130~210 g,新生仔体重8~10 g;在人工繁殖条件下无明显繁殖季节,怀孕周期41~45 d,窝产2~6只,哺乳期35 d左右,离乳后约60 d性成熟;出生4~6个月后就可达到成年期[5]。因而,树鼩体小易繁殖的优越生理学特征表明其作为实验动物模型的较易操作性。
1.3 免疫学
1.3.1淋巴细胞与细胞因子
目前,已经在树鼩中鉴定出CD4和CD3ε两种重要的T淋巴细胞分化分子。CD4作为T细胞的协同受体,在抗病毒免疫中具有重要作用。对树鼩CD4(tCD4)全长序列进行扩增和克隆,发现树鼩CD4氨基酸序列与人和猕猴的亲缘关系较近[6],且其氨基酸序列胞外域和胞内域保守性较好,胞外整体结构与人CD4胞外域相似。此外,CD4分子胞内域中的KKTCQC基序在T细胞受体(TCR)介导的信号转导和激活中起重要作用,而在树鼩CD4 胞内域中也有KKTCQC 基序的存在,且该基序在树鼩和人类之间是保守的。CD3表达于T淋巴细胞表面可与T细胞受体(TCR)结合,参与T细胞活化的信号传导。同样,对树鼩的CD3ε编码序列进行了全长扩增和克隆,显示树鼩CD3ε蛋白胞内域与跨膜域高度保守,且与人和恒河猴CD3ε的亲缘关系较近[7]。特别是树鼩TCR/CD3复合物介导的信号转导所需的CD3ε细胞质结构域也与人类的CD3ε细胞质结构域相似。
细胞因子(cytokine, CK)是由活化的免疫细胞产生的介导机体炎症及免疫应答反应的一类低分子量可溶性蛋白质,包括白细胞介素(IL)、干扰素(IFN)、肿瘤坏死因子(TNF)、集落刺激因子(CSF)和生长因子(GF)等。其中,干扰素(IFN)是抵抗病毒的第一道防线。基于树鼩的基因组学,Li等[8]预测并鉴定出了树鼩中存在的五种I型IFN亚型(α, β, ω, κ, ε和δ), II型IFN(γ)和两种III型IFN(λ1, λ2/3)。除了半胱氨酸位置和N-糖基化数量的微小差异外,树鼩IFN-α和IFN-β的预测结构接近于人类。对树鼩TNF-α克隆后发现与人TNF-α相似度高达84.8%[11]。此外,白介素-7(IL-7)在调节T细胞体内平衡和克服慢性病毒感染等方面起重要作用[9]。树鼩转录本tsIL7-sv2、tsIL7-sv4和tsIL7-sv5的剪接区域分别与人IL7δ5、IL7δ3/4和IL7δ3/4/5具有同源性[10]。树鼩与人在免疫细胞和细胞因子的结构和功能方面的相似性,为树鼩作为病毒感染性疾病模型提供了理论基础。
1.3.2“眼睛”与“桥梁”
模式识别受体(pattern recognition receptor, PRRs)是天然免疫反应起始阶段识别微生物病原体的 “眼睛”,这些受体通过识别病原体相关分子模式(pathogen-associated molecular patterns, PAMPs)来抵御病原微生物对宿主的入侵并激发下游信号通路,从而引发天然免疫反应。在目前已公认的四种PRRs 中,Toll样受体(TLRs)与病毒感染后引起宿主的天然免疫密切相关。在树鼩中已鉴定出13种功能性TLR(tTLR1-tTLR13),系统进化分析发现树鼩TLRs的结构不但保守而且与其它哺乳动物的TLRs具有高度相似性。有趣的是,树鼩感染HCV后,原代肝细胞中的tTLR2,tTLR3,tTLR4和tTLR8的mRNA转录物发生的变化与人感染HCV后肝细胞中的变化相似,这表明树鼩与人可能具有相似的HCV感染模式[12]。
主要组织相容性复合体(major histocompatibility complex, MHC)是免疫应答反应中呈递抗原的“桥梁”,有助于T细胞受体(TCR)的识别并启动免疫应答。研究发现,树鼩和灵长类的MHC I类基因结构相似,都有8个外显子和7个内含子。并且除第2、5和6外显子分别有3 bp、9 bp和3 bp的缺失外,树鼩其余的外显子长度与人和恒河猴相同[4]。树鼩MHC I类基因氨基酸序列对比显示其半胱氨酸位点、糖基化位点和CD8+T细胞结合位点等都非常保守并且与灵长类相同[13],这表明树鼩MHC I类分子可能具备MHC分子的经典功能。树鼩与人在PRRs和MHC分子结构和功能上的相似性,显示出其作为病毒感染性动物模型的巨大优势。
综上,树鼩与人在分类地位和进化程度的亲缘性,以及树鼩在诸多病毒相关免疫因子(如淋巴细胞、细胞因子、PRRs及MHC等)与人类之间存在的相似性,体现了树鼩作为新型病毒感染性实验动物模型的潜在优越性。
2 树鼩在人类病毒感染性疾病中的应用
2.1 肝炎病毒(Hepatitis viruses)
常见的肝炎病毒包括乙型肝炎病毒(hepatitis B virus, HBV) 和丙型肝炎病毒(hepatitis C virus, HCV),能够引起急性和慢性肝炎,并发展为肝硬化和肝癌等严重的肝脏性疾病,每年大约有80~100万人因此而死亡。因此,建立一种有效的肝炎病毒感染动物模型,对肝炎病毒的致病性研究及药物研发具有重大意义。
2.1.1乙型肝炎病毒(HBV)
2.1.2丙型肝炎病毒(HCV)
黑猩猩是目前为止除人以外唯一对HCV易感的物种。虽然已经证实HCV可以在黑猩猩体内复制,且复制效率和对HCV的免疫应答与人体相似,但黑猩猩感染HCV后的肝脏病变较弱,且无慢性肝炎症状[20],阻碍了其在肝硬化和肝细胞癌致病机理等方面的研究。转基因小鼠通过模仿人的肝脏环境,使其对HCV易感,但转基因小鼠与人之间的体内环境和病理机制存在本质差异,在HCV感染机制方面的研究也有一定的局限。近期研究称HCV可在树鼩原代肝细胞和活体上有效复制和感染[21]。Zhao等[22]以HCV阳性病人血清感染树鼩原代肝细胞后,在肝细胞及培养上清中检测到负链RNA,持续培养两周后仍可检测出病毒RNA。Feng等[21]构建树鼩体内感染模型,在其肝组织中检测出了HCV RNA,免疫组化还发现了4种HCV特异性蛋白(core, E2, NS3/4及NS5A),同时发现与人相似的轻微肝炎症状。树鼩原代肝细胞及活体均可支持HCV有效感染、复制和传播,并发生与人相似的炎症反应,证明树鼩可作为一种潜在的丙型肝炎动物模型。树鼩与其它HCV感染常用研究模型的比较具体见表2。
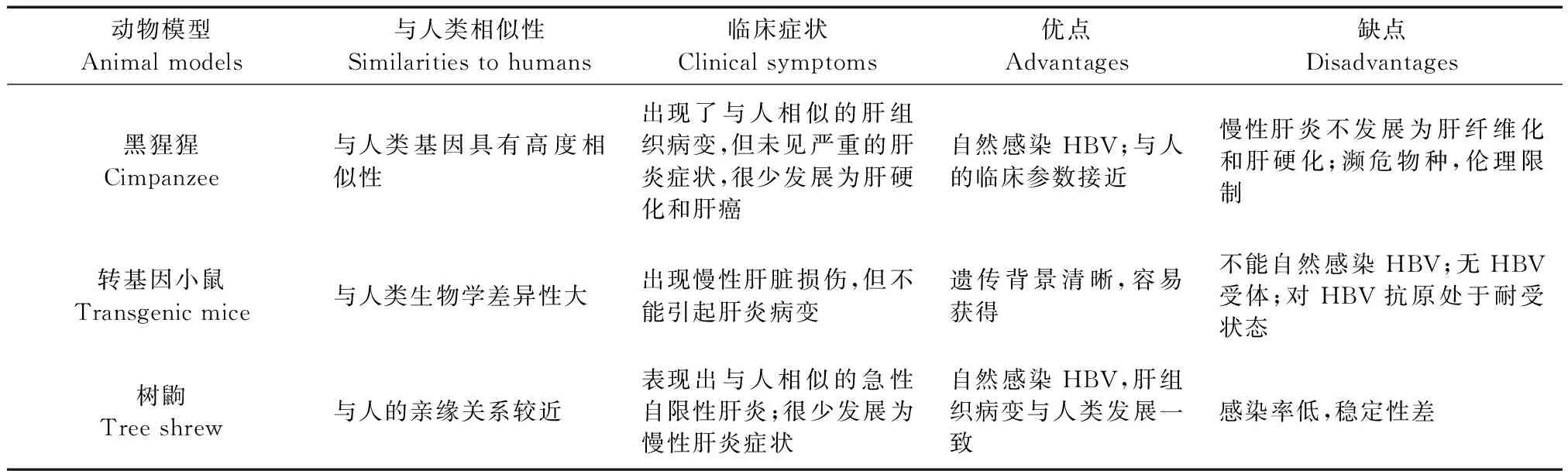
表1 HBV常用动物模型及其优缺点

表2 HCV 常用动物模型及其优缺点
2.2 单纯疱疹病毒(herpes simplex virus,HSV)
单纯疱疹病毒是人类容易感染的病原体之一,一经感染将终身潜伏在体内,而且容易复发,严重危害人类健康。目前常用小鼠和家兔等啮齿类动物来研究HSV感染的致病性[23],但小鼠和家兔感染的潜伏期与人类不同[24],且感染HSV后的免疫反应与人类也有一定的差异性[25],因而研究人员试图建立HSV树鼩感染模型。Darai等[26]发现幼龄树鼩对HSV具有易感性且感染后检测发现肝脏发生严重的病理组织学变化,出现了类似疱疹肝炎症状,肝脏和脾脏可检测出高滴度的HSV病毒。Li等[24]用HSV-1 17+毒株接种后树鼩出现了类似于人感染HSV的脑炎症状,如:共济失调、站立不稳、倾斜等异常行为,并在树鼩脑组织中检测到了HSV-1 DNA,进一步证实树鼩对HSV易感。以上结果说明树鼩可作为研究HSV感染机制和致病性的潜在动物模型。
2.3 流感病毒(Influenza virus)
流感病毒是一种急性的高传染性病毒,如甲型H1N1流感病毒、新近暴发的H7N9流感病毒等,可随季节性暴发流行,给人类的健康和财产带来了很大的危害。对于流感病毒的动物模型,先前已报道关于雪貂和小鼠的研究。不过雪貂虽敏感,却不易获得;而小鼠必须连续传代方可适应。树鼩的人/禽流感病毒受体分布比较接近人,且有较好的行为表象一致性和致病机制同源性。朱宇同等[27]对树鼩通过鼻腔接种A、B、C三种流感病毒,发现流感病毒A3型、新A1型或B型可成功感染树鼩,出现规律排毒和抗体增加等现象,并且大多数感染的树鼩伴随有上呼吸道感染、体温曲线不规律等症状。YANG等[28]发现树鼩感染H1N1流感病毒后表现出轻度或中度的呼吸道感染症状,并在其上呼吸道检测到了H1N1的复制,表明树鼩可感染流感病毒,为树鼩作为流感病毒研究的实验模型提供良好的佐证。
2.4 肠道病毒(Enterovirus)
肠道病毒EV71是造成儿童手足口病(hand, food and mouth disease, HFMD)的主要病原体之一,会对婴幼儿的生命健康造成较大的威胁。已有报道,大部分肠道病毒可感染食蟹猴、恒河猴或猕猴等非人灵长类动物,但是感染后的病理症状明显不足。EV71静脉注射食蟹猴后,感染动物虽然表现出与人感染相似的病毒血症、震颤、脑水肿以及共济失调等典型症状[29],但不会出现发烧症状且即使使用不同毒性的毒株感染食蟹猴也不能观察到明显的神经毒力作用。 EV71感染恒河猴后虽然引起手足口皮疹症状,却不能引起典型的神经系统症状[30]。王文广等[31]对3个月龄的树鼩进行EV71感染实验,发现其体温、白细胞和淋巴细胞水平均有升高趋势;继续感染两周后,部分树鼩出现了急性松弛性瘫痪,并有尿潴留症状,组织病理学检查发现在脑、心、肺、脾、肾等部位伴随有相应的病理变化,表明EV71病毒可感染幼龄树鼩。柯萨奇病毒(Coxsackievirus, CV) A 组16 型(CA16)属于小核糖核酸家族的肠道病毒属, 是人手足口病的另一种主要病原体。在CA16感染猕猴模型的研究中,感染的猕猴手足口部出现了疱疹并伴随发热症状,同时观察到典型的病毒血症和多种组织病毒载量上升等类似CA16感染人类的临床症状[32],但其病理变化较弱,且不能够产生有效的中和抗体反应,因而极大阻碍了该模型的广泛应用。李建平等[33]用CA16感染树鼩后,在其多种器官以及中枢神经系统和粪便中发现高载量病毒,同时肺、肾等组织中也出现细胞损伤和炎性细胞侵润等病理反应,说明树鼩对CA16具有敏感性,适合发展为研究CA16的潜在动物模型。
2.5 其他病毒
另外,在基孔肯雅(chikungunya, CHIK)、登革病毒(dengue virus,DENV)及EB病毒(Epstein-Barr virus, EBV)等其它病毒方面也有树鼩相关模型的研究。基孔肯雅病是由CHIK病毒引起的一种人兽共患病,主要流行于非洲和东南亚地区。张海林等[34]用CHIK病毒感染树鼩后出现了病毒血症,并产生了高滴度的血凝抑制抗体;此外在脑、肺、肝、脾、肾等内脏中检测到了病毒,并发现有发炎和出血现象,表明树鼩对CHIK 病毒较为敏感,可作为本病毒的实验动物模型应用于有关研究中。登革病毒属于黄病毒科(Flavivirade)黄病毒属(Flavivirus)中的一个血清型亚群,主要通过埃及伊蚊和白蚊伊蚊等媒介传播,由该病毒引起的登革热已成为继疟疾之后全球传播最广的第二大虫媒疾病。姜黎明在构建登革病毒树鼩模型的研究中,发现感染树鼩有发烧、死亡、病毒血症和氨基酸转移酶偏高等现象,这些症状表明树鼩可作为DENV的新模型的候选动物,为未来建立成熟的登革热动物模型提供科学依据。EB病毒是疱疹病毒科嗜淋巴细胞病毒属的成员。在最近报道的EB病毒感染树鼩的研究中,发现EB病毒的拷贝量及其抗体都有不同程度的增加,同时观察到树鼩肝、脾和肠系膜淋巴结肿大,此外出现了脾小体增生,在肝脏和肠系膜淋巴结中有炎性细胞侵润等炎症反应[35],表明树鼩作为EBV动物模型的潜能。
综上,树鼩作为一种新的模式动物,不仅繁殖快、体型小,易操作、成本低,且能够感染多种与人类疾病相关的病毒并呈现出与人类感染病毒相似的疾病病程,因而是一种用于病毒学研究较为理想的动物模型。
3 展望
综上所述,树鼩全基因组的解析及分类和进化地位的确立,加之树鼩与人类有着相似的生理生化及免疫学等生物学特性,这都为树鼩成为研究人类病毒感染性疾病的新型实验动物奠定了坚实的基础。但一种实验动物模型的应用,需要建立在清晰的遗传背景、规模化的繁殖及稳定的遗传成分等基础之上,而这些缺陷也是目前树鼩在致病机制研究与药物及疫苗研发应用中遇到的瓶颈。另外,目前市场上针对树鼩专有的检测试剂盒仍然十分缺乏,在很大程度上制约了树鼩在医学生物学领域的研究。因此,树鼩模型研究中的缺陷问题亟需解决。可喜的是,近年来世界上一些国家已经开展了树鼩实验动物化的研究并取得了一定的进展,我国也正努力建立相应的纯化品系,使树鼩的饲养及繁殖规模化和标准化,并试图研发树鼩专有的特异性检测试剂盒[36]。因而树鼩将有望发展为一种新颖而完善的病毒感染性疾病动物模型,并广泛应用于医学动物实验中,尤其在探讨人类疾病致病机制和开发新型治疗药物等方面发挥更大作用。
参考文献:
