全脑放疗联合替莫唑胺对脑转移瘤患者中位生存期的影响
2018-06-25刘桂兰
刘桂兰
鹤壁市人民医院肿瘤内科,河南 鹤壁 458000
脑转移瘤也称颅内转移瘤,多由原发于身体其他部位的肿瘤细胞转移进入颅内而引起[1]。其中肺癌脑转移临床最为常见,其次为黑色素瘤、泌尿生殖系统的肿瘤以及消化道的肿瘤[2]。20~50岁是脑转移瘤的高发期,男性多于女性,肿瘤脑转移预示着肿瘤细胞已广泛扩散,此时,自然中位生存期往往只有3个月左右[3]。本研究以105例肿瘤脑转移患者为研究对象,观察全脑放疗联合替莫唑胺的疗效及对患者中位生存期的影响。
1 资料与方法
1.1一般资料选取鹤壁市人民医院肿瘤内科2013-06—2015-12收治的105例肿瘤脑转移患者,经CT、MRI、B超等检查确诊,符合脑转移肿瘤的诊断标准[4],患者知情并签署知情同意书,经医院伦理委员会批准,排除有药物禁忌证,不能配合治疗的患者及中途退出者。采用随机平行对照法分组,对照组52例,男31例,女21例;年龄43~68(55.34±2.01)岁;脑转移瘤类型:肺癌脑转移28例,结肠癌脑转移15例,乳腺癌脑转移9例。观察组53例,男33例,女20例;年龄42~69(54.93±2.31)岁;脑转移瘤类型:肺癌脑转移29例,结肠癌脑转移16例,乳腺癌脑转移8例。2组一般资料对比差异无统计学意义(P>0.05),具有可比性。
1.2治疗方法2组均给予全脑放疗,采用直线加速器(美国瓦里安医疗系统公司生产,型号UNIQUE)6 MV光子线全脑对穿照射放疗,利用热解塑料面罩固定体位,DT 40 Gy,2 Gy/次,分20次进行,4周内完成。观察组在此基础上给予替莫唑胺(江苏天士力帝益药业有限公司生产,国药准字H20040637)口服,28 d为1个疗程,第1个疗程150 mg/m2,1次/d,连服5 d;第2个疗程200 mg/m2,1次/d,连服5 d;第3~6个疗程可根据患者的身体状况适当调节药量,但最低不能低于100 mg/m2。放疗期间依据患者的病情,适当给予甘露醇以及地塞米松行脱水治疗,同时密切观察血象变化,必要时给予粒细胞集落刺激因子皮下注射,用以提升白细胞水平[5],2组均在6个疗程后进行疗效对比。
1.3观察指标(1)临床疗效:采用WHO制定的实体瘤近期疗效评价标准,治疗后肿瘤完全消退,无新病灶产生,且维持时间4周以上,为完全缓解(CR);治疗后肿瘤减少一半以上,无新病灶产生,维持4周以上,为部分缓解(PR);治疗后肿瘤减少<50%或增加<25%,为稳定(NC);治疗后肿瘤体积增大>25%或出现新病灶,为进展(PD)[6]。其中CR+PR=近期疗效。(2)生存时间:治疗结束后,电话跟踪随访,记录2组无进展生存时间及中位生存时间,并进行对比[7]。(3)不良反应:观察并记录2组治疗期间不良反应发生率,并进行对比[8]。
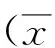
2 结果
2.1临床疗效观察组总有效率高于对照组,差异有统计学意义(χ2=10.460 8,P=0.001 2)。见表1。
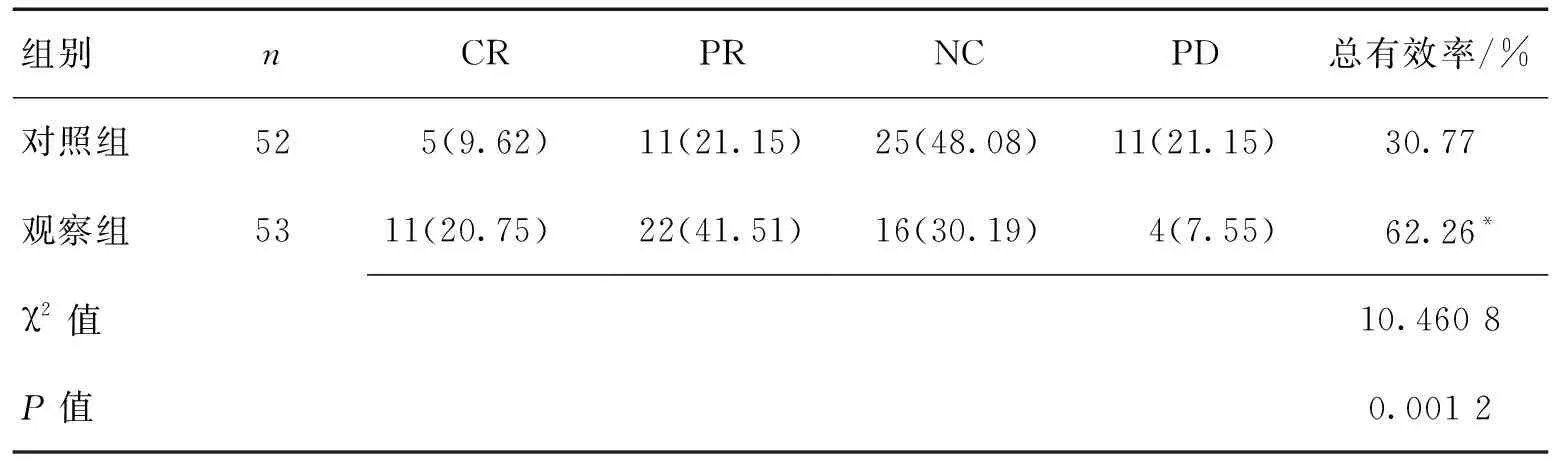
表1 2组临床疗效对比 [n(%)]
注:与对照组比较,*P<0.05
2.2生存时间观察组治疗后无进展生存时间、中位生存时间均高于对照组,差异有统计学意义(P<0.05)。见表2。
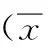
表2 2组治疗后生存时间对比±s,月)
注:与对照组比较,*P<0.05
2.3不良反应观察组出现骨髓抑制4例,恶心呕吐1例,不良反应发生率9.43%(5/53);对照组出现骨髓抑制9例,恶心呕吐4例,不良反应发生率25.00%(13/52),2组不良反应发生率对比差异有统计学意义(χ2=4.477 5,P=0.034 3)。
3 讨论
脑部是恶性肿瘤转移的高发部位[9]。临床研究证实[10],对恶性肿瘤患者进行尸检发现,近30%的患者出现肿瘤脑转移,肿瘤脑转移常见的原发部位有肺部、乳腺、消化道等,其中肺癌是最为常见的原发部位,占38%左右[11]。肿瘤脑转移后往往起病缓慢,但病程进展较为迅速,临床表现为头痛、恶心呕吐、语言功能障碍、肌力减退、神经麻痹等,自然中位生存期往往只有3个月[12],且治疗时由于不良反应较大,对生活质量造成严重影响[13]。因此,如何能够提高临床疗效、延长生存期以及增加安全性已成为临床重要课题之一[14]。
临床对于肿瘤脑转移患者常用的治疗方法有手术治疗以及全脑放疗[15],但手术治疗主要适用于单发性肿瘤脑转移,身体素质较好患者,对于病灶较多、大,且身体素质较差的患者则不适用[16]。全脑放疗依然是治疗肿瘤脑转移患者的主要方法,所有患者均可应用,全脑放疗能够通过对脑部进行对穿放射性照射,控制颅内肿瘤的生长,具有不受血脑屏障以及原发病灶影响的优点[17]。同时,对于肿瘤细胞、周围浸润细胞以及亚临床病灶亦有较佳的治疗效果,脑转移瘤的体积通常较小,直径多在4 cm左右,边界较为清晰,多呈圆形,常发生于脑部灰白质的交界处,脑转移的肿瘤患者多是实质性占位[18],瘤内基本都是病变组织,无正常组织,应用全脑放疗治疗能够取得较佳的效果。但由于剩余的正常脑部组织受到放疗剂量的影响,应用全脑放疗并不能够彻底杀灭所有恶性肿瘤,全脑放疗后仍有30%左右的患者肿瘤难以得到有效控制,临床效果欠佳[19]。由于疾病控制情况不佳,继续发展极易导致疾病进一步发展或脏器衰竭。随着研究的进一步深入,静脉化疗逐渐应用于临床,联合全脑放疗后显著提升治疗效果,但有较大争议,主要是因脑脊液中化疗药物的浓度会被血脑屏障降低,通过静脉化疗作用于机体后可能达不到有效的药物浓度,不仅效果不会明显,还会进一步增加不良反应发生率,降低耐受性,影响治疗进程,故全脑放疗联合静脉化疗不能大范围推广[20]。基于以上因素,若想进一步提升脑转移瘤患者的治疗效果,在选择静脉化疗药物时,不仅需要较佳的放射增敏作用及强大的肿瘤细胞杀伤能力,还应兼具较高的血脑屏障穿透率,以及较低的不良反应发生率,在提升治疗效果的同时,最大限度提升治疗耐受性[21]。由于内皮细胞连接较为紧密,同时毛细血管内皮细胞无窗孔,导致多种药物不能通过血脑屏障进入神经组织,而溶于脂类、分子量小的药物能够较易通过[22]。
替莫唑胺是一种咪唑并四嗪类的烷化剂,具有独特的作用机制及抗肿瘤活性。替莫唑胺在生理pH条件下,经快速非酶的催化,能够转变为活性的化合物MTIC,能够通过DNA鸟嘌呤的O6和N2位点上的烷基化,发挥出细胞毒性[23],以灭杀肿瘤细胞。替莫唑胺本身无活性,抗肿瘤谱较宽,能够轻易透过血脑屏障,发挥药理作用,在酸性环境下较为稳定[24];同时,该药口服后吸收迅速,在机体内不经肝脏代谢,生物利用度高,接近100%,且在机体内与血浆蛋白的结合率较低,脂溶性高、分子量小,在脑脊液及中枢系统中的渗透性高,同时能够维持较高的血药浓度,重复给药不会有药物蓄积的情况,且具有可逆性,剂量累计无毒性,患者耐受性好,故应用于临床能够显著降低不良反应发生率,提升安全性[25]。临床研究表明,与其他药物叠加应用无毒性,已成为临床治疗肿瘤脑转移的常用药物[26]。全脑化疗联合替莫唑胺在协同作用下进一步提高治疗效果,能够通过增效后强大的肿瘤细胞杀伤能力,显著改善临床症状,提高生存质量,延长生存时间,安全性较高[27]。本研究显示,观察组治疗后总有效率高于对照组,治疗后无进展生存时间、中位生存时间均高于对照组,不良反应发生率低于对照组,与尤光贤等[28-33]研究相当,证实其能够有效改善患者症状,延长生存时间,降低不良反应发生率。
[1] 孙宗文,张妍.颅脑放疗联合替莫唑胺治疗非小细胞肺癌脑转移30例[J].肿瘤学杂志,2016,22(1):53-56.
[2] 李子煌,李先明,杨东,等.替莫唑胺联合全脑放疗治疗非小细胞肺癌脑转移瘤的疗效观察[J].广东医学,2017,38(10):1 593-1 597.
[3] 邵蔚,胡毅.替莫唑胺治疗脑转移癌的疗效与安全性综述[J].解放军医学院学报,2017,38(7):703-705.
[4] 毛英,刘黎,张匠,等.替莫唑胺联合全脑放疗对乳腺癌脑转移患者的疗效评价[J].医学临床研究,2016,33(8):1 542-1 543;1 546.
[5] 苏雷,胡玲,崔桂敏,等.MGMT及IDH1表达与替莫唑胺联合全脑放疗治疗非小细胞肺癌脑转移疗效的关系[J].重庆医学,2017,46(21):2 976-2 979.
[6] 滕菲,崔桂敏,史鸿云,等.放疗联合替莫唑胺治疗非小细胞肺癌脑转移瘤的临床观察[J].国际肿瘤学杂志,2017,44(4):271-273.
[7] 李小芳,王悦,陈雪,等.替莫唑胺在MGMT高表达的非小细胞肺癌脑转移治疗中的应用观察[J].陕西医学杂志,2017,46(3):387-390.
[8] 柳影,王莹,刘显红,等.不同化疗方案治疗放疗后进展的小细胞肺癌脑转移患者效果及安全性比较[J].肿瘤研究与临床,2017,29(3):172-175;179.
[9] 潘振宇,于洪泉,许海洋,等.成人高级别胶质瘤脑膜转移16例临床分析[J].中华神经科杂志,2016,49(8):625-629.
[10] 林昌海,李丽仙,冉静,等.脑胶质瘤血液循环肿瘤标志物研究进展[J].重庆医学,2016,45(30):4 293-4 296.
[11] 笪海棠.恶性滋养细胞肿瘤脑转移治疗效果及预后危险因素分析[J].中国实用神经疾病杂志,2016,19(4):92-94.
[12] 梅芬,卢忠心.肺癌脑转移与血清肿瘤标志物水平的关系[J].临床与实验病理学杂志,2016,32(1):96-98.
[13] 付艳,焦顺昌,杜楠.肺癌脑转移的治疗进展[J].海南医学院学报,2017,23(8):1 149-1 152.
[14] 孙增峰,孙亚方,谈丽彩,等.结直肠癌脑转移的临床特征及预后因素分析[J].中华肿瘤杂志,2016,38(1):63-68.
[15] 孙文宇,马克威.EGFR-TKI治疗非小细胞肺癌脑转移的研究进展[J].中国老年学杂志,2016,36(20):5 213-5 215.
[16] 张淼,胡蓉,毛志远,等.不同分子分型乳腺癌脑转移癌临床特征及其生存分析[J].武警医学,2016,27(8):792-795;799.
[17] 张健欣,王淑珍,李博,等.妇科恶性肿瘤脑转移23例临床分析[J].中华医学杂志,2016,96(23):1 843-1 846.
[18] 路长红,马莉,孙增峰,等.非小细胞肺癌脑转移手术治疗预后相关因素分析[J].中华肿瘤防治杂志,2016,23(10):677-681.
[19] 李健能,李龙,刘希垄,等.胸部CT征象对周围型非小细胞肺癌脑转移的预测价值[J].临床放射学杂志,2016,35(6):871-876.
[20] 姜燕慧,刘宜敏,毕卓菲,等.脑转移灶体积评估非小细胞肺癌脑转移行全脑放疗的预后分析[J].广东医学,2017,38(7):1 085-1 088.
[21] 周先申,万经海.多发脑转移瘤手术指征及综合治疗探讨[J].中国临床医生杂志,2017,45(4):69-72.
[22] 何华钰,颜成睿,刘帅,等.乳腺癌脑转移的研究进展[J].中国微侵袭神经外科杂志,2016,21(8):374-376.
[23] 陈腊,张小林,蒋峰,等.肿瘤标志物D-二聚体血小板计数对肺癌脑转移的诊断及其对预后的评估[J].浙江临床医学,2016,18(6):1 011-1 013.
[24] 刘先领,李立群.脑转移瘤的综合治疗策略及最新进展[J].医学与哲学,2016,37(4):13-16;19.
[25] 宋琪,焦顺昌,李方.非小细胞肺癌脑转移的靶向和免疫治疗[J].中国肺癌杂志,2016,19(8):530-532.
[26] 王庆兰,李敬芳,孙小英,等.高放射剂量对甲状腺癌脑转移患者生存期及肿瘤标志物水平的影响[J].实用临床医药杂志,2017,21(11):186-188.
[27] 李丹,毛伟敏,苏丹,等.非小细胞肺癌脑转移的治疗进展[J].医学研究杂志,2016,45(5):10-12;9.
[28] 尤光贤,文强,蒋先明,等.全脑放疗联合替莫唑胺治疗脑转移性肿瘤的临床疗效分析[J].中华全科医学,2014,12(7):1 056-1 058.
[29] RADES D,DZIGGEL L,BLANCK O,et al.Predicting the Risk of Developing New Cerebral Lesions After Stereotactic Radiosurgery or Fractionated Stereotactic Radiotherapy for Brain Metastases from Renal Cell Carcinoma[J].Anticancer Res,2018,38(5):2 973-2 976.
[30] DZIGGEL L,GEBAUER N,BARTSCHT T,et al.Performance Status and Number of Metastatic Extra-cerebral Sites Predict Survival After Radiotherapy of Brain Metastases from Thyroid Cancer[J].Anticancer Res,2018,38(4):2 391-2 394.
[31] BERGHOFF A S,BRASTIANOS P K.Toward Precision Medicine in Brain Metastases[J].Semin Neurol,2018,38(1):95-103.doi:10.1055/s-0038-1627469.
[32] HAMILTON A M,WONG S M,WONG E,et al.Cranial irradiation increases tumor growth in experimental breast cancer brain metastasis[J].NMR Biomed,2018,31(5):e3907.doi:10.1002/nbm.3907.
[33] AMELOT A,TERRIER L M,MATHON B,et al.Can anticancer chemotherapy promote the progression of brain metastases?[J].Med Oncol,2018,35(3):35.doi:10.1007/s12032-018-1097-4.
