产气荚膜梭菌ε毒素突变体的表达及免疫保护力评价
2018-06-23杜吉革彭小兵张秀坤李启红印春生姚文生蒋玉文陈小云
杜吉革,彭小兵,张秀坤,朱 真,薛 麒,王 磊,李启红,印春生,姚文生,康 凯,蒋玉文,陈小云
(中国兽医药品监察所,北京 100081)
产气荚膜梭菌旧称魏氏梭菌,是一种重要的人畜共患病原,常常诱发创伤性气性坏疽和人类食物中毒以及羔羊痢疾、牛羊坏死性肠炎、牛羊肠毒血症[1-3],对畜牧业造成巨大经济损失[4-7]。产气荚膜梭菌的主要致病因子是其分泌的引起人和动物发病的外毒素[8]。根据产生的4种主要致死性外毒素α(CPA)、β(CPB)、ε(ETX)和ι(CPI)的种类,将该菌分为A、B、C、D、E五个毒素型[9]。由B型和D型产生的ETX[10],在该菌所有外毒素中毒力最强[11]。该分子主要分为I、II和III三个区域,且有两条肽链同时跨过I、II和III三个区域[12],这导致仅使用ETX的一个域作为疫苗候选抗原的策略(如CPA、CPB的C末端[13-14])很难应用于该毒素的防控。因此,实现毒素的减毒乃至无毒,对于开发毒素基因工程亚单位疫苗,及以其作为抗原组分的多价亚单位疫苗的研究和应用显得尤为重要。已有的研究发现,106位组氨酸突变为脯氨酸的重组ETX基本是无毒的,且保留了良好的免疫原性[15-17]。然而,该蛋白的可溶性表达量非常低,不足5%[18-19],这将大大增加该蛋白用于制备亚单位疫苗的纯化难度和生产成本,同时降低了表达蛋白的免疫原性。
已有的研究发现,将目的基因按照大肠杆菌偏好的密码子进行优化后可明显促进目的蛋白的可溶表达[20-21]。为此,对我国现行D型产气荚膜梭菌制苗用菌株(C60-2株)ETX的编码基因进行了优化研究,同时突变第106位氨基酸,经原核系统表达、纯化和鉴定,并对其毒力和免疫原性进行了研究。
1 材料与方法
1.1 试验材料 D型产气荚膜梭菌C60-2株、D型产气荚膜梭菌C60-2株天然毒素、兔源D型产气荚膜梭菌毒素抗血清以及pET-30a(+)表达载体均为中国兽医药品监察所基础保障处微生物实验室保存;1.5~2.0 kg普通级健康日本大耳白兔和16~18 g ICR小鼠购自北京维通利华实验动物技术有限公司;pEASY-Blunt Cloning Vector、感受态细胞Top10和BL21(DE3)购自北京全式金生物技术有限公司;Montanide ISA 201佐剂购自法国赛彼科(seppic)公司;Ni-IDA亲和层析介质试剂盒、蛋白Marker、Western blot Marker、蛋白溶解液(50 mmol/L Tris-HCl,10% Glycerol,150 mmol/L NaCl,pH 8.0), 均购自南京金斯瑞生物科技有限公司; 高保真PCR酶(KFX-401S)购自东洋坊公司;premix Taq version 2.0、DNA Marker购自Takara公司。T4 DNA连接酶、DNA凝胶回收试剂盒购自Promaga公司;限制性内切酶NdeⅠ和Hind Ⅲ购自NEB公司;抗His标签单抗、Bradford蛋白浓度测定试剂盒,购自碧云天生物技术有限公司;明胶缓冲溶液,LB培养基购自北京中海生物科技有限公司。
1.2 基因合成及密码子优化 以前期扩增的D型产气荚膜梭菌C60-2株ETX编码基因为模版,按大肠杆菌偏爱的密码子进行了优化设计和人工合成。同时将第106位组氨酸突变为脯氨酸。此外,在突变基因后添加6*His标签蛋白序列。基因合成由南京金斯瑞生物科技有限公司完成,合成的基因称为GETXH106P。
1.3 ETX突变体原核表达载体的构建 以GETXH106P基因为模板,采用引物对GETXH106P-F/ GETXH106P-R进行PCR扩增。其中上游引物GETXH106P-F序列为:5'-CGCCATATGAAAGAAA ̄TCTC -3',其5'端引入限制性内切酶NdeⅠ位点(下划线部分)及保护性碱基;下游引物GETXH106P-R序列为:5'-CCGAAGCTTTTAGTGGTGATG,其5'端引入限制性内切酶Hind Ⅲ位点及保护性碱基(下划线部分)。PCR体系为50 μL。PCR反应条件为:94 ℃预变性4 min;98 ℃变性10 s,56 ℃退火30 s,68 ℃延伸60 s,共33个循环;最后68 ℃延伸7 min。扩增得到的目的DNA条带,经回收后,采用NdeⅠ/Hind Ⅲ双酶切消化,与经过相同酶切消化的pET30a(+)载体连接。将连接好的质粒转化Top10感受态细胞,挑取单克隆至含有卡那霉素的LB液体培养基中,37 ℃振荡培养过夜,提取质粒进行PCR和双酶切鉴定,鉴定结果为阳性的质粒送中美泰和公司测序,将测序正确的质粒命名为pET30a-GETXH106P。
1.4 重组蛋白的表达与鉴定 将pET30a-GETXH106P质粒转化BL21(DE3)感受态细胞,分别在16 ℃和37 ℃条件下用IPTG诱导表达,收集菌体,超声破碎后分别收集上清和沉淀,采用SDS-PAGE检测重组蛋白的表达情况及其可溶性,将表达的目的蛋白称为rETXH106P。采用Western blot方法,以抗His标签蛋白抗体为一抗,以HRP标记的山羊抗鼠IgG为二抗进行孵育,进而对重组蛋白做进一步的鉴定。
1.5 重组蛋白的纯化与鉴定 按照Ni-IDA亲和层析介质试剂盒的使用说明书对菌体裂解上清中呈可溶性表达的目的蛋白进行纯化,用Bradford蛋白浓度测定试剂盒测定蛋白浓度,-80 ℃保存备用。将纯化后的目的蛋白(0.5 μg)经SDS-PAGE电泳后转印至PVDF膜上,以兔源D型产气荚膜梭菌抗毒素为一抗,以HRP标记的山羊抗兔IgG为二抗进行孵育,按照底物显色试剂盒说明书进行显色,检测纯化的重组蛋白与D型产气荚膜梭菌抗毒素的反应情况。
1.6 重组蛋白的纯化与鉴定
1.6.1 细胞毒性试验 将MDCK细胞接种96孔细胞培养板,置37 ℃、含5% CO2的培养箱中培养至形成细胞单层后,弃细胞生长液。将rETXH106P用细胞维持液稀释至100 μg/mL以及10 μg/mL,每个稀释度各接种3孔细胞,每孔100 μL,置37 ℃、含5% CO2的培养箱中培养24 h,观察并记录细胞的病变情况。同时将肉肝胃酶消化汤和洗脱液用细胞维持液稀释100倍后,分别孵育细胞,作为阴性对照组,将D型产气荚膜梭菌C60-2株天然毒素做5000倍稀释后作为阳性对照。
1.6.2 小鼠的毒力测定 已有的研究发现,产气荚膜梭菌ETX首先以前体毒素形式分泌,当被蛋白酶,如胰酶、糜蛋白酶以及羧肽酶等,切除N端以及C端相应的氨基酸后,毒素被活化,从而发挥相应的生物活性[22-24]。活化的ETX对小鼠的半数致死量可达50 ng/kg[25]。按照我国现行《中华人民共和国兽药典》(2015年版)规定的方法,用终浓度为1%的胰酶对纯化的rETXH106P在37 ℃条件下活化1 h。将16~18 g ICR小鼠随机分为9组,每组5只。分别用活化前和活化后的rETXH106P静脉注射,注射剂量分为1 μg(6.25×104ng/kg)、10 μg(6.25×105ng/kg)、100 μg(6.25×106ng/kg)3个梯度。同时设置胰酶消化液(终浓度为1%)以及蛋白溶解液两个阴性对照和1个MLD的天然毒素阳性对照。所有样品均用明胶缓冲液进行稀释,注射的液体总体积为200 μL。注射后观察2 d,记录小鼠的存活状态。
1.7 免疫原性分析
1.7.1 免疫程序 将合适浓度的纯化rETXH106P与Montanide ISA 201佐剂以1∶1(V/V)的比例配制成rETXH106P终浓度为50 μg/ml的疫苗,另取灭菌PBS与Montanide ISA 201佐剂以1∶1(V/V)的比例制备对照疫苗,置4 ℃保存备用。选用体重1.5~2.0 kg健康家兔,测定免疫前每只家兔血清对D型产气荚膜梭菌毒素的中和效价。取8只对D型产气荚膜梭菌毒素的中和效价为0的家兔,其中4只各颈部皮下注射疫苗,2.0 mL/只,免疫后14 d,以相同剂量、相同途径进行二次免疫。另外4只以相同剂量、相同途径和相同方法免疫对照疫苗作为对照组。
1.7.2 血清中和抗体效价测定 分别在一免后14 d以及二免后21 d,对实验组及对照组所有兔经耳缘静脉采血,分离血清备用。按照《中华人民共和国兽药典》(2015年版)三部中规定的方法测定血清中和效价[26]。
1.7.3 攻毒试验 二免后21 d,对免疫组及对照组所有家兔经耳缘静脉各注射1个MLD的天然毒素进行攻毒,观察5 d,记录家兔的死亡情况。根据免疫组及对照组家兔的死亡情况,判定试验疫苗的免疫保护效力。
2 结 果
2.1 ETX毒素突变体原核表达载体的构建 采用引物GETXH106P-F/GETXH106P-R进行PCR扩增,扩增产物经酶切后克隆至pET-30a(+)载体上。获得的重组质粒经双酶切后电泳观察,结果如图1所示。酶切后出现大小约5 kb的载体DNA片段,以及大小约920 bp的目的基因片段,与预期相符。测序结果表明,插入的外源基因序列是正确的。将此重组质粒命名为pET30a-GETXH106P。
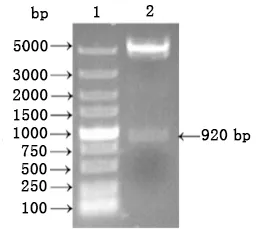
1. DL5000 DNA相对分子质量标准; 2.重组质粒pET30a-GETXH106P的NdeⅠ和Hind Ⅲ双酶切鉴定1. DL5000 DNA Marker;2. pET30a-GETXH106P digested with NdeⅠand Hind Ⅲ图1 原核表达重组质粒pET30a-GETXH106P的酶切鉴定Fig 1 Identification of recombinant prokaryotic expression plasmids pET30a-GETXH106P
2.2 ETX毒素突变体的原核表达鉴定 将重组表达质粒pET30a-GETXH106P转化至BL21(DE3)感受态细胞并诱导表达。SDS-PAGE和Western blot检测结果显示,表达的目的蛋白分子量约为39 kD,大小与预期相符。表达的rETXH106P在BL21(DE3)菌体中以可溶性和包涵体两种形式存在(图2)。图2a为重组蛋白表达的SDS-PAGE鉴定结果,如图所示,37 ℃、诱导4 h后,通过灰度扫描显示,可溶性表达的蛋白比例可达30%。综合考虑重组蛋白的表达量、可溶性及诱导时间等条件,我们确定目的蛋白最适诱导表达条件为37 ℃,诱导表达4 h,收获细胞裂解上清。图2 b为重组蛋白的Western blot鉴定结果,表达的目的蛋白能与抗His标签抗体发生反应,证明目的蛋白含有His标签,与预期相符。
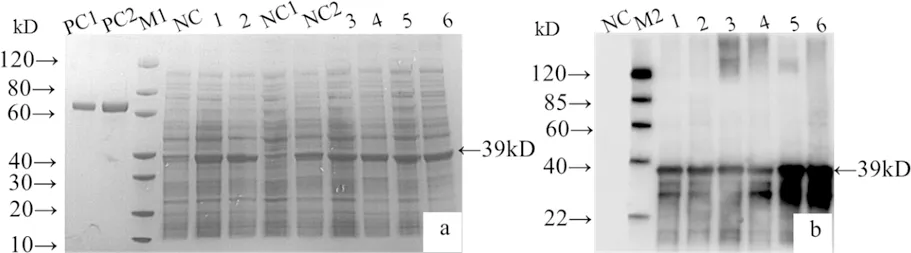
a.重组蛋白表达的SDS-PAGE鉴定;b.重组蛋白与抗His单抗的Western blotM1. 蛋白marker;M2. Western blot marker;PC1. BSA (1 μg);PC2. BSA (2 μg);NC.未诱导细胞裂解物;1. 15 ℃、16 h诱导的细胞裂解物;2. 37 ℃、4 h诱导的细胞裂解物;NC1. 未诱导细胞裂解上清;NC2. 未诱导细胞裂解沉淀;3. 15 ℃、16 h诱导的细胞裂解上清;4. 15 ℃、16 h诱导的细胞裂解沉淀;5. 37 ℃、4 h诱导的细胞裂解上清;6. 37 ℃、4 h诱导的细胞裂解沉淀a.The identification of recombinant protein expression by SDS-PAGE; b. The identification of recombinant protein with anti-His monoclonal antibody by Western blotM1. protein Marker; M2. Western blot Marker;PC1. BSA (1 μg) ; PC2. BSA (2 μg); NC. The cell lysates without induction; 1. The cell lysates induced with IPTG for 16 h at 15 ℃; 2. The cell lysates induced with IPTG for 4 h at 37 ℃; NC1. The supernatant of cell lysates without induction; NC2. The precipitation of cell lysates without induction; 3.The supernatant of cell lysates induced with IPTG for 16 h at 15 ℃; 4. The precipitation of cell lysates induced with IPTG for 16 h at 15 ℃;5. The supernatant of cell lysates induced with IPTG for 4 h at 37 ℃; 6. The precipitation of cell lysates induced with IPTG for 4 h at 37 ℃.图2 rETXH106P的原核表达与鉴定Fig 2 Prokaryotic expression and identification of rETXH106P
2.3 ETX毒素突变体的纯化与鉴定 如图3所示,按照Ni-IDA亲和层析介质试剂盒说明书对rETXH106P进行纯化,收集纯度较高的洗脱液(50 mmol/L Imidazole以及300 mmol/L Imidazole的洗脱液)进行透析,最终获得的蛋白浓度为1.5 mg/mL,纯度可达90%以上。将纯化后的rETXH106P经SDS-PAGE后转印到PVDF膜上进行Western blot检测。结果显示,rETXH106P能够与D型产气荚膜梭菌抗毒素反应(图4)。
2.4 ETX毒素突变体的毒力测定
2.4.1 对MDCK细胞的毒力测定 MDCK细胞加入各组分后继续培养24 h,显微镜下观察。5000倍稀释的天然D型产气荚膜梭菌毒素接种细胞组出现了明显的细胞病变(图5a);接种浓度为100 μg/mL、10 μg/mL rETXH106P蛋白的实验组(图5b)、接种肉肝胃酶消化汤和洗脱液的阴性对照组及空白对照组细胞均生长良好,未出现细胞病变(图5c)。

M: 蛋白Marker; 1:诱导的细胞裂解沉淀;2:诱导的细胞裂解物上清;3:上清与Ni-IDA孵育后流出液;4:无Imidazole的洗脱液;5:20 mmol/L Imidazole的洗脱液;6:50 mmol/L Imidazole的洗脱液;7:300 mmol/L Imidazole的洗脱液;8:Ni-IDA介质M: protein marker; 1: The precipitation of cell lysates induced with IPTG;2:The supernatant of cell lysates after centrifugation; 3:The flow-through from Ni-IDA resin after incubated with supernatant;4:The elution from Ni-IDA resin washed with elution buffer without Imidazole;5: The elution from Ni-IDA resin washed with elution buffer contain 20 mmol/L Imidazole); 6:The elution from Ni-IDA resin washed with elution buffer(contain 50mmol/L Imidazole); 7:The elution from Ni-IDA resin washed with elution buffer (contain 300mmol/L Imidazole); 8:The elution from Ni-IDA resin图3 rETXH106P的纯化Fig 3 Purification of rETXH106P
M. 蛋白Marker;1.未诱导的细胞裂解物;2. 纯化后的rETXH106PM:Protein Marker;1:The cell lysates without induction;2:rETXH106P after purification图4 rETXH106P与D型产气荚膜梭菌抗毒素反应的Western blot鉴定Fig 4 Interaction of rETXH106P with antitoxin serum of Clostridium perfringens type D
2.4.2 对小鼠的毒力测定 未活化和经过胰酶活化的rETXH106P,分别以1、10、100 μg/只的剂量尾静脉注射小鼠,结果显示:注射组以及蛋白溶解液和胰酶消化液两个阴性对照组小鼠,在注射后24 h均存活,未见任何异常。注射1个MLD天然毒素的小鼠,在注射后24 h内全部死亡。以上结果说明rETXH106P已成功减毒,即使经过胰酶活化后,本实验注射剂量对小鼠依然是无毒的。
2.5 ETX毒素突变体的免疫原性分析
2.5.1 血清毒素中和抗体效价的测定 结果如表1所示,经血清中和法测定,以rETXH106P制备疫苗免疫家兔后,每毫升一免抗血清可中和450~700个MLD的D型产气荚膜梭菌毒素;每毫升的二免抗血清可中和3000~4000个MLD的D型产气荚膜梭菌毒素,而佐剂对照组的兔血清对D型产气荚膜梭菌毒素无中和作用。以上结果表明,rETXH106P的免疫效力远高于现行《中华人民共和国兽药典》的规定(30个MLD/mL),是优良的制苗用候选抗原。

a: 加入5000倍稀释的天然毒素培养液后培养24 h的细胞;b1-b2:分别加入浓度为100 μg/mL及10 μg/mL的rETXH106P培养液后培养24 h的细胞;c1:蛋白洗脱液对照;c2:用于培养D型产期荚膜梭菌的肉肝胃酶消化汤对照;c3: 细胞培养基对照a: MDCK cell cultured with the toxin-containing medium of Clostridium perfringens type D with dilution 5000 for 24h;b1-b2:MDCK cell cultured with rETXH106P-containing medium with concentrate of 100μg/mL and 10μg/mL, respectively, for 24h; c1:MDCK cell cultured with elution buffer control; c2: MDCK cell cultured with anaerobic beef, liver and stomach digestive enzyme soup used by Clostridium perfringens type D; c3: Cell culture control图5 rETXH106P对MDCK细胞的影响Fig 5 The influence of rETXH106P to MDCK cell
2.5.2 攻毒保护实验 表1结果显示,在二免后21 d,对所有rETXH106P免疫组和佐剂免疫对照组的家兔,经耳缘静脉注射1个MLD剂量的天然毒素进行攻毒,结果表明,佐剂免疫对照组家兔在攻毒后5 d内全部死亡,rETXH106P免疫组家兔全部健活,未见任何不良反应。

表1 rETXH106P的免疫保护和免疫兔血清的中和效价结果Tab 1 Immunoprotection of rETXH106P and neutralizing titers of rabbit antiserum
“S”代表存活;“D”代表死亡
"S" means survived; "D" means died
3 讨 论
随着研究的深入,与产气荚膜梭菌密切相关的主要致死性外毒素的结构和致病机理越来越清晰,致死性外毒素的部分无毒区域(CPA、CPB以及CPI的C末端[13-14])或者无毒突变体(ETX和PFO[27])作为亚单位疫苗抗原已经被证实能够有效预防相应的毒血症。在无毒重组ETX亚单位疫苗的研究中,经典的无细胞毒性突变体为第106位组氨酸突变为脯氨酸的重组ETX蛋白,其安全性和免疫原性已经得到大量验证[15-17]。研究制备的rETXH106P可溶性表达量较高,可溶性比例可达30%,这可能是由于研究按照大肠杆菌偏爱的密码子,对rETXH106P进行了优化,从而为后续的大量生产以及纯化提供便利。根据已有的文献报道,50 ng/mL的天然ETX即可引起小鼠死亡,而研究结果发现6.25×106ng/kg的rETXH106P对ICR小鼠尾静脉注射,仍无致死性,证明该重组蛋白具有良好的安全性。
自然环境中对动物致病的梭菌种类较多,且常混合感染,因而梭菌病的预防多采用联苗,以达到一针多防的目的。目前我国商品化的该类疫苗均为天然毒素经甲醛脱毒后制备的类毒素疫苗,其生产过程复杂,易导致产毒不稳定。此外,该类疫苗有效抗原含量较低,制备联苗后免疫剂量过大,容易引起动物的应激反应。彭小兵等对该类疫苗2006-2015年间的检验结果进行了统计分析,结果表明:以血清中和法检验,效力不符合规定的产品共有33批,其中β毒素组分效力不符合规定(低于1 MLD)的比例最高,约为72.7%[28]。然而,鉴于此类联苗免疫剂量的限制,无法再大幅度增加β类毒素的比例。为此,产气荚膜梭菌毒素亚单位疫苗的研制显得极为重要。在一定范围内,可以最大限度增大免疫原性较差的毒素抗原,从而提高联苗的总体免疫保护作用。而研究中制备的rETXH106P,一免兔血清每毫升可中和450 MLD以上,二免兔血清每毫升可中和3000 MLD以上,效果明显优于目前的商品化疫苗。这说明ETX的第106位氨基酸突变后,毒力基本消失,但仍保留了良好的免疫原性,是我国现行D型产气荚膜梭菌毒素疫苗升级换代的理想候选疫苗抗原。
参考文献:
[1] Novak J S, Juneja V K.Clostridiumperfringens: hazards in new generation foods [J]. Innov Food Sci Emerg Technol, 2002, 3(2):127-132.
[2] Uzal F A, Freedman J C, Shrestha A,etal. Towards an understanding of the role ofClostridiumperfringenstoxins in human and animal disease [J]. Future Microbiol, 2014, 9(3):361-377.
[3] Decker M, Gomes G D, Galv?倞o A C,etal. Evaluation of a new mathematical model to describeClostridiumperfringensgrowth during the cooling of cooked ground beef [J]. Food Sci Technol, 2013, 33(3):507-512.
[4] 郑晓丽, 窦贤明, 胡道俊, 等. 产气荚膜梭菌对养牛业的危害及其防制[J]. 中国畜牧兽医, 2010, 37(8):211-214.
Zheng X L, Dou X M, Hu D G,etal. The threat, prevention and control ofClostridiumperfringensin cattle industry [J]. China Animal Husbandry and Veterinary Medicine, 2010, 37(8):211-214.
[5] 钏有科, 肖 啸, 濮永华,等. 努比亚山羊产气荚膜梭菌病的诊治[J]. 中国兽医杂志, 2014, 50(12):42-43.
Chuan Y K, Xiao X, Pu Y H,etal. Diagnosis and treatment ofClostridiumperfringensinfection in Nubian goats[J]. Chinese Journal of Veterinary Medicine, 2014, 50(12):42-43.
[6] Van I F, De B J, Pasmans F,etal.Clostridiumperfringensin poultry: an emerging threat for animal and public health [J]. Avian Pathol, 2004, 33(6):537-549.
[7] 郑晓丽, 宋振银, 倪学勤. 产气荚膜梭菌对家禽业的危害及其预防[J].中国家禽, 2008, 30(24):69-71.
Zheng X L, Song Z Y, Ni X Q. Hazards and prevention ofClostridiumperfringensto poultry industry [J]. China Poultry, 2008, 30(24):69-71.
[8] Revittmills S A, Rood J I, Adams V.Clostridiumperfringensextracellular toxins and enzymes: 20 and counting [J]. Microbiol Aus, 2015, 36(3)114-117.
[9] Niilo L.Clostridiumperfringensin animal disease: a review of current knowledge [J]. Can Vet J, 1980, 21(5):141-148.
[10] Sayeed S, Li J, Mcclane B A. Virulence plasmid diversity inClostridiumperfringenstype D isolates [J]. Infect Immun, 2007, 75(5):2391-2398.
[11] Sakurai J. Toxins ofClostridiumperfringens[J]. Rev Med Microbiol, 1995, 6(3):175-185.
[12] Cole A R, Gibert M, Popoff M,etal.Clostridiumperfringensepsilon-toxin shows structural similarity to the pore-forming toxin aerolysin [J]. Nat Struct Mol Biol, 2004, 11(8):797-798.
[13] Nagahama M, Oda M, Kobayashi K,etal. A recombinant carboxy-terminal domain of alpha-toxin protects mice againstClostridiumperfringens[J]. Microbiol Immunol, 2013, 57(5):340-345.
[14] Das S, Majumder S, Kingston J J,etal. Generation and characterization of recombinant bivalent fusion protein r-Cpib for immuno ̄therapy againstClostridiumperfringensbeta and iota toxemia [J]. Mol Immunol, 2016, 70:140-148.
[15] Alimolaei M, Golchin M, Daneshvar H. Oral immunization of mice againstClostridiumperfringens, epsilon toxin with aLacto ̄bacilluscasei, vector vaccine expressing epsilon toxoid [J]. Infect Genet Evol, 2016, 40:282-287.
[16] Li Q, Xin W, Gao S,etal. A low-toxic site-directed mutant ofClostridiumperfringenserfringens low-toxic site-directed mutant of Closenterotoxemia [J]. Hum Vaccin Immunother, 2013, 9(11):2386-2392.
[17] Dorca-Arévalo J, Pauillac S, Dlaz-Hidalgo L,etal. Correlation betweeninvitrocytotoxicity andinvivolethal activity in mice of epsilon toxin mutants fromClostridiumperfringens[J]. PLoS One, 2014, 9(7):e102417.
[18] 李 箐. 产气荚膜梭菌α、ε毒素突变体构建及应用[D]. 安徽医科大学, 2013.
Li Q. Construction of mutants ofClostridiumperfringensAlpha, epsilon toxin and it's application [D]. Anhui Medical University, 2013.
[19] Oyston P C, Payne D W, Havard H L,etal. Production of a non-toxic site-directed mutant ofClostridiumperfringensepsilon-toxin which induces protective immunity in mice [J]. Microbiology, 1998, 144 (2):333-341.
[20] 罗维佳, 邓 晨, 李衍常, 等. 串联杂种泛素结合结构域蛋白(ThUBD)在大肠杆菌中的可溶性高效表达[J]. 军事医学, 2016, 40(10):795-800.
Luo W J, Dong C, Li Y C,etal. Soluble expression of tandem hybrid ubiquitin-binding domains(ThUBD)In prokaryotic cytoplasm of Escherichia coli BL21(DE3) [J]. Military Medical Sciences, 2016, 40(10):795-800.
[21] 于 蕊, 王 双, 余云舟, 等. B型肉毒毒素保护性抗原He在大肠杆菌中的可溶性高表达[J]. 生物技术通讯, 2008, 19(3):365-367.
Yu R, Wang S, Yu Y Z,etal. High-level and soluble expression of Botulinum Neurotoxin serotype B protective antigen HC domain in Escherichia coli[J]. Letter in Biotechnology, 2008, 19(3):365-367.
[22] Hunter S E, Clarke I N, Kelly D C,etal. Cloning and nucleotide sequencing of theClostridiumperfringensepsilon-toxin gene and its expression inEscherichiacoli[J]. Infect Immun, 1992, 60(1):102-110.
[23] Minami J, Katayama S, Matsushita O,etal. Lambda-toxin ofClostridiumperfringensactivates the precursor of epsilon-toxin by releasing its N- and C-terminal peptides [J]. Microbiol Immunol, 1997, 41(7):527-535.
[24] Freedman J C, McClane, B A, Uzal, F A. New insights intoClostridiumperfringensepsilon toxin activation and action on the brain during enterotoxemia [J]. Anaerobe , 2016, 41: 27-31.
[25] Bokori-Brown M, Savva C G, Sp F D C,etal. Molecular basis of toxicity ofClostridiumperfringensepsilon toxin [J]. FEBS J, 2011, 278(23):4589.
[26] 中国兽药典委员会. 中华人民共和国兽药典2015年版三部[S]. 北京:中国农业出版社,2016:45-46.
Commission of Chinese Veterinary Pharmacopoeia.Veterinary Pharmacopoeia of the People's Repubilc of China Volume Ⅲ 2015 Edition[S]. Beijing: China Agricultural Press, 2016:45-46.
[27] Verherstraeten S, Goossens E, Valgaeren B,etal. Non-toxic perfringolysin O and α-toxin derivatives as potential vaccine candidates against bovine necrohaemorrhagic enteritis[J]. Veteri ̄nary Journal, 2016, 217:89.
[28] 彭小兵, 田冬青, 彭国瑞, 等. 产气荚膜梭菌β毒素的表达及其抗血清的制备[J]. 畜牧与兽医, 2015, 47(10): 93-96.
Peng X B, Tian D Q, Peng G R,etal. Expression ofClostridiumperfringenserfringensm perfringension of 33antiserum[J]. Animal Husbandry and Veterinary Medicine, 2015, 47(10):93-96.
