苗药白接骨醇提物对耐药性猪源大肠杆菌体外抑菌效果观察
2018-06-23龙征荣熊绍斌杨昌海赵婵娟
张 森,龙征荣,欧 婧,熊绍斌,杨昌海,赵婵娟
(1.黔东南民族职业技术学院,贵州凯里 556000; 2.贵州省雷山县丹江镇农业服务中心,贵州雷山557100;3.重庆三峡职业技术学院,重庆万州)
猪致病性大肠杆菌常引发猪场发生仔猪黄痢、白痢和水肿病,尤其仔猪黄痢,发病日龄小,发病急,常引起猪腹泻、脱水、电解质紊乱,甚至死亡。日龄越小发病率越高,情况越严重,管理不善的猪场极易引起仔猪大量死亡,给猪场造成巨大的经济损失,是威胁我国养猪业的主要疾病之一。近几十年来,抗生素和抗菌药在畜牧生产上长期或不规范使用,导致生产中大肠杆菌耐药现象严重。病原菌长期处于抗生素和抗菌药的选择压力下,可能会通过质粒和整合子将耐药基因在相同或不同种属细菌之间广泛转移,进而导致兽医临床上不断出现多重耐药的“超级”大肠杆菌菌株[1-3],极大的增加了该病的防控难度。中草药的应用在我国已有千年的历史,现代药理研究表明,中草药中的某些活性成分具抗菌、抗炎、提高免疫、抗氧化等多种活性作用,与抗生素和抗菌药相比,中草药成分复杂,各成分之间具有一定的相互作关系,通常会表现为整体量效作用,而且呈现多作用靶点,不易产生耐药性[4]。中草药来源广泛,安全性高,毒性小,因此,在畜牧生产上有良好的应用前景。苗药与中药具有很高的相似性,是苗族人民长期以来对苗族生存环境中植物药用作用的经验总结,具有很高的临床应用参考价值。白接骨为爵床科白接骨属草本植物,是黔东南苗族地区广泛用于止血、扭伤、疖肿等疾病的民间常用草药,《贵州民间药物》记载了该草药的主要疗效,但其现代药理研究尚未见报道,本试验观察白接骨醇提物对猪大肠杆菌的体外抑制作用,以期为开发利用白接骨这一苗药防治猪大肠杆菌病提供实验依据。
1 材料与方法
1.1 供试药物与菌株 试验药物:白接骨(全草,2016年8月份采集)由黔东南民族职业技术学院植物组织培养中心鉴定为正品。试验菌株:质控菌 猪大肠杆菌标准株[CVCC1510,血清型O9:K88ac],购自中国兽医药品监察所;临床分离菌株:猪腹泻致病大肠杆菌[EC1],由贵州大学兽医微生物实验室分离、鉴定、保存、提供。
1.2 主要仪器与试剂 SW-CJ-2D净化工作台(苏州净化);LS-30高压灭菌锅(上海博讯实业有限公司医疗设备厂);KJ14麦氏比浊管(北京哲成科技有限公司);JA003电子秤(上海舜宇横平科学仪器有限公司);DHP-500电热恒温培养箱(金坛大地自动化仪器厂);DHG-9075A电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司);营养肉汤培养基(杭州百思生物技术有限公司,批号:20170508001),95%乙醇为分析纯(国药集团化学试剂有限公司),微生物药敏试纸(温州市康泰生物科技有限公司)。
1.3 方法
1.3.1 药液制备 将采集的药物置恒温鼓风干燥箱中,在45 ℃条件下烘干。将烘干的药物粉碎成粗粉,准确称取10 g,放入三角烧瓶中,加100 mL 80%乙醇,置于超声波机中超声助溶1 h,减压抽滤提取液。按此方法提取3次,合并3次提取液,旋转蒸发仪回收乙醇,给浓缩液中加入吐温-80 0.5 mL助溶,用蒸馏水定容至50 mL。最终药液生药浓度为200 mg/mL。过滤除菌,备用。
1.3.2 菌液的制备 按无菌操作法,将保存的菌种划线接种于1%琼脂营养肉汤培养基上,37 ℃条件下培养18 h,挑取单个菌落接种于5 mL无菌营养肉汤液体培养基中,37 ℃条件下培养12 h,用灭菌的肉汤培养基稀释至0.5麦氏浊度,即约1.5×108CFU/mL。取适量菌液用灭菌肉汤培养基进行100倍稀释,菌悬液浓度约1.5×106CFU/mL,备用。
1.3.3 耐药性分析 采用试纸扩散法(K-B法),分别吸取150 μL各配制备用的细菌液至1%的琼脂肉汤培养板上,用“L”棒涂布均匀,在超净工作台上室温条件下放置5 min,等距离放置药敏试纸片(药敏试纸直径为6.35 mm),静置10 min使其和培养板表面严实无缝。将培养皿置37 ℃培养18 h,观察其抑菌圈有无及直径大小。
1.3.4 苗药白接骨醇提物抑菌作用分析 采用管碟法[5],按无菌操作要求,分别吸取150 μL各配制备用的细菌液至1%的琼脂肉汤培养板上,用“L”棒涂布均匀,在超净工作台上室温条件下放置5 min,等距离放置灭菌牛津杯(规格10 mm×8 mm×6 mm),静置10 min使其和培养板表面严实无缝。给每个牛津杯中加入相应的药物100 μL,4 ℃放置8 h,使药物扩散,然后将培养皿置37 ℃培养18 h,观察,并用游标卡尺十字法测量抑菌圈直径,取平均值。每种药物和菌株平行做3次重复。结果判定:抑菌圈<10 mm为不敏感,10~19 mm为中度敏感,≥20 mm为高度敏感[6]。
1.3.5 苗药白接骨MIC和MBC的测定 采用微量法[7]。按操作方法,取一次性无菌96孔培养板,每列8孔,每孔加100 μL肉汤培养基,吸取100 μL药物加入第1孔,混匀后,吸取100 μL到第2孔,以此类推至第10孔,混匀后,弃100 μL,每孔接种10 μL菌液;第11孔加入10 μL无菌蒸馏水,为阴性对照,第12孔接种10 μL菌液,为细菌生长对照。将96孔培养板加盖置37 ℃恒温培养箱中培养18 h,观察细菌生长情况。结果判定:与阴性对照对比,如浑浊或有沉淀,则判断为有菌生长;如透明度与阴性对照相同,则判断无菌生长。以无菌生长所对应的最低药物浓度为该药物对此菌的MIC。然后,将每孔培养液划线接种1%琼脂营养肉汤培养板,37 ℃培养18 h,观测细菌生长情况,无菌落生成对应的最低药物浓度为该药物对此菌的MBC。每种菌株做3次平行重复。
2 结果与分析
2.1 猪大肠杆菌耐药性分析 通过K-B试纸法观察了EC1对4种常用抗菌药物的敏感性,结果如图1所示,4种抗菌药物对CVCC1510标准株均出现了直径不小的抑菌圈,而在EC1,仅庆大霉素出现抑菌圈,甲氧苄啶/磺胺甲恶唑、头孢曲松、环丙沙星均无抑菌圈出现。测量统计如表1所示,4种抗菌药物对CVCC1510抑菌圈平均直径均超过了20 mm,表现高度敏感。而对EC1的抑菌圈平均直径除庆大霉素达到了22.56±0.63 mm外,其余均≤6.35 mm。由此说明,临床上分离的EC1菌株具有多重耐药性。
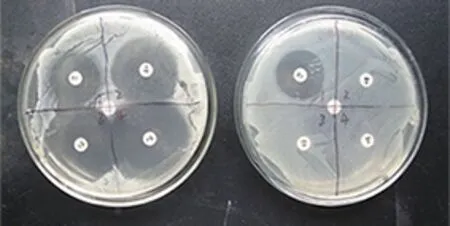
左为CVCC1510标准菌株,右为EC1临床分离菌株;"1"为庆大霉素,"2"为甲氧苄啶/磺胺甲恶唑,"3"为头孢曲松,"4"为环丙沙星,中间为生理盐水对照。Note: The result of left dish is CVCC1510, and right is EC1; "1"is the result of gentamicin, "2"is methoxybenzymidine/sulfamethoxazole, "3"is ceftriaxone, "4"is ciprofloxacin and the middle is negative control.图1 常用抗生素对猪大肠杆菌抑菌效果Fig 1 The effect of common antibiotics on E.coli from swine

药物抑菌圈直径CVCC1510EC1庆大霉素24.10±0.3822.56±0.63甲氧苄啶/磺胺甲恶唑27.39±0.65≤6.35头孢曲松32.66±0.56≤6.35环丙沙星33.38±0.39≤6.35对照≤6.35≤6.35
2.2 苗药白接骨醇提物对大肠杆菌抑菌作用 采用管碟法观察白接骨对大肠杆菌抑菌作用,结果如图2所示,白接骨醇提物对CVCC1510菌株和EC1菌株具有较大的抑菌圈,并且3个重复的结果重复性高。1%吐温-80溶液对2菌株均无明显的抑菌圈。经测量统计,结果如表2所示,白接骨醇提物对CVCC1510标准菌株的抑菌圈直径平均值达33.20±0.82 mm,对EC1的抑菌圈直径平均值达33.78±0.38 mm,而1%吐温-80溶液和灭菌蒸馏水对照在牛津杯内径内也有细菌生长,说明1%浓度的吐温-80对细菌的生长没有明显的影响。因此图2、表2结果表明,白接骨醇提物对致病性大肠杆菌有较强的体外抑制作用。
2.3 MIC测定结果 采用微量稀释法定量测定白接骨对大肠杆菌的MIC,结果如表3所示,CVCC1510和EC1与倍比稀释的白接骨醇提物共育,第8个稀释度(生药浓度0.78 mg/mL)培养液透明度眼观基本与对照相似,在第9个稀释度呈现明显的肉眼可见的浑浊,三个重复结果一致,因此判定白接骨对两株大肠杆菌的MIC均为0.78 mg/mL,表现较强的抑菌效果。
2.4 MBC测定结果 对2.2项结果中每孔培养液无菌操作下进行划板接种,在37 ℃培养12 h,结果如图3所示,第8孔培养液划线接种的细菌生长相对于第9孔减少,但也有明显的肉眼可见的细菌生长。而第7孔(含生药浓度1.56 mg/mL)则基本无细菌生长,因此,判定白接骨对CVCC1510和EC1的MBC均为1.56 mg/mL。
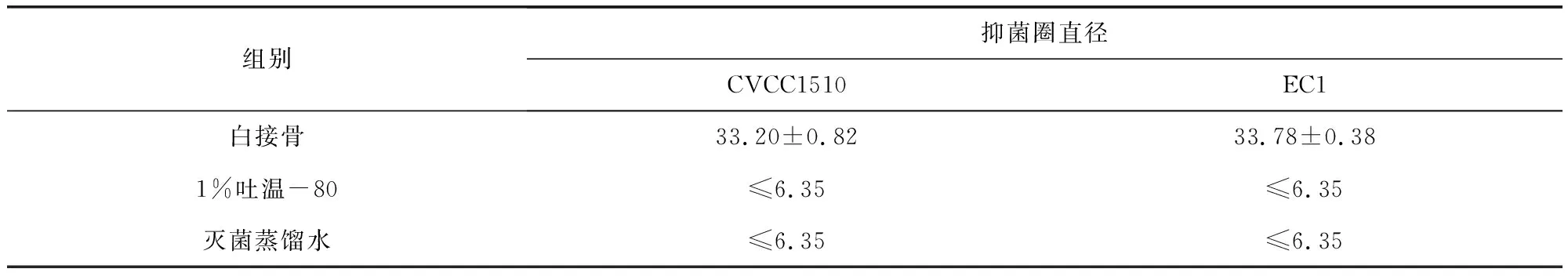
表2 苗药白接骨醇提物对大肠杆菌抑菌作用(mm)Tab 2 the effect of Asystasiella neesiana (Wall.) Lindau alcohol extraction on E.coli (unit: mm)

上排为白接骨对CVCC1510抑菌作用3个重复,下排为白接骨对EC1抑菌作用3个重复;"1"为白接骨醇提物(200mg/mL);"2"为1%吐温-80溶液对照;"3"为灭菌蒸馏水对照。Note: Above row is the effect of Asystasiella neesiana (Wall.) Lindau on CVCC1510 for 3 times repetitions, bottom row is the effect of Asystasiella neesiana (Wall.) Lindau on EC1 for 3 times repetitions. "1"is Asystasiella neesiana (Wall.) Lindau alcohol extraction (200mg/mL), "2"is 1% tween-80 control, "3"is negative control.图2 白接骨醇提物对大肠杆菌的抑菌作用Fig 2 the effect of Asystasiella neesiana (Wall.) Lindau alcohol extraction on E.coli

组别123456789101112MIC/(mg·mL-1)CVCC1510-1 --------++-+0.78CVCC1510-2--------++-+0.78CVCC1510-3--------++-+0.78EC1-1--------++-+0.78EC1-2--------++-+0.78EC1-3--------++-+0.78
"1~10"是药物从1:2(100mg/mL)-1:2048(0.20mg/mL)浓度倍比稀释;"11"为阴性对照;"12"为细菌生长对照;"-"为培养液澄清;"+"为培养液浑浊。
"1~10"were the medicine dilutions from 1:2(100mg/mL)-1:2048(0.20mg/mL),"11" was negative control,"12"was positive control.

上排为白接骨对CVCC1510的3个重复,下排为白接骨对EC1的3个重复;1~12分别对应2.2项部分1~12孔培养物Above row is the effect of Asystasiella neesiana (Wall.) Lindau on CVCC1510 for 3 times repetitions, bottom row is the effect of Asystasiella neesiana (Wall.) Lindau on EC1 for 3 times repetitions;"1~12" were the culture result of suspension from 2.2 part 1~12 culture hole.图3 苗药白接骨醇提物对大肠杆菌MBC结果Fig 3 the MBC of Asystasiella neesiana (Wall.) Lindau alcohol extraction on E.coli
3 讨论与小结
大肠杆菌耐药性问题凸显,多重耐药现象日趋严重。岳秀英等[8]报道四川省2009-2014年共2954株猪、鸡源大肠杆菌对抗生素的耐药率依次为四环素(92.32%)>磺胺异噻唑(91.96%)>氨苄西林(91.25%)>复方新诺明(87.56%)>多西环素(77.67%)>氟苯尼考(73.97%)>大观霉素(69.91%)>恩诺沙星(66.00%)>阿莫西林/克拉维酸(61.10%)>氧氟沙星(59.39%)>庆大霉素(57.82%)>多粘菌素E(42.53%)>头孢噻呋(40.40%)。彭苗苗等[9]从湖南株洲、益阳猪场分离9株大肠杆菌,均含有耐药基因GyrA、ParC、TetA和TetB,其中7株大肠杆菌对10种以上抗生素耐药,对氨苄西林、青霉素、阿莫西林、红霉素的耐药率达100%。对四环素、多西环素的耐药率达到88.9%。本试验所用大肠杆菌(EC1)菌株是贵州大学在贵州猪场分离的猪腹泻致病菌。虽然仅检测了其对庆大霉素、甲氧苄啶/磺胺甲恶唑、头孢曲松、环丙沙星的敏感性,但该菌株仅对庆大霉素出现抑菌圈,其余3种均无明显的抑菌圈,可定性说明该分离菌株具有多重耐药性。
近年来,中药体外抑菌大肠杆菌的研究较多,黄连、大黄、白花蛇舌草、五倍子、丁香、黄芩、夏枯草、虎杖等均有体外抑制大肠杆菌的报道,在众多报道中,黄连、大黄、五倍子的作用较强,黄连、大黄水煎剂对大肠杆菌MIC为7.81 mg/mL)[10-11],五倍子醇提液MIC为0.39 mg/mL[12],但也有报道其MIC仅为15.6 mg/mL[13]。本试验通过管蝶法联合微量法稀释法和琼脂平板计数法研究了苗药白接骨对大肠杆菌的体外抑制作用,结果显示,白接骨醇提物对标准大肠杆菌和耐药性大肠杆菌表现了较强体外抑制作用,MIC和MBC分别达到了0.78 mg/mL和1.56 mg/mL,其体外抑菌效果明显优于报道的常见中药。李君华[14]通过观察24种常用中药饮片水煎液对大肠杆菌多重耐药菌株和敏感菌株的抑菌效果,得出结论,相对于敏感菌,耐药菌对中药更为敏感。但是,本试验中白接骨醇提物对EC1菌株和标准菌株的MIC和MBC结果一致,并没有表现出对耐药菌株更敏感。
目前常采用K-B试纸法、打孔法和管碟法定性观察药物的体外抑菌效果。中草药成分复杂,其具有抗菌作用的成分可能仅是其众多化学成分中的极少数,含量有限,用直径6.35 mm左右的滤纸直接浸泡入中草药水提或醇提粗提液制作药敏试纸,试纸药物量少,而且药量不精确。管碟法药量控制范围大,而且加药量比较准确,与打孔法相比更便捷。
中药醇提液在蒸馏乙醇浓缩后往往会出现浑浊和浓稠现象,影响药物在琼脂培养板上的扩散,在微量法或试管法测定MIC时,影响培养液的透明度,不利于细菌生长情况观察,所以有效解决中药提取液透明度是中药抑菌试验的重要环节。大多数中药体外抑菌文献对此问题表述不清楚,刘瑶[15]等在观察苗药大乌泡叶提取物的体外抑菌作用时,用10%二甲基亚砜(DMSO)助溶,本试验中白接骨醇提物在蒸馏乙醇后出现浑浊,用DMSO助溶,效果不理想,使用1%吐温-80助溶,药物透明度大大提高,基本解决了药物对培养基透明度的影响和药物在琼脂培养基上的扩散问题,并且设置1%吐温-80对照,结果显示,1%浓度的吐温-80对细菌生长没有明显的影响。
本试验仅是对苗药白接骨药理作用的初步探讨,结果显示,白接骨具有很强的体外抑制猪源敏感和耐药大肠杆菌的作用,具有很好的开发应用前景。现代研究表明,中草药体外抑菌是通过其某些活性成分直接作用于细菌结构和干扰细菌代谢而抑菌杀菌[16],白接骨的抑菌活性成分和抗菌机理尚需进一步的研究。此外,中药抗耐药菌的作用机制主要有抑制菌体内酶的活性;改变细菌细胞膜通透性;抑制细菌外排泵系统,抑制细菌生物被膜的形成及对细菌质粒的消除作用[17],白接骨是通过何种途径实现抑制耐药大肠杆菌的,尚需进一步研究。
参考文献:
[1] 王永芬,席 磊,边传周,等. 猪致病性大肠杆菌耐药质粒检测及其中药消除作用研究[J].中国预防兽医学报,2011,33(12):932-935.
Wang Y F, Xi L, Bian C Z,etal. Drug resistance plasmid detection in pathogenic swineEscherichiaColiand elimination with traditional Chinese herbs[J]. Chinese Journal of Preventive Veterinary Medicine, 2011,33(12):932-935.
[2] 段玉平,徐兴然,曾忠良,等. 猪源大肠杆菌整合子与耐药性的相关性研究[J]. 中国兽药杂志,2009,43(5):24-26.
Duan Y P, Xu X R, Zeng Z L,etal. Incestigation of the relationship between integrons and resistance ofE.colifrom swine farms[J]. Chinese Journal of Veterinary Drug, 2009,43(5):24-26.
[3] 李金清. 致病性大肠杆菌耐药性与其质粒相关性研究[J]. 青海畜牧兽医杂志,2011,41(3):7-9.
Li J Q. Study on correlation of resistance to drugs of pathogenicEscherichiacoliwith its plasmid[J]. Chinese Qinghai Journal of Animal and Veterinary Science, 2011,41(3):7-9.
[4] 韩 飞,幸仁汇,陈琳琦,等. 中药抗细菌耐药性的研究进展[J].中国中药杂志,2016,41(5):813-817.
Han F, Xing R H, Chen L Q,etal. Research progress of anti-drug resistance in traditional Chinese medicine[J]. China Journal of Chinese Material Medica, 2016,41(5):813-817.
[5] 马绪荣,苏德模.药品微生物学检验手册[M].北京:科学出版社,2000:265.
Ma X R, Su D M. Manual of medicinal microbiological detection[M]. Beijing: China Science Publishing, 2000:265.
[6] 杜 锐、韩文瑜、雷连成. 金黄色葡萄球菌中草药抑制剂的筛选研究[J], 中国兽药杂志,2006,40(9):10-13.
Du R, Han W Y, Lei L C. Screening the Chinese herbal medicine bacterial inhibitor onStaphylococcusaureus[J]. Chinese Journal of veterinary Drug, 2006,40(9):10-13
[7] 陈 奇.中药药理研究方法学[M].北京:人民卫生出版社,2011: 333-334.
Chen Q. Research methods in pharmacology of Chinese materia medica[M].Beijing: People's Medical Publishing House, 2011: 333-334.
[8] 岳秀英,葛 荣,吴晓岚,等. 四川省猪、鸡源大肠杆菌对抗生素耐药性研究[J]. 中国兽医杂志,2017,53(1):93-95.
Yue X Y, Ge R, Wu X L,etal. Research of drug resistance ofEscherichiacolifrom swine and chicken in Sichuan province[J]. Chinese Journal of Veterinary medicine, 2017,53(1):93-95.
[9] 彭苗苗,邱美珍,王 慧,等. 猪源大肠杆菌耐药质粒图谱及耐药性分析[J]. 激光生物学报,2017,26(2):183-1888.
Peng M M, Qiu M Z, Wang H,etal. Analysis of resistance plasmid profiles and drug resistance ofEscherichiacolifrom swine[J]. Acta Laser Biology Sinica, 2017,26(2):183-1888.
[10] 司红彬,梁松林,许桂芹,等.4味中药及其与抗菌药的复方制剂的MIC测定[J]. 中国兽药杂志,2006,40(2):31-34.
Si H B, Liang S L, Xu G Q,etal. MICs of Chinese traditional medicine and their compounds with antibiotics determined by bacteriostatic testinvitro[J]. Chinese Journal of veterinary Drug, 2006,40(2):31-34.
[11] 王俊丽,张要齐,孙雪峰,等.18种中药对猪大肠杆菌的体外抑菌活性的测定方法比较[J].安徽农业科学,2012,40(26):12947-12948.
Wang J L, Zhang Y Q, Sun X F,etal. Study on theinvitrobacteriostatic test of 18 kinds of traditional Chinese herbs against swineE.coli[J].Journal of Anhui Agri. Sci, 2012,40(26):12947-12948.
[12] 王亚萍,陈 锴,李宝莉,等.中药体外抑制大肠杆菌实验研究[J].中医学报,2017,32(4):606-609.
Wang Y P, Chen K, Li B L,etal. Experimental study on the inhibitory effect of some Chinese herbal medicine onEscherichiacoliinvitro[J]. Acta Chinese Medicine, 2017,32(4):606-609.
[13] 肖莉春,孔祥峰,黄明钱,等. 中药提取物对猪源耐药大肠杆菌分离株的抑制作用[J]. 江西农业大学学报,2013,35(6):1248-1254.
Xiao L C, Kong X F, Huang M Q,etal. Antimicrobial activities of Chinese herb extracts against antibiotic-resistant isolates ofE.colifrom swine farms[J]. Acta Agriculture Universitatis Jiangxiensis, 2013,35(6):1248-1254.
[14] 李君华.中药饮片对多重抗生素耐药细菌的抑菌作用[J].中国保健营养,2014,5:2418-2419.
Li J H. The bacteriostasis of Chinese medicine in multiple-resistant bacteria[J]. China Health Care﹠Nutrition, 2014,5:2418-2419.
[15] 刘 瑶,蔡 进,陈 瑞,等. 苗药大乌泡叶提取物的体外抑菌作用考察[J].中国药房,2017,28(1):72-75.
Liu Y, Cai J, Chen R,etal. Study oninvitroantibacterial effect of extracts form Miao medicine Rubus multibracteatus leaves[J]. China Pharmacy, 2017,28(1):72-75.
[16] 王德志,张 敏,武 瑞. 中草药抑制耐药性大肠杆菌的研究进展[J].中国畜牧兽医,2009,36(3):140-142.
Wang D Z, Zhang M, Wu R. Advance of the inhibition effects of Chinese medicine on drug-resistanceEscherichiacoli[J]. China Animal Husbandry﹠Veterinary Medicine, 2009,36(3):140-142.
[17] 崔煦然,赵京霞,郭玉红,等.细菌耐药背景下中药抗菌作用研究进展[J].世界中医药,2016,11(10):1940-1944.
Cui X R, Zhao J X, Guo Y H,etal. Advances of researches on antibiosis function of traditional Chinese medicine with background of bacterial resistance[J]. World Chinese Medicine, 2016,11(10):1940-1944.
